Описание препарата Лирика® (капсулы, 150 мг) основано на официальной инструкции, утверждено компанией-производителем в 2014 году
Дата согласования: 30.06.2014
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Аналоги (синонимы) препарата Лирика®
- Заказ в аптеках Москвы
Фотографии упаковок

30.06.2014
Действующее вещество
ATX
Фармакологическая группа
Нозологическая классификация (МКБ-10)
Список кодов МКБ-10
- F41.1 Генерализованное тревожное расстройство
- G40.0 Локализованная (фокальная) (парциальная) идиопатическая эпилепсия и эпилептические синдромы с судорожными припадками с фокальным началом
- G40.1 Локализованная (фокальная) (парциальная) симптоматическая эпилепсия и эпилептические синдромы с простыми парциальными припадками
- G40.2 Локализованная (фокальная) (парциальная) симптоматическая эпилепсия и эпилептические синдромы с комплексными парциальными судорожными припадками
- G62.9 Полиневропатия неуточненная
- M79.1 Миалгия
- R52.2 Другая постоянная боль
Состав
| Капсулы | 1 капс. |
| активное вещество: | |
| прегабалин | 25 мг |
| 75 мг | |
| 150 мг | |
| 300 мг | |
| вспомогательные вещества: лактозы моногидрат — 35/8,25/16,5/33 мг; крахмал кукурузный — 20/8,375/16,75/33,5 мг; тальк — 20/8,375/16,75/33,5 мг | |
| состав капсулы | |
| корпус: титана диоксид (2,4423/2,4423/2,4423/2,4423%), желатин (для всех дозировок — до 100%) | |
| крышечка: краситель железа оксид красный (для дозировки 75 мг — 1,7361%, для дозировки 300 мг — 0,7361%); титана диоксид (2,4423/0,409/2,4423/0,409%); желатин (для всех дозировок — до 100%) | |
| чернила: шеллак (24–27%); этанол (23–26%); изопропанол (0,5–3%); бутанол (0,5–3%); пропиленгликоль (3–7%); аммиака раствор концентрированный (1–2%); калия гидроксид (0,05–0,1%); вода очищенная (15–18%); краситель железа оксид черный (24–28%) |
Описание лекарственной формы
Капсулы, 25 мг: твердые, желатиновые, размер №4, с крышечкой и корпусом белого цвета. Черными чернилами на корпусе капсулы указаны дозировка и код продукта («PGN 25»), на крышечке — «Pfizer».
Капсулы, 75 мг: твердые, желатиновые, размер №4, с крышечкой от красно-коричневого до темно-красно-коричневого* цвета и корпусом белого цвета. Черными чернилами на корпусе капсулы указаны дозировка и код продукта («PGN 75»), на крышечке — «Pfizer».
Капсулы, 150 мг: твердые, желатиновые, размер №2, с крышечкой белого цвета и корпусом белого цвета. Черными чернилами на корпусе капсулы указаны дозировка и код продукта («PGN 150»), на крышечке — «Pfizer».
Капсулы, 300 мг: твердые, желатиновые, размер №0, с крышечкой от красно-коричневого до темно-красно-коричневого цвета* и корпусом белого цвета. Черными чернилами на корпусе капсулы указаны дозировка и код продукта («PGN 300»), на крышечке — «Pfizer».
Содержимое капсулы — порошок от белого до почти белого цвета.
* В оригинальных сертификатах производителя данные цвета описаны как: «от красно-коричневого до темно-красно-коричневого» — «orange»; «от светло-красно-коричневого до красно-коричневого» —«light orange», что соответствует цвету пантонов сравнения, используемых в Европейском Союзе при проведении данного вида анализа
Фармакологическое действие
Фармакологическое действие
—
противоэпилептическое.
Фармакодинамика
Действующим веществом является прегабалин — аналог ГАМК — (S)-3-(аминометил)-5-метилгексановая кислота.
Механизм действия
Было установлено, что прегабалин связывается с дополнительной субъединицей (α-2-дельта-протеин) потенциалзависимых кальциевых каналов в ЦНС, необратимо замещая (3Н)-габапентин. Предполагается, что такое связывание может способствовать проявлению его анальгетического и противосудорожного эффектов.
Нейропатическая боль
Эффективность прегабалина отмечена у больных с диабетической нейропатией и постгерпетической невралгией.
Установлено, что при приеме прегабалина курсами до 13 нед по 2 раза в сутки и до 8 нед по 3 раза в сутки, в целом риск развития побочных эффектов и эффективность препарата при приемах по 2 или по 3 раза в сутки одинаковы.
При приеме курсом продолжительностью до 13 нед боль уменьшалась в течение 1-й нед, а эффект сохранялся до конца лечения.
Отмечалось уменьшение индекса боли на 50% у 35% больных, получавших прегабалин, и 18% больных, принимавших плацебо. Среди пациентов, не испытывавших сонливости, эффект такого снижения боли отмечался у 33% больных группы прегабалина и 18% больных группы плацебо. У 48% пациентов, принимавших прегабалин, и у 16% пациентов, принимавших плацебо, возникала сонливость.
Фибромиалгия
Выраженное снижение болевой симптоматики, связанной с фибромиалгией, отмечается при применении прегабалина в дозах от 300 до 600 мг/сут. Эффективность доз 450 и 600 мг/сут сравнима, однако переносимость 600 мг/сут обычно хуже.
Также применение прегабалина связано с заметным улучшением функциональной активности пациентов и снижением выраженности нарушений сна. Применение прегабалина в дозе 600 мг/сут приводило к более выраженному улучшению сна по сравнению с дозой 300–450 мг/сут.
Эпилепсия
При приеме препарата в течение 12 нед по 2 или 3 раза в сутки отмеченные риск развития побочных эффектов и эффективность препарата одинаковы. Уменьшение частоты судорог начиналось в течение 1-й нед.
Генерализованное тревожное расстройство
Уменьшение симптоматики генерализованного тревожного расстройства отмечается на 1-й нед лечения. При применении препарата в течение 8 нед у 52% пациентов, получавших прегабалин, и у 38% пациентов, получавших плацебо, отмечалось 50% уменьшение симптоматики по шкале тревожности Гамильтона (HAM-A).
Фармакокинетика
Параметры фармакокинетики прегабалина в равновесном состоянии у здоровых добровольцев, больных эпилепсией, получавших противоэпилептическую терапию, и пациентов, получавших его по поводу хронических болевых синдромов, были аналогичны.
Всасывание. Прегабалин быстро всасывается натощак. Tmax препарата в плазме — 1 ч как при однократном, так и повторном применении. Биодоступность прегабалина при приеме внутрь составляет ≥90% и не зависит от дозы. При повторном применении Css достигается через 24–48 ч. При применении препарата после приема пищи Cmax снижается примерно на 25–30%, а Tmax увеличивается приблизительно до 2,5 ч. Однако прием пищи не оказывает клинически значимое влияние на общее всасывание прегабалина.
Распределение. Vd прегабалина после приема внутрь составляет примерно 0,56 л/кг. Препарат не связывается с белками плазмы.
Метаболизм. Прегабалин практически не подвергается метаболизму. После приема меченного прегабалина примерно 98% радиоактивной метки определяется в моче в неизмененном виде. Доля N-метилированного производного прегабалина, который является основным метаболитом, обнаруживаемым в моче, составляет 0,9% от дозы. Не отмечены признаки рацемизации S-энантиомера прегабалина в R-энантиомер.
Выведение. Прегабалин выводится в основном почками в неизмененном виде.
Средний T1/2 составляет 6,3 ч. Клиренс прегабалина из плазмы и почечный клиренс прямо пропорциональны клиренсу креатинина (см. Нарушение функции почек). У больных с нарушенной функцией почек и пациентов, находящихся на гемодиализе, необходима коррекция дозы (см. «Способ применения и дозы», табл. 1).
Линейность/нелинейность. Фармакокинетика прегабалина в диапазоне рекомендуемых суточных доз носит линейный характер, межиндивидуальная вариабельность низкая (<20%). Фармакокинетику препарата при повторном применении можно предсказать на основании данных приема единичной дозы. Следовательно, необходимости в регулярном мониторировании концентрации прегабалина нет.
Особые группы пациентов
Пол. Не оказывает клинически значимое влияние на концентрацию прегабалина в плазме.
Нарушение функции почек. Клиренс прегабалина прямо пропорционален клиренсу креатинина. Учитывая, что препарат в основном выводится почками, у больных с нарушенной функцией почек рекомендуется снизить дозу прегабалина. Кроме того, прегабалин эффективно удаляется из плазмы при гемодиализе (после 4-часового сеанса гемодиализа концентрации прегабалина в плазме снижаются примерно на 50%), после гемодиализа необходимо назначить дополнительную дозу препарата (см. «Способ применения и дозы», табл. 1).
Нарушение функции печени. Фармакокинетика прегабалина у больных с нарушением функции печени специально не изучалась. Прегабалин практически не подвергается метаболизму и выводится в основном в неизмененном виде с мочой, поэтому нарушение функции печени не должно существенно изменять концентрации препарата в плазме.
Пожилые пациенты (старше 65 лет). Клиренс прегабалина с возрастом имеет тенденцию к снижению, что отражает возрастное снижение клиренса креатинина. Пожилым людям с нарушенной функцией почек может потребоваться снижение дозы препарата (см. «Способ применения и дозы», табл. 1).
Показания
- нейропатическая боль у взрослых;
- эпилепсия (в качестве дополнительной терапии у взрослых с парциальными судорожными приступами, сопровождающимися или не сопровождающимися вторичной генерализацией);
- генерализованное тревожное расстройство у взрослых;
- фибромиалгия у взрослых.
Противопоказания
- повышенная чувствительность к действующему веществу или любому другому компоненту препарата;
- редкие наследственные заболевания, в т.ч. непереносимость галактозы, лактазная недостаточность и нарушение всасывания глюкозы/галактозы;
- детский и подростковый возраст до 17 лет включительно (нет данных по применению).
С осторожностью: почечная недостаточность (см. «Способ применения и дозы»); сердечная недостаточность (см. «Побочные действия»); возможное наличие редких наследственных заболеваний (см. «Особые указания»). В связи с зарегистрированными единичными случаями бесконтрольного применения прегабалина, его необходимо назначать с осторожностью у пациентов с лекарственной зависимостью в анамнезе. Такие пациенты нуждаются в пристальном медицинском наблюдении во время лечения препаратом.
Применение при беременности и кормлении грудью
Адекватных данных о применении прегабалина при беременности нет.
В экспериментальных исследованиях на животных препарат оказывал токсическое действие на репродуктивную функцию. В связи с этим прегабалин можно назначать при беременности только в том случае, если предполагаемая польза для матери явно перевешивает возможный риск для плода.
При лечении прегабалином женщины репродуктивного возраста должны пользоваться адекватными методами контрацепции.
Сведений о выведении прегабалина с грудным молоком у женщин нет, однако замечено, что у крыс он выводится с грудным молоком. В связи с этим во время лечения прегабалином не рекомендуется кормить грудью.
Способ применения и дозы
Реклама: ООО «РЛС-Библиомед», ИНН 7714758963, erid=4CQwVszH9pUmKjt23pm
Внутрь, независимо от приема пищи, в суточной дозе от 150 до 600 мг в 2 или 3 приема.
Нейропатическая боль: начальная доза — 150 мг/сут. В зависимости от достигнутого эффекта и переносимости, через 3–7 дней дозу можно увеличить до 300 мг/сут, а при необходимости еще через 7 дней — до максимальной дозы 600 мг/сут.
Эпилепсия: начальная доза — 150 мг/сут. С учетом достигнутого эффекта и переносимости, через 1 нед дозу можно увеличить до 300 мг/сут, а еще через неделю — до максимальной дозы 600 мг/сут.
Фибромиалгия: начальная доза — 150 мг/сут. В зависимости от достигнутого эффекта и переносимости, через 3–7 дней дозу можно увеличить до 300 мг/сут. При отсутствии положительного эффекта дозу увеличивают до 450 мг/сут, а при необходимости еще через 7 дней — до максимальной дозы 600 мг/сут.
Генерализованное тревожное расстройство: начальная доза — 150 мг/сут. В зависимости от достигнутого эффекта и переносимости, через 3–7 дней дозу можно увеличить до 300 мг/сут. При отсутствии положительного эффекта дозу увеличивают до 450 мг/сут, а при необходимости еще через 7 дней — до максимальной дозы 600 мг/сут.
Отмена прегабалина
Если лечение пациентов прегабалином необходимо прекратить, рекомендуется делать это постепенно в течение минимум 1 нед.
Особые группы пациентов
Нарушение функции почек. Пациентам с нарушенной функцией почек дозу подбирают индивидуально, с учетом клиренса креатинина (табл. 1), который рассчитывают по следующей формуле:
У больных, получающих лечение гемодиализом, суточную дозу прегабалина подбирают с учетом функции почек. Непосредственно после каждого 4-часового сеанса гемодиализа назначают дополнительную дозу (табл. 1).
Таблица 1
Подбор дозы прегабалина с учетом функции почек
| Cl креатинина, мл/мин | Суточная доза прегабалина | Кратность приема, сут | |
| Стартовая доза, мг/сут | Максимальная доза, мг/сут | ||
| ?60 | 150 | 600 | 2–3 |
| ?30–<60 | 75 | 300 | 2–3 |
| ?15–<30 | 25–50 | 150 | 1–2 |
| <15 | 25 | 75 | 1 |
| Дополнительная доза после диализа, мг | |||
| — | 25 | 100 | Однократно |
Нарушение функции печени. У больных с нарушением функции печени коррекция дозы не требуется (см. «Фармакокинетика»).
Дети до 12 лет и подростки (12–17 лет включительно). Безопасность и эффективность применения прегабалина у детей до 12 лет и подростков 12–17 лет не установлена. Применение препарата у детей не рекомендуется.
Пожилые люди (старше 65 лет). Пациентам пожилого возраста (старше 65 лет) может потребоваться снижение дозы прегабалина в связи со снижением функции почек.
В случае пропуска дозы прегабалина необходимо принять следующую дозу как можно скорее, однако не следует принимать пропущенную дозу, если время приема следующей уже подходит.
Побочные действия
По имеющемуся опыту клинического применения прегабалина более чем у 12000 пациентов, наиболее распространенными нежелательными явлениями были головокружение и сонливость. Наблюдаемые явления были обычно легкими или умеренными. Частота отмены прегабалина и плацебо из-за нежелательных реакций составила 14 и 7% соответственно. Основными нежелательными эффектами, требовавшими прекращения лечения, были головокружение (4%) и сонливость (3%), в зависимости от их субъективной переносимости.
Другие побочные эффекты, также приводящие к отмене препарата, — атаксия, спутанность сознания, астения, нарушение внимания, нечеткость зрения, нарушение координации, периферические отеки.
Ниже перечислены все нежелательные явления, частота которых превышала таковую в группе плацебо (наблюдавшиеся более чем у 1 человека). Они распределены по системно-органным классам и частоте: очень часто — ≥1/10; часто — ≥1/100, <1/10; нечасто — ≥1/1000, <1/100; редко — <1/1000.
Перечисленные нежелательные явления могли быть связаны с основным заболеванием и/или сопутствующей терапией.
Инфекции и инвазии: нечасто — назофарингит.
Со стороны системы крови и лимфатической системы: редко — нейтропения.
Нарушения метаболизма и питания: часто — повышение аппетита; нечасто — анорексия, гипогликемия.
Психические расстройства: часто — эйфория, спутанность сознания, снижение/увеличение либидо, раздражительность, усиление бессонницы/бессонница, дезориентация; нечасто — деперсонализация, аноргазмия, беспокойство, депрессия, ажитация, лабильность настроения, подавленное настроение, трудности в подборе слов, галлюцинации, необычные сновидения, панические атаки, апатия; редко — расторможенность, приподнятое настроение.
Неврологические расстройства: очень часто — головокружение, сонливость; часто — атаксия, нарушение внимания, нарушение координации, ухудшение памяти, тремор, дизартрия, парестезия, нарушение равновесия, амнезия, седация, летаргия; нечасто — когнитивные расстройства, гипестезия, нистагм, нарушение речи, миоклонические судороги, ослабление рефлексов, дискинезия, психомоторное возбуждение, постуральное головокружение, гиперестезия, потеря вкусовых ощущений, ощущение жжения на слизистых оболочках и коже, интенционный тремор, ступор, обморок; редко — гипокинезия, паросмия, дисграфия.
Со стороны органа зрения: часто — нечеткость зрения, диплопия; нечасто — сужение полей зрения, снижение остроты зрения, боль в глазах, астенопия, а также сухость в глазах, отечность глаз, повышенное слезотечение; редко — мелькание искр перед глазами, раздражение глаз, мидриаз, осциллопсия (субъективное ощущение колебания рассматриваемых предметов), нарушение восприятия зрительной глубины, утрата периферического зрения, косоглазие, усиление яркости зрительного восприятия.
Со стороны органа слуха и вестибулярного аппарата: часто — вертиго; нечасто — гиперакузия.
Со стороны ССС: нечасто — тахикардия, AV блокада I степени, приливы крови к лицу, снижение АД, похолодание конечностей, повышение АД, гиперемия кожи; редко — синусовая тахикардия, синусовая аритмия, синусовая брадикардия.
Со стороны дыхательной системы: нечасто — одышка, кашель, сухость слизистой оболочки носа; редко — заложенность носа, кровотечение из носа, ринит, храп, чувство стеснения в глотке.
Со стороны пищеварительной системы: часто — сухость во рту, запор, рвота, метеоризм, вздутие живота; нечасто — повышенное слюноотделение, гастроэзофагеальный рефлюкс, гипестезия слизистой оболочки полости рта; редко — асцит, дисфагия, панкреатит.
Со стороны кожных покровов: нечасто — потливость, папулезная сыпь; редко — холодный пот, крапивница.
Со стороны опорно-двигательного аппарата: нечасто — подергивания мышц, припухлость суставов, мышечные спазмы, миалгия, артралгия, боль в спине, боль в конечностях, скованность в мышцах; редко — спазм шейных мышц, боль в шее, рабдомиолиз.
Со стороны мочевыделительной системы: нечасто — дизурия, недержание мочи; редко — олигурия, почечная недостаточность.
Со стороны репродуктивной системы: часто — эректильная дисфункция; нечасто — задержка эякуляции, сексуальная дисфункция; редко — аменорея, боль в грудных железах, выделения из молочных желез, дисменорея, увеличение молочных желез в объеме.
Прочие: часто — утомляемость, отеки, в т.ч. периферические, чувство опьянения, нарушение походки; нечасто — астения, падения, жажда, чувство стеснения в груди, генерализованные отеки, озноб, боль, патологические ощущения; редко — гипертермия.
Лабораторные показатели и инструментальные данные: часто — увеличение массы тела; нечасто — повышение активности АЛТ, КФК, АСТ, снижение числа тромбоцитов; редко — повышение концентрации глюкозы и креатинина крови, снижение концентрации калия крови, снижение массы тела, снижение числа лейкоцитов в крови.
Эффекты, отмеченные при постмаркетинговом наблюдении (частота неизвестна)
Неврологические расстройства: головная боль, потеря сознания, когнитивные нарушения, судороги.
Со стороны пищеварительной системы: редкие случаи отека языка, тошнота, диарея.
Со стороны кожных покровов: редкие случаи отека лица, зуд, синдром Стивенса-Джонсона.
Со стороны органа зрения: кератит, потеря зрения.
Со стороны иммунной системы: ангионевротический отек, аллергические реакции, гиперчувствительность.
Со стороны ССС: ХСН, удлинение интервала QT.
Со стороны мочевыделительной системы: задержка мочи.
Со стороны дыхательной системы: отек легких.
Со стороны репродуктивной системы: гинекомастия.
Прочие: повышенная утомляемость.
Взаимодействие
Прегабалин выводится с мочой, в основном в неизмененном виде, подвергается минимальному метаболизму у человека (в виде метаболитов с мочой выводится менее 2% дозы), не ингибирует метаболизм других лекарственных веществ in vitro и не связывается с белками плазмы, поэтому он вряд ли способен вступать в фармакокинетическое взаимодействие.
Не обнаружены признаки клинически значимого фармакокинетического взаимодействия прегабалина с фенитоином, карбамазепином, вальпроевой кислотой, ламотриджином, габапентином, лоразепамом, оксикодоном или этанолом. Установлено, что пероральные гипогликемические препараты, диуретики, инсулин, фенобарбитал, тиагабин и топирамат не оказывают клинически значимое влияние на клиренс прегабалина.
При применении пероральных контрацептивов, содержащих норэтистерон и/или этинилэстрадиол, одновременно с прегабалином равновесная фармакокинетика препаратов не менялась.
Сообщалось о случаях нарушения дыхания и наступления комы при одновременном применении прегабалина с другими препаратами, угнетающими ЦНС. Также сообщалось об отрицательном влиянии прегабалина на деятельность ЖКТ (в т.ч. развитие кишечной непроходимости, паралитического илеуса, запора) при одновременном применении с ЛС, вызывающими запор (такими как ненаркотические анальгетики).
Повторное пероральное применение прегабалина с оксикодоном, лоразепамом или этанолом не оказывало клинически значимое влияние на дыхание. Прегабалин, по-видимому, усиливает нарушения когнитивной и двигательной функций, вызванные оксикодоном. Прегабалин может усилить эффекты этанола и лоразепама.
Передозировка
При передозировке препарата (до 15 г) каких-либо из неописанных выше нежелательных реакций зарегистрировано не было. В ходе постмаркетингового применения наиболее частыми нежелательными явлениями, развивавшимися при передозировке прегабалина, являлись: аффективные расстройства, сонливость, спутанность сознания, депрессия, ажитация и беспокойство.
Лечение: проводят промывание желудка, поддерживающую терапию и при необходимости — гемодиализ (см. «Способ применения и дозы», табл. 1).
Особые указания
У части больных сахарным диабетом в случае прибавки массы тела на фоне лечения прегабалином может потребоваться коррекция доз гипогликемических средств.
Прегабалин необходимо отменить в случае развития симптомов ангионевротического отека (таких как отек лица, периоральный отек или отечность тканей верхних дыхательных путей).
Противоэпилептические препараты, включая прегабалин, могут повышать риск возникновения суицидальных мыслей или поведения. Поэтому пациентов, получающих эти препараты, следует тщательно наблюдать на предмет возникновения или ухудшения депрессии, появления суицидальных мыслей или поведения.
Лечение прегабалином сопровождалось головокружением и сонливостью, которые повышают риск случайных травм (падений) у пожилых людей. В ходе постмаркетингового применения препарата отмечались также случаи потери сознания, спутанности сознания и нарушения когнитивных функций. Поэтому до тех пор, пока больные не оценят возможные эффекты препарата, они должны соблюдать осторожность.
Сведения о возможности отмены других противосудорожных средств при подавлении судорог прегабалином и целесообразности монотерапии этим препаратом недостаточны.
Имеются сообщения о развитии судорог, в т.ч. эпилептического статуса и малых припадков, на фоне применения прегабалина или сразу после окончания терапии.
При появлении в ответ на применение прегабалина таких нежелательных реакций, как нечеткость зрения или других нарушений со стороны органа зрения, отмена препарата может привести к исчезновению указанных симптомов.
Также отмечались случаи развития почечной недостаточности, в некоторых случаях после отмены прегабалина функция почек восстанавливалась.
В результате отмены прегабалина после длительной или краткосрочной терапии наблюдались следующие нежелательные явления: бессонница, головная боль, тошнота, диарея, гриппоподобный синдром, депрессия, потливость, головокружение, судороги и тревога. Сведения о частоте и выраженности проявлений синдрома отмены прегабалина в зависимости от длительности терапии последним и его дозы не имеется.
Нет данных о том, что прегабалин активен в отношении рецепторов, связанных с развитием злоупотребления препарата пациентами. Во время постмаркетинговых исследований отмечались случаи злоупотребления прегабалином. Как и при применении любого ЛС, влияющего на ЦНС, следует тщательно оценить анамнез пациента на предмет имеющихся случаев злоупотребления ЛС, а также наблюдать пациента в связи с возможностью злоупотребления прегабалином.
Имеются сообщения о случаях развития зависимости при применении прегабалина. Пациенты с лекарственной зависимостью в анамнезе нуждаются в тщательном медицинском наблюдении на предмет симптомов зависимости от прегабалина.
В ходе постмаркетингового применения препарата сообщалось о развитии ХСН на фоне терапии прегабалином у некоторых пациентов. Эти реакции преимущественно наблюдались у больных пожилого возраста, страдавших нарушениями функции сердца и получавших препарат по поводу нейропатии. Поэтому прегабалин у данной категории пациентов должен использоваться с осторожностью. После отмены прегабалина возможно исчезновение проявлений подобных реакций.
Частота нежелательных явлений со стороны ЦНС, особенно таких, как сонливость, повышается при лечении центральной нейропатической боли, обусловленной поражением спинного мозга, что, однако, может быть следствием суммации эффектов прегабалина и других параллельно принимаемых средств (например антиспастические). Это обстоятельство следует принимать во внимание при назначении прегабалина по данному показанию.
Отмечались случаи энцефалопатии, особенно у пациентов с сопутствующими заболеваниями, которые могут привести к развитию данного состояния.
Влияние на способность управлять транспортными средствами и работать с механизмами. Прегабалин может вызвать головокружение и сонливость и, соответственно, повлиять на способность управлять автомобилем и пользоваться сложной техникой. Больные не должны управлять автомобилем, пользоваться сложной техникой или выполнять другие потенциально опасные виды деятельности, пока не станет ясно, влияет ли этот препарат на выполнение ими таких задач.
Форма выпуска
Капсулы, 25 мг, 75 мг, 150 мг или 300 мг. В блистере из ПВХ и алюминиевой фольги, 10, 14 или 21 шт. 1 или 4 блистера по 14 шт., 4 блистера по 21 шт. или 10 блистеров по 10 шт. в картонной пачке.
Производитель
Пфайзер Мэньюфэкчеринг Дойчланд ГмбХ.
Моосвальдаллее, 1, 79090 Фрайбург, Германия.
Владелец регистрационного удостоверения: Пфайзер Инк. 235, Ист 42-я Стрит, Нью-Йорк, штат Нью-Йорк, 10017, США.
Претензии потребителей направлять по адресу представительства корпорации «Пфайзер Эйч. Си. Пи. Корпорэйшн», США.
Москва, 123317, Пресненская наб., 10, комплекс «Башня на набережной», блок С.
Тел.: (495) 258-55-35, факс: (495) 258-55-38.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Тиагабин
Tiagabine
Фармакологическое действие
Потенцирует ГАМКергическую передачу в центральной нервной системе: ингибирует обратный захват ГАМК, увеличивает (на 60–70 %) концентрацию и время её пребывания в синаптической щели нейрональных и глиальных клеток.
Фармакокинетика
Абсорбция
Быстро и практически полностью (89 %) всасывается из желудочно-кишечного тракта. TCmax (время достижения максимальной плазменной концентрации) (21 нг/мл) составляет 90 минут и увеличивается при приёме пищи до 2,6 часа.
Распределение и метаболизм
Связь с белками плазмы — 96 % (уменьшается при нарушении функции печени), объём распределения (Vd)— 1 л/кг. Проникает через гематоэнцефалический барьер. Подвергается окислительной биотрансформации в печени при участии цитохрома CYP3А.
Выведение
Период полувыведения (T½) — 7–9 часов (2–3 часа — на фоне индукторов микросомальных ферментов, 12–16 часов — при нарушении функции печени). Экскретируется почками (14 % в виде изомеров 5-оксотиолена, 1 % в неизменённом виде) и остальная часть — с фекалиями (в течение 3–5 дней).
Показания
Парциальные и генерализованные эпилептические припадки.
Беременность и грудное вскармливание
Категория действия на плод по FDA — C.
Способ применения и дозы
Внутрь, взрослым: начальная доза — 7,5–15 мг/сут в 3 приёма с последующим постепенным увеличением на 5–15 мг до рекомендуемой — 30–50 мг/сут.
Детям из расчёта 1,5 мг/кг.
Побочные действия
Со стороны нервной системы и органов чувств
Утомляемость, нарушения концентрации внимания, астения, головокружение, головная боль, сонливость, раздражительность, депрессия, атаксия, тремор, нистагм.
Прочие
Тошнота, развитие инфекций.
Передозировка
Симптомы
Сонливость, головокружение, атаксия, нарушение координации, кома.
Лечение
Симптоматическая терапия.
Взаимодействие
Индукторы микросомальных ферментов печени (барбитураты, карбамазепин, фентоин) ускоряют метаболизм и снижают концентрацию.
Галоперидол ослабляет эффект тиагабина (снижение судорожного порога).
Меры предосторожности
У больных с нарушениями функции печени необходима коррекция режима дозирования (уменьшение дозы или кратности приёма).
Классификация
-
АТХ
N03AG06
-
Фармакологическая группа
-
Код МКБ 10
-
Категория при беременности по FDA
C
(риск не исключается)
Информация о действующем веществе Тиагабин предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Тиагабин, содержатся в инструкции производителя, прилагаемой к упаковке.
Лирика® (Lyrica®) инструкция по применению
📜 Инструкция по применению Лирика®
💊 Состав препарата Лирика®
✅ Применение препарата Лирика®
📅 Условия хранения Лирика®
⏳ Срок годности Лирика®
Описание лекарственного препарата
Лирика®
(Lyrica®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2023 года.
Дата обновления: 2023.09.25
Владелец регистрационного удостоверения:
Контакты для обращений:
ВИАТРИС ООО
(Россия)
Код ATX:
N02BF02
(Прегабалин)
Лекарственные формы
| Лирика® |
Капс. 25 мг: 14, 56, 84 или 100 шт. рег. №: ЛС-001752 |
|
|
Капс. 50 мг: 14, 56, 84 или 100 шт. рег. №: ЛС-001752 |
||
|
Капс. 75 мг: 14, 56, 84 или 100 шт. рег. №: ЛС-001752 |
||
|
Капс. 100 мг: 14, 56, 84 или 100 шт. рег. №: ЛС-001752 |
||
|
Капс. 150 мг: 14, 56, 84 или 100 шт. рег. №: ЛС-001752 |
||
|
Капс. 200 мг: 14, 56, 84 или 100 шт. рег. №: ЛС-001752 |
||
|
Капс. 300 мг: 14, 56, 84 или 100 шт. рег. №: ЛС-001752 |
Форма выпуска, упаковка и состав
препарата Лирика®
Капсулы твердые желатиновые, №4, с крышечкой белого цвета и корпусом белого цвета; черными чернилами на корпусе капсулы указаны дозировка и код продукта — «PGN 25», на крышечке — «Pfizer»; содержимое капсул — порошок белого или почти белого цвета.
Вспомогательные вещества: лактозы моногидрат — 35 мг, крахмал кукурузный — 20 мг, тальк — 20 мг.
Состав корпуса капсулы: титана диоксид — 0.557 мг (1.47%), натрия лаурилсульфат — 0.046 мг (0.12%) (max), вода — 3.306 мг (8.7%), желатин — 18.892 мг (49.72%) qsp до 100%.
Состав крышечки капсулы: титана диоксид — 0.371 мг (0.98%), натрия лаурилсульфат — 0.03 мг (0.08%) (max), вода — 2.204 мг (5.8%), желатин — 12.594 мг (33.14%) qsp до 100%.
Состав чернил: шеллак (24-27%), этанол (23-26%), изопропанол (0.5-3%), бутанол (0.5-3%), пропиленгликоль (3-7%), аммиака раствор концентрированный (1-2%), калия гидроксид (0.05-0.1%), вода очищенная (15-18%), краситель железа оксид черный (24-28%).
10 шт. — блистеры (10) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (1) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
21 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
Капсулы твердые желатиновые, №3, с крышечкой белого цвета и корпусом белого цвета с черной полосой; черными чернилами на корпусе капсулы указаны дозировка и код продукта — «PGN 50», на крышечке — «Pfizer»; содержимое капсул — порошок белого или почти белого цвета.
Вспомогательные вещества: лактозы моногидрат — 70 мг, крахмал кукурузный — 40 мг, тальк — 40 мг.
Состав корпуса капсулы: титана диоксид — 0.703 мг (1.46%), натрия лаурилсульфат — 0.058 мг (0.12%) (max), вода — 4.176 мг (8.7%), желатин — 23.863 мг (49.71%) qsp до 100%.
Состав крышечки капсулы: титана диоксид — 0.469 мг (0.98%), натрия лаурилсульфат — 0.038 мг (0.08%) (max), вода — 2.784 мг (5.8%), желатин — 15.909 мг (33.14%) qsp до 100%.
Состав чернил: шеллак (24-27%), этанол (23-26%), изопропанол (0.5-3%), бутанол (0.5-3%), пропиленгликоль (3-7%), аммиака раствор концентрированный (1-2%), калия гидроксид (0.05-0.1%), вода очищенная (15-18%), краситель железа оксид черный (24-28%).
10 шт. — блистеры (10) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (1) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
21 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
Капсулы твердые желатиновые, №4, с крышечкой от красно-коричневого до темно-красно-коричневого цвета* и корпусом белого цвета; черными чернилами на корпусе капсулы указаны дозировка и код продукта — «PGN 75», на крышечке — «Pfizer»; содержимое капсул — порошок белого или почти белого цвета.
Вспомогательные вещества: лактозы моногидрат — 8.25 мг, крахмал кукурузный — 8.375 мг, тальк — 8.375 мг.
Состав корпуса капсулы: титана диоксид — 0.557 мг (1.47%), натрия лаурилсульфат — 0.046 мг (0.12%) (max), вода — 3.306 мг (8.7%), желатин — 18.892 мг (49.72%) qsp до 100%.
Состав крышечки капсулы: краситель железа оксид красный — 0.264 мг (0.69%), титана диоксид — 0.062 мг (0.16%), натрия лаурилсульфат — 0.03 мг (0.08%) (max), вода — 2.204 мг (5.8%), желатин — 12.64 мг (33.26%) qsp до 100%.
Состав чернил: шеллак (24-27%), этанол (23-26%), изопропанол (0.5-3%), бутанол (0.5-3%), пропиленгликоль (3-7%), аммиака раствор концентрированный (1-2%), калия гидроксид (0.05-0.1%), вода очищенная (15-18%), краситель железа оксид черный (24-28%).
10 шт. — блистеры (10) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (1) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
21 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
Капсулы твердые желатиновые, №3, с крышечкой от красно-коричневого до темно-красно-коричневого цвета* и корпусом от красно-коричневого до темно-красно-коричневого цвета*; черными чернилами на корпусе капсулы указаны дозировка и код продукта — «PGN 100», на крышечке — «Pfizer»; содержимое капсул — порошок белого или почти белого цвета.
Вспомогательные вещества: лактозы моногидрат — 11 мг, крахмал кукурузный — 11.17 мг, тальк — 11.17 мг.
Состав корпуса капсулы: краситель железа оксид красный — 0.5 мг (1.04%), титана диоксид — 0.118 мг (0.25%), натрия лаурилсульфат — 0.058 мг (0.12%) (max), вода — 4.176 мг (8.7%), желатин — 23.949 мг (49.89%) qsp до 100%.
Состав крышечки капсулы: краситель железа оксид красный — 0.333 мг (0.69%), титана диоксид — 0.079 мг (0.16%), натрия лаурилсульфат — 0.038 мг (0.08%) (max), вода — 2.784 мг (5.8%), желатин — 15.966 мг (33.26%) qsp до 100%.
Состав чернил: шеллак (24-27%), этанол (23-26%), изопропанол (0.5-3%), бутанол (0.5-3%), пропиленгликоль (3-7%), аммиака раствор концентрированный (1-2%), калия гидроксид (0.05-0.1%), вода очищенная (15-18%), краситель железа оксид черный (24-28%).
10 шт. — блистеры (10) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (1) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
21 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
Капсулы твердые желатиновые, №2, с крышечкой белого цвета и корпусом белого цвета; черными чернилами на корпусе капсулы указаны дозировка и код продукта — «PGN 150», на крышечке — «Pfizer»; содержимое капсул — порошок белого или почти белого цвета.
Вспомогательные вещества: лактозы моногидрат — 16.5 мг, крахмал кукурузный — 16.75 мг, тальк — 16.75 мг.
Состав корпуса капсулы: титана диоксид — 0.894 мг (1.47%), натрия лаурилсульфат — 0.073 мг (0.12%) (max), вода — 5.307 мг (8.7%), желатин — 30.326 мг (49.71%) qsp до 100%.
Состав крышечки капсулы: титана диоксид — 0.596 мг (0.98%), натрия лаурилсульфат — 0.049 мг (0.08%) (max), вода — 3.538 мг (5.8%), желатин — 20.217 мг (33.14%) qsp до 100%.
Состав чернил: шеллак (24-27%), этанол (23-26%), изопропанол (0.5-3%), бутанол (0.5-3%), пропиленгликоль (3-7%), аммиака раствор концентрированный (1-2%), калия гидроксид (0.05-0.1%), вода очищенная (15-18%), краситель железа оксид черный (24-28%).
10 шт. — блистеры (10) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (1) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
21 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
Капсулы твердые желатиновые, №1, с крышечкой от светло-красно-коричневого до красно-коричневого цвета* и корпусом от светло-красно-коричневого до красно-коричневого цвета*; черными чернилами на корпусе капсулы указаны дозировка и код продукта — «PGN 200», на крышечке — «Pfizer»; содержимое капсул — порошок белого или почти белого цвета.
Вспомогательные вещества: лактозы моногидрат — 22 мг, крахмал кукурузный — 22.34 мг, тальк — 22.34 мг.
Состав корпуса капсулы: краситель железа оксид красный — 0.201 мг (0.26%), титана диоксид — 0.189 мг (0.25%), натрия лаурилсульфат — 0.091 мг (0.12%) (max), вода — 6.612 мг (8.7%), желатин — 38.507 мг (50.67%) qsp до 100%.
Состав крышечки капсулы: краситель железа оксид красный — 0.134 мг (0.18%), титана диоксид — 0.126 мг (0.17%), натрия лаурилсульфат — 0.061 мг (0.08%) (max), вода — 4.408 мг (5.8%), желатин — 25.672 мг (33.78%) qsp до 100%.
Состав чернил: шеллак (24-27%), этанол (23-26%), изопропанол (0.5-3%), бутанол (0.5-3%), пропиленгликоль (3-7%), аммиака раствор концентрированный (1-2%), калия гидроксид (0.05-0.1%), вода очищенная (15-18%), краситель железа оксид черный (24-28%).
10 шт. — блистеры (10) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (1) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
21 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
Капсулы твердые желатиновые, №0, с крышечкой от красно-коричневого до темно-красно-коричневого цвета* и корпусом белого цвета, черными чернилами на корпусе капсулы указаны дозировка и код продукта «PGN 300», на крышечке — «Pfizer»; содержимое капсул — порошок белого или почти белого цвета.
Вспомогательные вещества: лактозы моногидрат — 33 мг, крахмал кукурузный — 33.5 мг, тальк — 33.5 мг.
Состав корпуса капсулы: титана диоксид — 1.407 мг (1.47%), натрия лаурилсульфат — 0.115 мг (0.12%) (max), вода — 8.352 мг (8.7%), желатин — 47.726 мг (49.71%) qsp до 100%.
Состав крышечки капсулы: краситель железа оксид красный — 0.667 мг (0.69%), титана диоксид — 0.157 мг (0.16%), натрия лаурилсульфат — 0.077 мг (0.08%) (max), вода — 5.568 мг (5.8%), желатин — 31.931 мг (33.26%) qsp до 100%.
Состав чернил: шеллак (24-27%), этанол (23-26%), изопропанол (0.5-3%), бутанол (0.5-3%), пропиленгликоль (3-7%), аммиака раствор концентрированный (1-2%), калия гидроксид (0.05-0.1%), вода очищенная (15-18%), краситель железа оксид черный (24-28%).
10 шт. — блистеры (10) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (1) — пачки картонные с контролем первого вскрытия.
14 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
21 шт. — блистеры (4) — пачки картонные с контролем первого вскрытия.
* в оригинальных сертификатах производителя данные цвета описаны так: «от красно-коричневого до темно-красно-коричневого цвета» — «orange», от светло-красно-коричневого до красно-коричневого цвета» — «light orange», что соответствует цвету понтонов сравнения, используемых в Европейском Союзе при проведении данного вида анализа.
Фармакологическое действие
Действующим веществом является прегабалин — аналог гамма-аминомасляной кислоты ((S)-3-(аминометил)-5-метилгексановая кислота).
Механизм действия
Было установлено, что прегабалин связывается с дополнительной субъединицей (α2-дельта-протеин) потенциал-зависимых кальциевых каналов в ЦНС, необратимо замещая [3Н]-габапентин. Предполагается, что такое связывание может способствовать проявлению его анальгетического и противосудорожного эффектов.
Нейропатическая боль
Эффективность прегабалина отмечена у пациентов с диабетической невропатией и постгерпетической невралгией.
Установлено, что при приеме прегабалина курсами до 13 недель по 2 раза/сут и до 8 недель по 3 раза/сут, в целом риск развития побочных эффектов и эффективность препарата при приемах по 2 или по 3 раза/сут одинаковы.
При приеме курсом продолжительностью до 13 недель боль уменьшалась в течение первой недели, а эффект сохранялся до конца лечения.
Отмечалось уменьшение индекса боли на 50% у 35% пациентов, получавших прегабалин, и 18% пациентов, принимавших плацебо. Среди пациентов, не испытывавших сонливости, эффект такого снижения боли отмечался у 33% пациентов группы прегабалина и 18% пациентов группы плацебо. У 48% пациентов, принимавших прегабалин, и у 16% пациентов, принимавших плацебо, возникала сонливость.
Фибромиалгия
Выраженное снижение болевой симптоматики, связанной с фибромиалгией, отмечается при применении прегабалина в дозах от 300 мг до 600 мг/сут. Эффективность доз 450 и 600 мг/сут сравнима, однако переносимость 600 мг/сут обычно хуже.
Также применение прегабалина связано с заметным улучшением в функциональной активности пациентов и снижением выраженности нарушений сна. Применение прегабалина в дозе 600 мг/сут приводило к более выраженному улучшению сна, по сравнению с дозой 300-450 мг/сут.
Эпилепсия
При приеме препарата в течение 12 недель по 2 или 3 раза/сут отмеченные риск развития побочных эффектов и эффективность препарата при этих режимах дозирования одинаковы. Уменьшение частоты судорог начиналось в течение первой недели.
Генерализованное тревожное расстройство
Уменьшение симптоматики генерализованного тревожного расстройства отмечается на первой неделе лечения. При применении препарата в течение 8 недель у 52% пациентов, получавших прегабалин, и у 38% пациентов, получавших плацебо, отмечалось 50% уменьшение симптоматики по шкале тревожности Гамильтона (HAM-A).
В клинических исследованиях у пациентов, постоянно получавших прегабалин, побочные реакции со стороны органа зрения (такие как затуманивание зрения, снижение остроты зрения, изменения полей зрения) отмечались чаще (за исключением изменений глазного дна), чем у пациентов, получавших плацебо (см. раздел «Особые указания»).
Фармакокинетика
Параметры фармакокинетики прегабалина в равновесном состоянии у здоровых добровольцев, у пациентов с эпилепсией, получавших противоэпилептическую терапию, и у пациентов, получавших его по поводу хронических болевых синдромов, были аналогичны.
Всасывание
Прегабалин быстро всасывается натощак. Сmax прегабалина в плазме достигается через 1 ч как при однократном, так и повторном применении. Биодоступность прегабалина при приеме внутрь составляет ≥90% и не зависит от дозы. При повторном применении Css достигается через 24-48 ч. При применении препарата после приема пищи Cmax снижается примерно на 25-30%, а Tmax увеличивается приблизительно до 2.5 ч. Однако прием пищи не оказывает клинически значимого влияния на общее всасывание прегабалина.
Распределение
Кажущийся Vd прегабалина после приема внутрь составляет примерно 0.56 л/кг. Прегабалин не связывается с белками плазмы.
В исследованиях прегабалина на животных отмечали, что он проникает через ГЭБ у мышей, крыс и обезьян. Также было показано, что прегабалин может проникать через плацентарный барьер, и обнаруживается в молоке у крыс во время лактации.
Метаболизм
Прегабалин практически не подвергается метаболизму. После приема меченного прегабалина примерно 98% радиоактивной метки определялось в моче в неизмененном виде. Доля N-метилированного производного прегабалина, который является основным метаболитом, обнаруживаемым в моче, составляла 0.9% дозы. В доклинических исследованиях не отмечено признаков рацемизации S-энантиомера прегабалина в R-энантиомер.
Выведение
Прегабалин выводится в основном почками в неизмененном виде.
Средний Т1/2 составляет 6.3 ч. Клиренс прегабалина из плазмы и почечный клиренс прямо пропорциональны КК. У пациентов с нарушенной функцией почек и пациентов, находящихся на гемодиализе, необходима коррекция дозы (см. раздел «Режим дозирования»).
Линейность/нелинейность
Фармакокинетика прегабалина в диапазоне рекомендуемых суточных доз носит линейный характер, межиндивидуальная вариабельность низкая (<20%). Фармакокинетику прегабалина при повторном применении можно предсказать на основании данных приема однократной дозы. Следовательно, необходимости в регулярном мониторировании концентрации прегабалина нет.
Фармакокинетика у особых групп пациентов
Пол. Пол пациента не оказывает клинически значимого влияния на концентрацию прегабалина в плазме.
Нарушение функции почек. Клиренс прегабалина прямо пропорционален КК. Учитывая, что прегабалин в основном выводится почками, у пациентов с нарушенной функцией почек рекомендуется снизить дозу прегабалина. Кроме того, прегабалин эффективно удаляется из плазмы при гемодиализе (после 4-часового сеанса гемодиализа концентрации прегабалина в плазме снижаются примерно на 50%), после гемодиализа необходимо назначить дополнительную дозу препарата (см. раздел «Режим дозирования»).
Нарушение функции печени. Фармакокинетика прегабалина у пациентов с нарушением функции печени специально не изучалась. Прегабалин практически не подвергается метаболизму и выводится в основном в неизмененном виде с мочой, поэтому нарушение функции печени не должно существенно изменять концентрации прегабалина в плазме.
Пожилые пациенты (старше 65 лет). Клиренс прегабалина с возрастом имеет тенденцию к снижению, что отражает возрастное снижение КК. Пациентам пожилого возраста с нарушенной функцией почек может потребоваться снижение дозы препарата (см. раздел «Режим дозирования»).
Показания препарата
Лирика®
Нейропатическая боль:
- лечение нейропатической боли у взрослых.
Эпилепсия:
- в качестве дополнительной терапии у взрослых с парциальными судорожными приступами, сопровождающимися или не сопровождающимися вторичной генерализацией.
Генерализованное тревожное расстройство:
- лечение генерализованного тревожного расстройства у взрослых.
Фибромиалгия:
- лечение фибромиалгии у взрослых.
Режим дозирования
Препарат принимают внутрь независимо от приема пищи в суточной дозе от 150 до 600 мг в 2 или 3 приема.
При нейропатической боли лечение начинают с дозы 150 мг/сут. В зависимости от достигнутого эффекта и переносимости через 3-7 дней дозу можно увеличить до 300 мг/сут, а при необходимости еще через 7 дней — до максимальной дозы 600 мг/сут.
При эпилепсии лечение начинают с дозы 150 мг/сут. С учетом достигнутого эффекта и переносимости через 1 неделю дозу можно увеличить до 300 мг/сут, а еще через неделю — до максимальной дозы 600 мг/сут.
При фибромиалгии лечение начинают с дозы по 75 мг 2 раза/сут (150 мг/сут). В зависимости от достигнутого эффекта и переносимости через 7 дней дозу можно увеличить до 300 мг/сут (150 мг 2 раза/сут). При отсутствии положительного эффекта дозу увеличивают до 450 мг/сут (225 мг 2 раза/сут), а при необходимости еще через 7 дней — до максимальной дозы 600 мг/сут. Следует учитывать, что доза 600 мг/сут не дает дополнительных преимуществ, но хуже переносится.
При генерализованном тревожном расстройстве лечение начинают с дозы 150 мг/сут. В зависимости от достигнутого эффекта и переносимости через 7 дней дозу можно увеличить до 300 мг/сут. При отсутствии положительного эффекта дозу увеличивают до 450 мг/сут, а при необходимости еще через 7 дней — до максимальной дозы 600 мг/сут.
Следует регулярно оценивать необходимость продолжения терапии.
Отмена прегабалина
Если лечение необходимо прекратить, рекомендуется делать это постепенно в течение минимум 1 недели.
У пациентов с нарушенной функцией почек дозу подбирают индивидуально с учетом КК (табл. 1), который рассчитывают по следующей формуле:
Для мужчин:
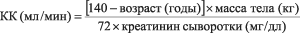
Для женщин:
КК (мл/мин)= значение КК для мужчин × 0.85
У пациентов, находящихся на гемодиализе, суточную дозу прегабалина подбирают с учетом функции почек. После 4-часового сеанса гемодиализа концентрации прегабалина в плазме крови снижаются примерно на 50%. Непосредственно после каждого 4-часового сеанса гемодиализа назначают дополнительную дозу (см. табл. 1).
Таблица 1. Подбор дозы прегабалина с учетом функции почек
У пациентов с нарушением функции печени коррекции дозы не требуется (см. раздел «Фармакокинетика»).
Пациентам пожилого возраста (старше 65 лет) может потребоваться снижение дозы прегабалина в связи со снижением функции почек (см. раздел «Фармакокинетика»).
Применение у детей до 12 лет и подростков (12-17 лет, включительно) — безопасность и эффективность прегабалина не установлены. Применение препарата у детей не рекомендуется.
В случае пропуска дозы прегабалина необходимо принять следующую дозу как можно скорее, однако не следует принимать пропущенную дозу, если время приема следующей уже подходит.
Побочное действие
По имеющемуся опыту клинического применения прегабалина у более чем 12000 пациентов, наиболее распространенными нежелательными явлениями были головокружение и сонливость. Наблюдаемые явления были обычно легкими или умеренными. Частота отмены прегабалина и плацебо из-за нежелательных реакций составила 14% и 7% соответственно. Основными нежелательными эффектами, требовавшими прекращения лечения, были головокружение (4%) и сонливость (3%), в зависимости от их субъективной переносимости. Другие побочные эффекты, которые также приводили к отмене препарата: атаксия, спутанность сознания, астения, нарушение внимания, нечеткость зрения, нарушение координации, периферические отеки.
Также отмечались нежелательные реакции, возникающие после отмены прегабалина: бессонница, головная боль, тошнота, тревога, гриппоподобный синдром, судороги, повышенная возбудимость, депрессия, боль, гипергидроз и диарея.
На фоне терапии центральной нейропатической боли, связанной с повреждением спинного мозга, наблюдается увеличение частоты побочных реакций в целом, а также побочных реакций со стороны ЦНС, в особенности сонливости.
В таблице перечислены все нежелательные явления, частота которых превышала таковую в группе плацебо (наблюдавшиеся более чем у 1 человека). Они распределены по системно-органным классам. Частота встречаемости нежелательных реакций определялась по количеству нежелательных явлений в массиве данных клинических исследований независимо от оценки причинно-следственной связи: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100) и редко (<1/1000). Реакции, наблюдавшиеся во время пострегистрационного применения препарата, выделены курсивом.
Перечисленные нежелательные явления могут также быть связаны с основным заболеванием и/или сопутствующей терапией.
Противопоказания к применению
- повышенная чувствительность к действующему веществу или любому другому компоненту препарата;
- редкие наследственные заболевания, в т.ч. непереносимость галактозы, лактазная недостаточность и нарушение всасывания глюкозы/галактозы;
- детский и подростковый возраст до 17 лет включительно (нет данных по применению).
С осторожностью: почечная недостаточность (см. раздел «Режим дозирования»); хроническая сердечная недостаточность (см. раздел «Особые указания»); одновременное применение с опиоидами (см. раздел «Особые указания»).
В связи с зарегистрированными единичными случаями бесконтрольного применения прегабалина, препарат необходимо назначать с осторожностью пациентам с лекарственной зависимостью в анамнезе (такие пациенты нуждаются в пристальном медицинском наблюдении во время лечения препаратом).
Применение при беременности и кормлении грудью
Беременность
Имеются ограниченные данные о применении прегабалина у беременных женщин.
Данные, полученные в ходе наблюдательного исследования, которое включало более случаев 2700 беременности, во время которых отмечалось воздействие прегабалина, на основании данных, регулярно собираемых из административных и медицинских реестров Дании, Финляндии, Норвегии и Швеции, не указывают на существенное повышение риска серьезных врожденных пороков развития, неблагоприятных исходов родов или патологических исходов в отношении развития нервной системы в постнатальном периоде для беременностей, во время которых отмечалось воздействие прегабалина.
Тяжелые врожденные пороки развития
Скорректированные отношения распространенности и 95% доверительные интервалы (ДИ) в стандартном мета-анализе для воздействия монотерапии прегабалином в I триместре по сравнению с отсутствием воздействия противоэпилептических препаратов составляли 1.13 (0.96-1.33).
Исходы родов и исходы в отношении развития нервной системы в постнатальном периоде
Статистически значимые данные для мертворождения, низкой массы тела при рождении, преждевременных родов, малых размеров плода для гестационного возраста, низкой оценки по шкале Апгар и микроцефалии отсутствовали.
Для популяции пациентов детского возраста, подвергшейся внутриутробному воздействию, исследование не выявило повышенного риска развития синдрома дефицита внимания и гиперактивности (СДВГ), расстройств аутистического спектра (РАС) и нарушений умственного развития.
При применении у животных препарат оказывал токсическое действие на репродуктивную функцию. Прегабалин не следует применять во время беременности, если польза для матери явно не превышает потенциальный риск для плода. При лечении прегабалином женщины репродуктивного возраста должны пользоваться адекватными методами контрацепции.
Период грудного вскармливания
Прегабалин выводится с грудным молоком. Т.к. безопасность применения прегабалина у новорожденных неизвестна, во время лечения прегабалином не рекомендуется кормить грудью. Следует прекратить грудное вскармливание или отменить терапию прегабалином, принимая во внимание необходимость терапии для матери и грудное вскармливание для новорожденного.
Фертильность
Клинических данных о влиянии прегабалина на фертильность женщин с сохраненной детородной функцией нет.
Применение при нарушениях функции печени
У пациентов с нарушением функции печени коррекции дозы не требуется.
Применение при нарушениях функции почек
С осторожностью следует назначать препарат при почечной недостаточности. У пациентов с нарушенной функцией почек дозу подбирают индивидуально с учетом КК.
Применение у детей
Противопоказано применение в возрасте до 17 лет включительно (нет данных по применению).
Применение у пожилых пациентов
Пациентам пожилого возраста (старше 65 лет) может потребоваться снижение дозы прегабалина в связи со снижением функции почек.
Особые указания
Пациенты с сахарным диабетом
У части пациентов с сахарным диабетом в случае повышения массы тела на фоне лечения прегабалином может потребоваться коррекция доз гипогликемических препаратов.
Реакции гиперчувствительности
Прегабалин необходимо отменить в случае развития симптомов ангионевротического отека (таких как, отек лица, периоральный отек или отечность тканей верхних дыхательных путей).
Суицидальные мысли и поведение
Противоэпилептические препараты, включая прегабалин, могут повышать риск возникновения суицидальных мыслей или поведения. Поэтому пациентов, получающих эти препараты, следует тщательно наблюдать на предмет возникновения или ухудшения депрессии, появления суицидальных мыслей или поведения.
Снижение функции ЖКТ
При одновременном применении прегабалина и опиоидов следует рассмотреть необходимость проведения профилактических мер по предупреждению развития запоров (в особенности у пожилых пациентов и женщин).
Головокружение, сонливость, потеря сознания, спутанность сознания и нарушения когнитивных функций
Лечение прегабалином сопровождалось головокружением и сонливостью, которые повышают риск случайных травм (падений) у пожилых людей. В ходе пострегистрационного применения препарата отмечались также случаи потери сознания, спутанности сознания и нарушения когнитивных функций. Поэтому до тех пор, пока пациенты не оценят возможные эффекты препарата, они должны соблюдать осторожность.
Отмена сопутствующей терапии противосудорожными препаратами
Сведения о возможности отмены других противосудорожных средств при подавлении судорог прегабалином и целесообразности монотерапии этим препаратом недостаточны.
Имеются сообщения о развитии судорог, в т.ч. эпилептического статуса и малых припадков на фоне применения прегабалина или сразу после окончания терапии.
Влияние прегабалина на зрение
В клинических исследованиях у пациентов, постоянно получавших прегабалин, такой побочный эффект, как затуманивание зрения отмечался чаще, чем у пациентов, получавших плацебо. При этом указанный побочный эффект прекращался по мере продолжения лечения. В клинических исследованиях, во время которых проводили офтальмологическое обследование пациентов, снижение остроты зрения и изменения полей зрения чаще наблюдалось у пациентов, получающих прегабалин, чем у получающих плацебо. Частота изменений глазного дна была выше у пациентов, получающих плацебо.
Несмотря на то, что клиническое значение этих нарушений не установлено, пациентам следует сообщать врачу об изменениях зрения на фоне терапии прегабалином. В случае сохранения симптомов нарушения зрения следует продолжить наблюдение. Более частые проверки зрения следует проводить у пациентов, которые уже регулярно наблюдаются у офтальмолога. При появлении в ответ на применение прегабалина таких нежелательных реакций, как потеря зрения, нечеткость зрения или других нарушений со стороны органа зрения, отмена препарата может привести к исчезновению указанных симптомов.
Почечная недостаточность
Отмечались также случаи развития почечной недостаточности, в некоторых случаях после отмены прегабалина функция почек восстанавливалась.
Симптомы отмены прегабалина
В результате отмены прегабалина после длительной или краткосрочной терапии наблюдались следующие нежелательные явления: бессонница, головная боль, тошнота, диарея, гриппоподобный синдром, депрессия, потливость, головокружение, судороги и тревога. Имеющиеся данные свидетельствуют о том, что частота возникновения и тяжесть проявлений синдрома отмены могут зависеть от дозы прегабалина.
Злоупотребление прегабалином
Нет данных о том, что прегабалин активен в отношении рецепторов, отвечающих за развитие злоупотребления препаратом у пациентов. Во время пострегистрационных исследований отмечались случаи нарушения рекомендованного режима дозирования, злоупотребления и зависимости от прегабалина. Как и при применении любого лекарственного средства, влияющего на ЦНС, следует тщательно оценить анамнез пациента на предмет имеющихся случаев злоупотребления лекарственными средствами и/или психических расстройств. Пациенты должны наблюдаться на предмет нарушения рекомендованного режима дозирования, злоупотребления и зависимости от прегабалина (например, развитие устойчивости к терапии прегабалином, необоснованное повышение дозы препарата, аддиктивное поведение пациента).
Хроническая сердечная недостаточность
Несмотря на то, что очевидной взаимосвязи с концентрацией прегабалина в плазме крови и развитием сердечной недостаточности не отмечалось, в ходе пострегистрационного применения препарата сообщалось о развитии хронической сердечной недостаточности на фоне терапии прегабалином у некоторых пациентов. У пациентов без клинически выраженных признаков заболеваний сердца или сосудов не отмечалось связи между периферическими отеками и сердечно-сосудистыми осложнениями, такими как, повышение АД или хроническая сердечная недостаточность. Эти реакции преимущественно наблюдались у пациентов пожилого возраста, страдавших нарушениями функции сердца и получавших препарат по поводу невропатии. Поэтому прегабалин у данной категории пациентов следует применять с осторожностью. После отмены прегабалина возможно исчезновение проявлений подобных реакций.
Одновременное применение с опиоидами
Рекомендуется соблюдать осторожность при назначении прегабалина одновременно с опиоидами в связи с риском развития угнетения ЦНС. В наблюдательном исследовании с участием лиц, принимающих опиоиды, у пациентов, которые получали терапию прегабалином одновременно с опиоидом, наблюдался повышенный риск смертности, связанной с опиоидами, по сравнению с теми, кто принимал только опиоиды (скорректированное отношение шансов, 1.68 [95% ДИ, 1.19-2.36]).
Терапия центральной нейропатической боли, связанной с повреждением спинного мозга
Частота нежелательных явлений со стороны ЦНС, особенно таких как сонливость, повышается при лечении центральной нейропатической боли, обусловленной поражением спинного мозга, что, однако, может быть следствием суммирования эффектов прегабалина и других параллельно принимаемых средств (например, антиспастических). Это обстоятельство следует принимать во внимание при назначении прегабалина по данному показанию.
Энцефалопатия
Отмечались случаи энцефалопатии, особенно у пациентов с сопутствующими заболеваниями, которые могут привести к развитию данного состояния.
Женщины репродуктивного возраста/Контрацепция
Использование прегабалина в I триместре беременности может вызвать серьезные врожденные дефекты у будущего ребенка. Прегабалин не следует применять во время беременности, если польза для матери явно не превышает потенциальный риск для плода. Женщины репродуктивного возраста должны пользоваться адекватными методами контрацепции во время лечения (см. раздел «Беременность и лактация»).
Влияние на способность к управлению транспортными средствами и механизмами
Прегабалин может вызвать головокружение и сонливость и, соответственно, повлиять на способность управлять автомобилем и пользоваться сложной техникой. Пациенты не должны управлять автомобилем, пользоваться сложной техникой или выполнять другие потенциально опасные виды деятельности, пока не станет ясно, влияет ли этот препарат на выполнение ими таких задач.
Передозировка
Симптомы: при передозировке препарата (до 15 г) каких-либо из не описанных выше нежелательных реакций зарегистрировано не было. В ходе пострегистрационного применения наиболее частыми нежелательными явлениями, развивавшимися при передозировке прегабалина, являлись: аффективные расстройства, сонливость, спутанность сознания, депрессия, ажитация и беспокойство, в редких случаях были зарегистрированы случаи комы. Также отмечались судороги.
Лечение: проводят промывание желудка, поддерживающую терапию и при необходимости — гемодиализ (см. раздел «Режим дозирования» табл. 1).
Лекарственное взаимодействие
Прегабалин выводится с мочой в основном в неизмененном виде, подвергается минимальному метаболизму у человека (в виде метаболитов с мочой выводится менее 2% дозы), не ингибирует метаболизм других лекарственных веществ in vitro и не связывается с белками плазмы, поэтому вряд ли способен вступать в фармакокинетическое взаимодействие.
Исследования in vivo и популяционный фармакокинетический анализ
Не обнаружено признаков клинически значимого фармакокинетического взаимодействия прегабалина с фенитоином, карбамазепином, вальпроевой кислотой, ламотриджином, габапентином, лоразепамом, оксикодоном и этанолом. Установлено, что пероральные гипогликемические препараты, диуретики, инсулин, фенобарбитал, тиагабин и топирамат не оказывают клинически значимого влияния на клиренс прегабалина.
Пероральные контрацептивные препараты, норэтистерон и/или этинилэстрадиол
При применении пероральных контрацептивных препаратов, содержащих норэтистерон и/или этинилэстрадиол, одновременно с прегабалином равновесная фармакокинетика обоих препаратов не менялась.
Препараты, влияющие на ЦНС
Сообщалось о случаях нарушения дыхания, наступления комы и смерти при одновременном применении прегабалина с другими препаратами, угнетающими ЦНС, в т.ч. у пациентов, которые злоупотребляют психоактивными веществами.
Повторное пероральное применение прегабалина с оксикодоном, лоразепамом или этанолом не оказывало клинически значимого влияния на дыхание. Прегабалин, по-видимому, усиливает нарушения когнитивной и двигательной функций, вызванные оксикодоном. Прегабалин может усилить эффекты этанола и лоразепама.
Влияние на ЖКТ
Также сообщалось об отрицательном влиянии прегабалина на деятельность ЖКТ (в т.ч. развитие кишечной непроходимости, паралитического илеуса, запора) при одновременном применении с лекарственными средствами, вызывающими запор (такими как опиоиды) (см. раздел «Особые указания»).
Взаимодействие препаратов при применении у пожилых пациентов
Специальные исследования фармакодинамического взаимодействия с другими лекарственными средствами у пожилых пациентов не проводились.
Условия хранения препарата Лирика®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°C.
Срок годности препарата Лирика®
Срок годности — 3 года. Не применять по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
ВИАТРИС ООО
(Россия)

|
|
ООО «Пфайзер» переименовано в ООО «Виатрис». ООО «Виатрис» 125315 Москва, Ленинградский пр-т, д. 72, к. 4 |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
1. Наименование лекарственного средства
Габитрил ® 5 мг таблетки, покрытые оболочкой
2. Качественный и количественный состав
Каждая таблетка Габитрил 5 мг содержит:
Тиагабин безводный, МНН 5 мг (в виде гидрохлорида моногидрата)
Эксципиент (ы) с известным эффектом
Полный список наполнителей см. В разделе 6.1.
3. Фармацевтическая форма
5 мг: таблетка. Белая, двояковыпуклая таблетка, покрытая пленкой, с тиснением на одной стороне с надписью «251».
4. Клинические особенности
4.1 Терапевтические показания
Габитрил представляет собой противоэпилептическое лекарственное средство, назначаемое в качестве дополнительной терапии при частичных припадках с вторичным генерализацией или без него, когда контроль не достигается оптимальными дозами по меньшей мере одного другого противоэпилептического препарата.
4.2 Позология и способ применения
Габитрил следует принимать внутрь во время еды.
Схемы дозирования, возможно, должны быть индивидуализированы на основе конкретных характеристик пациента, таких как возраст и сопутствующие лекарства .
Одновременный прием с препаратами, участвующими в метаболизме CYP 3A4 / 5: поскольку CYP3A4 / 5 участвует в метаболизме тиагабина, рекомендуется корректировать дозу тиагабина, когда его принимают в комбинации с индукторами CYP3A4 / 5 (см. Раздел 4.5 Взаимодействие с другие лекарственные средства и другие формы взаимодействия).
После данной дозы тиагабина расчетная концентрация в плазме у неиндуцированных пациентов более чем в два раза выше, чем у пациентов, получающих фермент-индуцирующие препараты. Для достижения аналогичного системного воздействия тиагабина неиндуцированным пациентам требуются более низкие и менее частые дозы тиагабина, чем у индуцированных пациентов. Этим пациентам также может потребоваться более медленное титрование тиагабина по сравнению с таковым у индуцированных пациентов.
Взрослые и дети старше 12 лет : начальная суточная доза составляет 5-10 мг тиагабина с последующим еженедельным приращением 5-10 мг / день. Обычная поддерживающая доза у пациентов, принимающих фермент-индуцирующие препараты, составляет 30-45 мг / сут. У пациентов, не принимающих фермент-индуцирующие препараты, поддерживающая доза должна быть первоначально снижена до 15-30 мг / день. Начальная суточная доза должна приниматься в виде разовой дозы или делиться на две дозы. Суточную поддерживающую дозу следует разделить на две или три разовые дозы.
Дети до 12 лет: у детей до 12 лет опыт применения Габитрила отсутствует, поэтому Габитрил не следует использовать в этой возрастной группе.
Пожилые люди : информация о применении габитрила у пациентов пожилого возраста ограничена, но фармакокинетика тиагабина не изменилась, поэтому не нужно вносить изменения в дозу.
Пациенты с почечной недостаточностью: почечная недостаточность не влияет на фармакокинетику тиагабина, поэтому нет необходимости изменять дозировку у этих типов пациентов.
Пациенты с нарушениями функции печени : тиагабин метаболизируется в печени, и поскольку фармакокинетика тиагабина у пациентов с нарушениями функции печени от легкой до умеренной степени изменяется (см. Раздел 5.2), дозировку габитрила следует корректировать путем уменьшения индивидуальных доз и / или пролонгирования интервалы доз.
Габитрил не следует применять у пациентов с тяжелыми нарушениями функции печени (см. Раздел 4.3).
4.3 Противопоказания
Повышенная чувствительность к активному веществу (веществам) или любому из наполнителей, перечисленных в разделе 6.1.
Сильно нарушенная функция печени.
Габитрил в сочетании с зверобой (Hypericum perforatum) (см. Раздел 4.5).
4.4 Особые предупреждения и меры предосторожности при использовании
Суицидальные мысли и поведение были зарегистрированы у пациентов, получавших антиэпилептические средства по нескольким показаниям. Мета-анализ рандомизированных плацебо-контролируемых испытаний противоэпилептических препаратов также показал небольшой повышенный риск суицидальных мыслей и поведения. Механизм этого риска неизвестен, и имеющиеся данные не исключают возможности повышенного риска для габитрила.
Поэтому пациенты должны быть проверены на наличие признаков суицидальных мыслей и поведения, и следует рассмотреть возможность соответствующего лечения. Пациентам (и лицам, осуществляющим уход за пациентами) следует рекомендовать обратиться к врачу в случае появления признаков суицидального мышления или поведения.
Постмаркетинговые отчеты показали, что использование габитрила было связано с новыми приступами и эпилептическим статусом у пациентов без эпилепсии. Смешивающие факторы, которые могли способствовать развитию судорог, включают в себя основные медицинские условия или сопутствующие лекарства, которые могут снизить порог судорог, сообщаемую передозировку и способ введения дозы (например, высокая доза, быстрая скорость титрования).
Безопасность и эффективность Gabitril не были установлены для каких-либо указаний, кроме как дополнительной терапии для частичных судорог у взрослых и подростков старше 12 лет.
Габитрил устраняется метаболизмом в печени, поэтому следует соблюдать осторожность при введении препарата пациентам с нарушениями функции печени. Следует использовать уменьшенные дозы и / или интервалы между дозами, и следует тщательно контролировать пациентов на наличие побочных эффектов, таких как головокружение и усталость.
Хотя Габитрил может немного продлевать депрессорный эффект триазолама на ЦНС, это взаимодействие вряд ли будет иметь отношение к клинической практике.
Противоэпилептические агенты, которые вызывают печеночные ферменты (такие как фенитоин, карбамазепин, фенобарбитал и примидон), усиливают метаболизм тиагабина. Следовательно, пациентам, принимающим фермент-индуцирующие препараты, могут потребоваться дозы тиагабина выше обычного диапазона доз.
Хотя нет никаких признаков изъятия абстиненции после Габитрила, рекомендуется уменьшить курс лечения в течение 2-3 недель.
Серьезная сыпь, включая везикулобуллярную сыпь, возникла у пациентов, получавших габитрил (см. Раздел 4.8 Нежелательные эффекты).
Спонтанные кровоподтеки не поступало. Следовательно, если наблюдаются кровоподтеки, необходимо провести полный анализ крови, включая количество тромбоцитов.
Редкие случаи дефектов поля зрения были зарегистрированы с tiagabine. Если визуальные симптомы развиваются, пациент должен быть направлен к офтальмологу для дальнейшей оценки, включая периметрию.
Таблетки Габитрил содержат лактозу и поэтому не должны использоваться у пациентов с редкими наследственными проблемами непереносимости галактозы, дефицита лаппазы Лаппа или мальабсорбции глюкозы-галактозы.
Быстрое титрование и / или большие дозы тиагабина могут плохо переноситься, и их следует избегать (см. Раздел 4.2).
4.5 Взаимодействие с другими лекарственными средствами и другие формы взаимодействия
Противоэпилептические агенты, которые вызывают печеночные ферменты (такие как фенитоин, карбамазепин, фенобарбитал и примидон), усиливают метаболизм тиагабина. Концентрация тиагабина в плазме может быть уменьшена в 1,5-3 раза при одновременном применении этих препаратов.
Габитрил не оказывает клинически значимого влияния на плазменные концентрации фенитоина, карбамазепина, фенобарбитала, варфарина, дигоксина, теофиллина и гормонов из оральных контрацептивов. Габитрил снижает концентрацию вальпроата в плазме примерно на 10%, а циметидин увеличивает биодоступность тиагабина примерно на 5%. Ни один из этих результатов не считается клинически важным и не требует изменения дозы.
Комбинация тиагабина с St. John Wort (Hypericum perforatum) может привести к снижению воздействия и снижению эффективности тиагабина из-за сильной индукции CYP3A4 под действием St. John Wort (усиление метаболизма тиагабина). Таким образом, сочетание тиагабина с зверобоям противопоказано (см. Также раздел 4.3).
4.6 Рождаемость, беременность и кормление грудью
беременность
Эксперименты на животных не показали тератогенного эффекта тиагабина. Однако исследования на животных показали пери- и постнатальную токсичность тиагабина в очень высоких дозах.
Клинический опыт применения Габитрила у беременных ограничен.
Грудное вскармливание
Нет информации о Габитрил во время кормления грудью.
Следовательно, в качестве меры предосторожности предпочтительно не использовать Габитрил во время беременности или кормления грудью, если, по мнению врача, потенциальные выгоды от лечения перевешивают потенциальные риски.
4.7 Влияние на способность управлять автомобилем и использовать машины
Габитрил может вызвать головокружение или другие симптомы, связанные с ЦНС, особенно во время начального лечения.Поэтому следует проявлять осторожность пациентам, управляющим транспортными средствами или действующими механизмами.
4.8 Нежелательные эффекты
Неблагоприятные события в основном связаны с ЦНС.
Полный список побочных реакций, о которых сообщалось с Габитрилом во время клинических исследований и опыта после маркетинга, приведен в таблице ниже. Побочные реакции перечислены ниже как предпочтительный термин MedDRA по классу и частоте системного органа (частоты определены как: очень распространенные ≥1 / 10, общие ≥1 / 100 до <1/10, необычные ≥ от 1/1000 до <1/100, редко (≥1 / 10000 до <1/1000); очень редко (<1/10000), неизвестно (не может быть оценено по имеющимся данным):
Габитрил сообщили о следующих нежелательных эффектах:
Системный Органный Класс
|
частота |
Нежелательные эффекты |
|
|
Психические расстройства |
Очень распространенный |
Нервозность (неспецифическая) |
|
общий |
Трудности с концентрацией, подавленное настроение, эмоциональная лабильность, спутанность сознания, бессонница, враждебность / агрессия |
|
|
редкий |
Депрессия, психоз |
|
|
редкий |
Галлюцинации, заблуждение |
|
|
Расстройства нервной системы |
Очень распространенный |
Головокружение, тремор |
|
общий |
Атаксия, ненормальная походка, расстройство речи |
|
|
редкий |
Сонливость |
|
|
редкий |
Не судорожный статус эпилептический |
|
|
Неизвестный |
энцефалопатия |
|
|
Глазные расстройства |
общий |
Зрение размыто |
|
редкий |
Дефекты поля зрения |
|
|
Желудочно-кишечные расстройства |
Очень распространенный |
Тошнота |
|
общий |
Диарея, рвота, боль в животе |
|
|
Заболевания кожи и подкожной клетчатки |
редкий |
Дерматит буллезный, синяк |
|
Неизвестный |
Везикулобуллезная сыпь, эксфолиативный дерматит |
|
|
Опорно-двигательный аппарат и соединительная ткань |
общий |
Подергивание мышц |
|
Общие расстройства и условия администрации сайта |
Очень распространенный |
Усталость |
|
Травма, отравление и процедурные осложнения |
общий |
Случайная травма |
У пациентов с серьезными поведенческими проблемами в анамнезе существует риск рецидива этих симптомов во время лечения габитрилом, как это происходит с некоторыми другими противоэпилептическими препаратами.
Несмотря на то, что они не были статистически значимыми, обычный лабораторный скрининг во время контролируемых плацебо исследований показал низкий уровень лейкоцитов (<2,5 × 10 9 на литр) чаще при лечении габитрилом (4,1%), чем плацебо (1,5%).
Постмаркетинговые отчеты показали, что использование габитрила было связано с новыми приступами и эпилептическим статусом у пациентов без эпилепсии (см. Раздел 4.4 Специальные предупреждения и особые меры предосторожности при использовании).
Сообщение о подозреваемых побочных реакциях
Важное значение имеет сообщение о предполагаемых побочных реакциях после получения разрешения на лекарственное средство. Это позволяет продолжать мониторинг соотношения пользы и риска лекарственного средства. Профессионалам здравоохранения предлагается сообщать о любых предполагаемых побочных реакциях с помощью схемы «Желтая карточка» по адресу: www.mhra.gov.uk/yellowcard
4.9 Передозировка
Симптомы, чаще всего сопровождающие передозировку Габитрила, отдельно или в сочетании с другими лекарственными средствами, включают судороги, в том числе эпилептический статус, у пациентов с основными припадочными расстройствами и без них, угнетение дыхания, остановку дыхания, кому, потерю сознания, ступенчатый волновой ступор, энцефалопатию, амнезия, спутанность сознания, дезориентация, сонливость, дискинезия, миоклонус, тремор, атаксия или нарушение координации, головокружение, нистагм, нарушение речи, головная боль, психотическое расстройство, галлюцинации, враждебность, агрессия, возбуждение, рвота, гиперсаливация, брадикардия, волнение, тахикардия, тахика гипертония, гипотония и недержание мочи. В более серьезных случаях сообщалось о немой и замкнутой внешности пациента и риск судорог.
Из постмаркетингового опыта не было сообщений о смертельных передозировках с участием только одного Габитрила (дозы до 720 мг), хотя некоторым пациентам требовалась интубация и респираторная поддержка как часть ведения их эпилептического статуса.
Стандартное медицинское наблюдение и поддерживающее лечение должны быть предоставлены. Рассмотрим пероральное введение активированного угля, если пациент представляет в течение 1 часа после приема внутрь более 2 мг / кг.
5. Фармакологические свойства
5.1 Фармакодинамические свойства
Габитрил является противоэпилептическим препаратом.
Тиагабин является мощным и селективным ингибитором поглощения ГАМК как в нервной, так и в глиальной клетках, что приводит к увеличению ГАМК-медикаментозного ингибирования в мозге.
Tiagabine не обладает значительным сродством к другим сайтам связывания рецепторов нейротрансмиттеров и / или сайтам захвата.
5.2 Фармакокинетические свойства
Тиагабин быстро и практически полностью всасывается из таблеток габитрила с абсолютной биодоступностью 89%.Администрация с пищей приводит к снижению скорости и не степень поглощения.
Объем распределения составляет примерно 1 л / кг.
Связывание с белками плазмы тиагабина составляет около 96%.
Почечный клиренс незначителен. Печеночный метаболизм является основным путем устранения тиагабина. Менее 2% дозы выводится в неизмененном виде с мочой и калом. Активных метаболитов не выявлено. Другие противоэпилептические лекарственные средства, такие как фенитоин, карбамазепин, фенобарбитал и примидон, вызывают метаболизм печеночного лекарственного средства, и печеночный клиренс тиагабина увеличивается при одновременном назначении с этими лекарственными средствами.
Нет никаких доказательств того, что тиагабин вызывает клинически значимую индукцию или ингибирование печеночных ферментов, метаболизирующих лекарственные средства, в клинических дозах.
Период полувыведения тиагабина из плазмы составляет 7–9 часов, за исключением индуцированных пациентов, где он составляет 2-3 часа.
Поглощение и устранение тиагабина являются линейными в пределах диапазона терапевтических доз.
Печеночная недостаточность
Исследование пациентов с легкими и умеренными нарушениями функции печени показало 50% увеличение пика концентрации в плазме (Cmax) и 70% увеличение площади под кривой (AUC) для общего (свободного плюс связанного) тиагабина у людей с нарушениями. по сравнению с людьми с нормальной функцией печени. Доля несвязанного лекарственного средства была выше у пациентов с умеренной печеночной недостаточностью, и, как следствие, воздействие несвязанного лекарственного средства было увеличено в большей степени (до 2 раз) у лиц с умеренными нарушениями по сравнению с индивидуумами с нормальной функцией печени. Период полураспада Tiagabine (T 1/2 ) продлен у пациентов с нарушениями функции печени, причем степень продления увеличивается с увеличением уровня печеночной недостаточности. Из-за побочных эффектов, наблюдаемых у пациентов с умеренной степенью нарушения, пациенты с выраженной печеночной недостаточностью не изучались (см. Раздел 4.3).
Дозу тиагабина следует тщательно подбирать у пациентов с эпилепсией и сниженной функцией печени. Более низкие дозы или более длительные интервалы дозирования могут потребоваться у пациентов с нарушениями функции печени от легкой до умеренной степени (см. Раздел 4.2).
5.3 Доклинические данные по безопасности
Данные по безопасности животных, полученные на крысах, мышах и собаках, не дали четких доказательств токсичности для конкретных органов или каких-либо данных, представляющих интерес для терапевтического применения тиагабина.Собака, по-видимому, особенно чувствительна к фармакологическим действиям тиагабина и клиническим признакам, таким как седативный эффект, нечувствительность, атаксия и нарушение зрения, отражающие эффекты на ЦНС, наблюдались при ежедневных дозах 0,5 мг / кг и выше в зависимости от дозы. Результаты широкого спектра тестов на мутагенность показали, что тиагабин вряд ли будет генотоксичен для человека. Кластогенная активность наблюдалась только при цитотоксических концентрациях (>> 200-кратный уровень в плазме человека) с использованием теста на лимфоциты человека in vitro в отсутствие метаболизирующей системы. В длительных исследованиях канцерогенности, проведенных на крысах и мышах, только исследование на крысах выявило слегка увеличенные случаи гепатоцеллюлярных аденом у женщин и доброкачественных опухолей клеток Лейдига только в группе с высокой дозой (200 мг / кг / день). Эти изменения считаются специфичными для крыс, и макрофаги и воспаление наблюдались чаще, чем обычно. Значение этого последнего открытия неизвестно.
6. Фармацевтические особенности
6.1 Список вспомогательных веществ
Ядро планшета:
Целлюлоза, микрокристаллическая (E460)
Аскорбиновая кислота (E300)
Лактоза безводная
Крахмал, предварительно желатинизированный (кукуруза)
кросповидон
Кремнезем, коллоидный безводный (E551)
Гидрогенизированное растительное масло (Тип 1)
Стеариновая кислота
Стеарат магния
Покрытие пленки:
гипромеллоза
Гидроксипропилцеллюлоза (E463)
Диоксид титана (E171)
6.2 Несовместимости
Никто.
6.3 Срок годности
3 года
6.4 Особые меры предосторожности при хранении
Не хранить в холодильнике и не замораживать. Хранить в оригинальной упаковке.
6.5 Характер и содержимое контейнера
Устойчивые к детям, белые полиэтиленовые бутылки с белыми полипропиленовыми винтовыми крышками. Каждая бутылка содержит полиэтиленовую канистру высокой плотности из активированного глинистого осушителя.
Упаковки, содержащие по 50 и 100 таблеток. Не все размеры упаковки могут продаваться.
6.6 Особые меры предосторожности при утилизации и другом обращении
Никаких специальных инструкций
7. Владелец торговой лицензии
Кефалон УК Лимитед
Ridings Point
Уистлер Драйв
Castleford
Западный Йоркшир
WF10 5HX
Объединенное Королевство
Состав
Капсула в оболочке содержит 25/50/75//150/300 мг активного вещества Прегабалина.
Дополнительные компоненты: прежелатинизированный крахмал (кукурузный), тальк.
Состав оболочки: жёлтый краситель оксид Fe, диоксид титана, желатин.
Форма выпуска
Альгерика выпускается в виде непрозрачных капсул различного цвета в зависимости от дозировки.
- 25 мг – желтоватый оттенок, на крышке надпись чёрного цвета «7622»;
- 50 мг – желтоватый оттенок, на крышке и на корпусе размещена радиальная полоса чёрного цвета, на крышке печать «7623»;
- 75 мг – желтоватый оттенок, крышечка розового цвета. На корпусе печать «7624»;
- 150 мг – жёлтый оттенок, на корпусе чёрная печать «7626»;
- 300 мг – корпус жёлтого цвета, крышечка – розового, печать чёрного цвета «7621».
Внутри каждой капсулы гранулированный белый порошок (может быть частично спрессован). Таблетки Альгерика не выпускаются.
Фармакологическое действие
Противоэпилептическое, противосудорожное средство. Действующее вещество — анкилированный аналог ГАМК Прегабалин. Активный компонент схож по своей структуре с ГАМК, но при этом не обладает характерной для ГАМК активностью. Для Прегабалина не свойственно ГАМКергическое воздействие (опосредованное и прямое).
Принцип воздействия медикамента основан на способности действующего компонента вступать в контакт и связываться со специальной субъединицей кальциевых потенциалзависимых каналов нейронов. Компенсаторно в ответ на потенциал действия снижается транспортировка кальция в нейрональные клетки. Для активного вещества характерно особое сродство с протеином (альфа2-дельта), который находится в нервной системе.
На фоне применения Прегабалина снижается выработка и высвобождение болевых нейротрансмиттеров (норадреналин, глутамат, субстанция Р) в синаптические щели при нейрональном возбуждении. Механизм действия активного вещества ведёт к избирательному подавлению импульсного проведения. Для медикамента характерно воздействие на сеть нейронов только при патологии нервной системы.
Фармакодинамика и фармакокинетика
Для активного компонента характерна линейная фармакокинетика. Показатель межиндивидуальной вариабельности достаточно низок — меньше 20%. Необходимости постоянного контроля над концентрацией действующего вещества во время лечения нет, т.к. уровень Прегабалина после однократного применения равен его концентрации после повторного приёма.
Всасывание
После приёма натощак действующий компонент хорошо абсорбируется из просвета пищеварительного тракта. Максимальная концентрация регистрируется через 1 час после разового применения. Показатель Тmax после повторных приёмов не меняется. Биологическая доступность составляет 90% и не зависит от дозировки медикамента.
После повторного приёма показатель Css достигается через 24-48 часов. Пища снижает степень и скорость абсорбции активного вещества (Сmax уменьшается на 25-30%, а Tmax повышается на 2.5 часа). При этом не происходит клинически значимого влияния на абсорбцию Прегабалина при приёме пищи.
Распределение, метаболизм
Действующий компонент способен связываться с плазменными белками. После приёма внутрь Vd равен 0.56 л/кг. Прегабалин выделяется при лактации, проходит через гематоплацентарный барьер и ГЭБ.
Активный компонент почти не подвергается метаболизму. 1% принятой дозы метаболизируется до образования основного метаболита N-метилированного соединения, которое выводится через почечную систему. Проявления рацемизации S-энантиомера в R-форму не выявлены.
Выведение
Главный путь выведения — через почечную систему. В среднем T1/2 равен 6.3 часа. Клиренс активного вещества из плазмы и почечный клиренс находятся в прямой пропорциональной зависимости клиренсу креатинина.
Показания к применению
- тревожные состояния (генерализованные формы у взрослых пациентов);
- нейропатический болевой синдром;
- фибромиалгия;
- эпилепсия с парциальными припадками (сопровождаемые и несопровождаемые вторичной генерализацией).
Противопоказания
- беременность;
- индивидуальная гиперчувствительность;
- ограничение по возрасту — до 18 лет;
- лактация.
Относительные противопоказания:
- терапия Оксикодоном, Лоразепамом или Этанолом;
- существенная патология почечной системы;
- сахарный диабет;
- энцефалопатия;
- сердечная недостаточность;
- пожилой возраст;
- медикаментозная зависимость.
Побочные действия Альгерика
Органы зрения:
- повышенное слезотечение;
- косоглазие;
- нарушение зрительного восприятия;
- раздражение глаз;
- диплопия;
- снижение остроты зрения;
- мидриаз;
- астенопия;
- усиление яркости зрительного восприятия;
- отёчность глаз;
- утрата периферического зрения.
Нервная система:
- эйфория;
- головокружение;
- дезориентация;
- нарушение координации;
- бессонница;
- раздражительность;
- снижение либидо;
- летаргия;
- нарушение равновесия;
- тремор конечностей;
- атаксия;
- нарушения памяти;
- седативное действие;
- амнезия;
- кошмарные сновидения;
- лабильность настроения;
- аноргазмия;
- спутанность сознания;
- деперсонализация;
- беспокойство;
- ажитация;
- депрессивное настроение;
- подавленность настроения;
- миоклонические судороги;
- панические атаки;
- галлюцинации;
- дисграфия;
- трудности в подборе слов;
- растормаживание;
- обморок;
- потеря вкусовых ощущений;
- психомоторное возбуждение;
- ослабление рефлексов;
- нистагм;
- интенционный тремор;
- обмороки;
- ступор;
- паросмия;
- гипокинезия.
Сердечно-сосудистая система:
- атриовентрикулярная блокада 1 степени;
- синусовая брадикардия;
- синусовая тахикардия;
- нестабильность кровяного давления (повышение/снижение);
- приливы тока крови к коже лица;
- синусовая аритмия.
Дыхательная система:
- заложенность носа;
- одышка;
- храп;
- носовое кровотечение;
- сухость слизистых оболочек носа;
- ринит;
- ощущение стеснения в ротоглотке.
Пищеварительный тракт:
- запоры;
- вздутие живота, метеоризм;
- сухость во рту;
- асцит;
- гиперестезия слизистой рта;
- усиленное слюноотделение;
- рвота;
- ГЭРБ;
- панкреатит;
- дисфагия.
Кожные покровы:
- холодный пот;
- потливость;
- папулёзная сыпь;
- крапивница.
Мочеполовая система:
- дизурические проявления;
- почечная недостаточность;
- недержание мочи;
- олигурия.
Соединительная ткань, костно-мышечная система:
- боли в области шеи;
- мышечная скованность;
- подёргивание мышц;
- мышечные спазмы;
- боли в спине;
- миалгия;
- отёчность суставов;
- рабдомиолиз.
Репродуктивная система:
- боли в молочных железах;
- дисменорея;
- эректильная дисфункция;
- задержка эякуляции;
- сексуальная дисфункция;
- выделения из молочных желез;
- аменорея.
Иные реакции:
- нарушение походки;
- периферическая отёчность;
- утомляемость;
- чувство стеснения в груди;
- ощущение опьянения;
- боль;
- озноб;
- гиперакузия;
- назофарингит;
- жажда;
- лейкопения;
- гипертермия;
- вертиго;
- задержка мочеиспускания;
- генерализованные отёки.
Альгерика, инструкция по применению (Способ и дозировка)
Капсулы предназначены для приёма per os. Суточная дозировка 150-600 мг (2-3 приёма). Капсулы запивают жидкостью, не допускается разламывание, измельчение.
Схема лечения, длительность терапии определяются отдельно для каждого пациента, оценивая особенности течения основного заболевания, сопутствующую патологию, переносимость терапии.
Терапия нейропатического болевого синдрома
Лечение начинают с суточного приёма 150 мг Прегабалина, разделённых на 2-3 приёма. Через 3-7 дней терапии в зависимости от переносимости медикамента суточное количество препарат увеличивают до 300 мг. При необходимости через неделю дозу повышают до 600 мг/сутки (максимально допустимая производителем дозировка).
Терапия эпилепсии с судорожными парциальными припадками (дополнительная)
Первоначальная дозировка – 150 мг в сутки (2-3 приёма). Через неделю дозу повышают до 300 мг. Еще через неделю количество медикамента может быть увеличено до 600 мг (допустимый максимум).
Терапия тревожных генерализованных расстройств
Лечение начинают со 150 мг в сутки (2-3 приёма). Через неделю дозу увеличивают вдвое – до 300 мг. Еще через неделю при отсутствии ожидаемой реакции количество Прегабалина может быть увеличено до 450 мг в день. Еще через неделю при необходимости дозировку повышают до 600 мг (максимум).
Терапия Фибромиалгии
Лечение Прегабалином начинают со 150 мг в сутки (2-3 приёма). Через 7 дней доктор может увеличить дозировку до 300 мг. Еще через неделю при отсутствии ожидаемой реакции дозу медикамента повышают до 450 мг. Через еще 7 дней количество препарата может быть увеличено до максимума – 600 мг/сутки.
Альгерика отменяют постепенно (минимум 1 неделю).
Передозировка
Данных нет. Есть упоминания о случайном приёме 8 г препарат при клинических исследованиях. Заметные проявления зарегистрированы не были.
При передозировке проводятся стандартные процедуры: промывание пищеварительного тракта, приём энтеросорбирующих лекарственных средств, проведение посиндромного лечения. Гемодиализ эффективен.
Взаимодействие
Прегабалин редко вступает в фармакологическое взаимодействие с иными медикаментами, т.к. не связывается с плазменными белками, не способен ингибировать in vitro метаболизм лекарственных средств и выводится через почечную систему в неизменном виде.
Допускается фармакологическое взаимодействие с Вальпроевой кислотой, фенитоином, Этанолом, Ламотриджином, Карбамазепином, Лоразепамом, Габапентином, Оксикодоном.
Фармакологический анализ доказал, что на клиренс Прегабалина не влияют: Тиагабин, Фенобарбитал, Инсулин, диуретические средства, гипогликемические препараты (пероральные), Топирамат.
Одновременный приём пероральных форм контрацептивов (Этинилэстрадиол, Норэтистерон) совместно с Прегабалином не оказывает влияния на фармакокинетику.
Прегабалин способен усиливать нарушения двигательных (основных и мнестических) функций, вызванных Оксикодоном. Возможно повышение активности Лоразепама и Этанола во время приёма Прегабалина.
Ослабление функций нижних отделов пищеварительного тракта (кишечная непроходимость, запоры) наблюдаются при применении опиоидных анальгетических препаратов.
Условия продажи
Альгерика продаётся в аптеках. Необходимо предъявлять рецептурный бланк от врача с печатями.
Условия хранения
Капсулы должны храниться при температуре до 25 градусов.
Срок годности
2 года.
Особые указания
При прибавке в весе у пациентов, страдающих сахарным диабетом, рекомендуется корректировка дозирования гипогликемических медикаментов. При регистрации симптоматики ангионевротического отёка терапию Прегабалином прекращают.
Во время лечения могут развиться нарушения зрительного восприятия (потеря или снижение остроты), которые проходят самостоятельно при длительной терапии, а также после отмены медикамента. Были зарегистрированы случаи почечной недостаточности, которая носила обратимый характер.
Лекарственное средство может вызывать сонливость и головокружения, которые повышают риск случайных падений и травматизации у лиц пожилого возраста. Описаны случаи возникновения медикаментозной зависимости. Недопустимо выполнение сложных видов работ, управление автотранспортом во время лечения.
Аналоги Альгерика
Совпадения по коду АТХ 4-го уровня:
- Прегабалин-Канон;
- Лирика;
- Прегабалин-Рихтер;
- Прабегин.
Детям
Альгерика не применяется в педиатрии.
При беременности (и лактации)
Беременность – абсолютное противопоказание для применения медикамента, т.к. его безопасность для плода не доказана.
Данных о выделении у женщин Прегабалина при лактации нет, но путём экспериментальных исследований было доказано, что активный компонент выводится у кормящих крыс с грудным молоком. Производителем рекомендуется приостанавливать грудное вскармливание на время терапии Прегабалином.
Отзывы об Альгерика
Пациенты оставляют достаточно противоречивые отзывы о препарате. Кто-то подтверждает эффективность Прегабалина в терапии заявленных производителем заболеваниях, а кто-то указывает на абсолютное отсутствие эффекта даже после длительного применения.
Чаще всего пациенты отмечают негативные реакции со стороны пищеварительного тракта, которые нивелируются, если принимать капсулы во время еды и запивать их больших количеством жидкости.
Цена на Альгерика, где купить
Средняя стоимость препарата в России – 1000 рублей. Купить Альгерика на Украине можно за 400 грн.
Generic name: tiagabine [ tye-AG-a-been ]
Brand name: Gabitril
Dosage form: oral tablet (12 mg; 16 mg; 2 mg; 20 mg; 4 mg)
Drug class: Gamma-aminobutyric acid reuptake inhibitors
What is tiagabine?
Tiagabine is an anti-epileptic medication, also called an anticonvulsant.
Tiagabine is used in combination with other medications to treat partial seizures in adults and children who are at least 12 years old.
Tiagabine may also be used for purposes not listed in this medication guide.
Tiagabine side effects
Get emergency medical help if you have signs of an allergic reaction: hives; fever; swollen glands; painful sores in or around your eyes or mouth; difficulty breathing; swelling of your face, lips, tongue, or throat.
New seizures have occurred in some people who are not epileptic who take medicine for partial seizures. Call your doctor at once if you have new or worsening seizures.
Report any new or worsening symptoms to your doctor, such as: mood or behavior changes, anxiety, panic attacks, trouble sleeping, or if you feel impulsive, irritable, agitated, hostile, aggressive, restless, hyperactive (mentally or physically), more depressed, or have thoughts about suicide or hurting yourself.
Tiagabine may cause serious side effects. Call your doctor at once if you have:
-
new or worsened seizures;
-
confusion, extreme weakness;
-
a light-headed feeling, like you might pass out;
-
vision problems; or
-
severe skin reaction—fever, sore throat, swelling in your face or tongue, burning in your eyes, skin pain followed by a red or purple skin rash that spreads (especially in the face or upper body) and causes blistering and peeling.
Common side effects of tiagabine may include:
-
tiredness, lack of energy;
-
dizziness, drowsiness;
-
nausea, stomach pain;
-
feeling nervous or irritable;
-
tremors; or
-
trouble concentrating.
This is not a complete list of side effects and others may occur. Call your doctor for medical advice about side effects. You may report side effects to FDA at 1-800-FDA-1088.
Warnings
Call your doctor at once if you have new or worsening seizures.
Do not stop using tiagabine suddenly. Stopping suddenly may cause increased seizures.
Before taking this medicine
You should not use tiagabine if you are allergic to it.
Tell your doctor about all other seizure medications you currently use. The safest dose of tiagabine may depend what other medicines you take in combination with it.
New seizures have occurred in some people who are not epileptic who take medicine for partial seizures.
To make sure tiagabine is safe for you, tell your doctor if you have:
-
a confirmed diagnosis of epilepsy;
-
a history of a seizure that did not stop (also called status epilepticus);
-
liver disease;
-
a history of abnormal brain wave test (EEG); or
-
a history of depression, mood disorder, or suicidal thoughts or actions.
Some people have thoughts about suicide while taking seizure medication. Your doctor should check your progress at regular visits. Your family or other caregivers should also be alert to changes in your mood or symptoms.
Follow your doctor’s instructions about taking seizure medication if you are pregnant. Do not start or stop taking tiagabine without your doctor’s advice, and tell your doctor right away if you become pregnant. Tiagabine may cause harm to an unborn baby, but having a seizure during pregnancy could harm both mother and baby. The benefit of preventing seizures may outweigh any risks to the baby.
If you are pregnant, your name may be listed on a pregnancy registry. This is to track the outcome of the pregnancy and to evaluate any effects of tiagabine on the baby.
Tiagabine can pass into breast milk and may harm a nursing baby. Tell your doctor if you are breast-feeding a baby.
Tiagabine should not be given to a child younger than 12 years old.
How should I take tiagabine?
Follow all directions on your prescription label. Your doctor may occasionally change your dose to make sure you get the best results. Do not use this medicine in larger or smaller amounts or for longer than recommended.
Tiagabine is often given in combination with other medications. Your dose of tiagabine may need to be changed if you start or stop using other seizure medicines.
Follow your doctor’s dosing instructions very carefully.
Take tiagabine with food.
Your doctor will need to check your progress while you are using tiagabine. To make sure you are taking a safe dose of tiagabine, your blood may need to be tested on a regular basis.
Use tiagabine regularly to get the most benefit. Get your prescription refilled before you run out of medicine completely.
Wear a medical alert tag or carry an ID card stating that you take tiagabine. Any medical care provider who treats you should know that you take seizure medication.
Do not stop using tiagabine suddenly, even if you feel fine. Stopping suddenly may cause increased seizures. Follow your doctor’s instructions about tapering your dose.
Store at room temperature away from moisture, heat, and light.
What happens if I miss a dose?
Take the missed dose as soon as you remember. Skip the missed dose if it is almost time for your next scheduled dose. Do not take extra medicine to make up the missed dose.
Call your doctor for instructions if you miss several doses in a row.
What happens if I overdose?
Seek emergency medical attention or call the Poison Help line at 1-800-222-1222.
Overdose symptoms may include slurred speech, severe weakness or drowsiness, muscle stiffness, problems with coordination, confusion, increased seizures, or feeling hostile or agitated.
What should I avoid while taking tiagabine?
tiagabine may cause blurred vision and may impair your thinking or reactions. Be careful if you drive or do anything that requires you to be alert and able to see clearly.
Drinking alcohol with this medicine can cause side effects.
What other drugs will affect tiagabine?
Taking this medicine with other drugs that make you sleepy can worsen this effect. Ask your doctor before taking tiagabine with a sleeping pill, narcotic pain medicine, muscle relaxer, or medicine for anxiety, depression, or seizures.
Tell your doctor about all your current medicines and any you start or stop using, especially:
-
medicine to treat a psychiatric disorder;
-
diet pills, stimulants, or ADHD medication;
-
narcotic medicine; or
-
other seizure medicines—carbamazepine, phenytoin, phenobarbital, primidone, valproate.
This list is not complete. Other drugs may interact with tiagabine, including prescription and over-the-counter medicines, vitamins, and herbal products. Not all possible interactions are listed in this medication guide.
Further information
Remember, keep this and all other medicines out of the reach of children, never share your medicines with others, and use this medication only for the indication prescribed.
Always consult your healthcare provider to ensure the information displayed on this page applies to your personal circumstances.
Medical Disclaimer
Copyright 1996-2023 Cerner Multum, Inc. Version: 8.01.





