Промышленность уже давно потребляет огромные количества серной кислоты. Учитывая разнообразие областей применения, это вещество производят в массовом масштабе. Несмотря на все более жесткие экологические и правовые ограничения, производство серной кислоты не снижается.

Постоянный спрос на это химическое соединение свидетельствует о том, насколько оно необходимо для мировой экономики. H2SO4 – это „едкая кровь” промышленности, пульсирующая в бесчисленных производственных установках по всему миру. С серной кислотой работают профессионалы, оперирующие в различных отраслях промышленности. Для многих исследований и экспериментов используют ее ученые, а с ее помощью знания получают в химических лабораториях студенты и ученики. Сегодня сложно себе представить функционирование современной экономики без серной кислоты. Свойства серной кислоты делают ее незаменимым сырьем и реактантом, которое трудно вытеснить даже самыми инновационными химическими соединениями, выпускаемыми на рынок производителями химических веществ.
Характеристика и свойства H2SO4
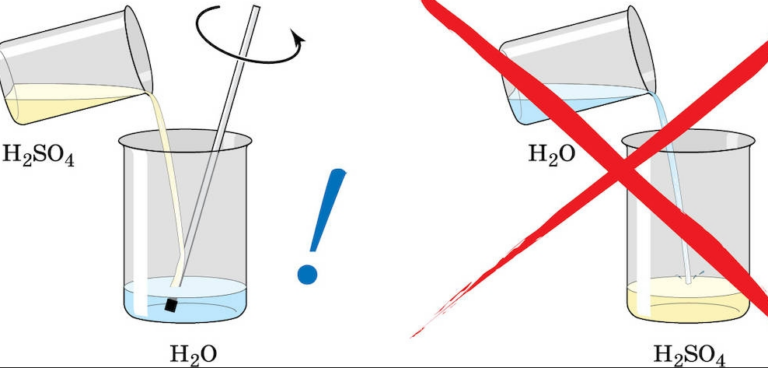
Серная кислота – это одна из наиболее сильно действующих минеральных кислот. Она представляет собой маслянистую, тяжелую и бесцветную жидкость с необыкновенно сильными гигроскопическими свойствами. В своей концентрированной форме обладает также сильными окислительными свойствами. Серная кислота очень хорошо растворяется в воде во всех соотношениях, выделяя большое количество тепла. Именно поэтому необходимо помнить о том, чтобы наливать кислоту в воду, а не наоборот. Возможно изготовление серной кислоты даже с концентрацией 99%, однако, потери оксида серы при температуре близкой к температуре кипения приводят к образованию азеотропа с водой концентрацией 98,3%. Из-за этого серную кислоту обычно хранят в виде 98%-ного раствора. Конечно, H2SO4 может иметь разные концентрации. Наиболее широко применяемыми водными растворами серной кислоты являются:
— 10% — т.н. сильно разведенная серная кислота, используемая, обычно, в качестве обезвоживающего средства, регулятора pH, лабораторного реактива,
— 29-32% — применяют в популярных свинцово-кислотных аккумуляторах,
— 62-70% — используют в качестве удобрения,
— 77-80% — применяют в процессе получения H2SO4 „камерным” методом и используют для производства глауберовой соли, т.е. сульфата натрия (Na2SO4),
— 98% — уже упомянутая ранее серная кислота.
Получение серной кислоты
В промышленности серную кислоту получают контактным способом путем окисления диоксида серы, который образуется, в основном, в результате процессов сжигания серы или сульфидов металлов (напр. пирита). Процесс производства серной кислоты при использовании серы можно разделить на три этапа. Первый из них заключается в производстве диоксида серы. Затем диоксид серы окисляют для получения триоксида серы. Последний этап заключается в превращении оксида серы (VI) в серную кислоту.
Сжигание серы проводят при избытке воздуха с целью полного завершения реакции под давлением на уровне около 0,5 МПа. Весь этот процесс осуществляется при температуре около 150oC в баках, выложенных толстым слоем огне- и кислотостойкого кирпича. Расплавленную серу фильтруют с целью удаления примесей (в основном это железо и органические соединения). Часто в процессе применяют также известь, чтобы уменьшить кислотность расплавленной серы, тем самым ограничивая ее коррозийные свойства. Расплавленную серу подают в горелки, где она сгорает. Смесь диоксида серы и воздуха, выходящую из горелки, затем пропускают через фильтр, который удаляет любые загрязнения.
На следующем этапе диоксид серы превращают в триоксид серы в результате реакции с кислородом в присутствии катализатора. Широко используемым катализатором является пятиокись ванадия (V2O5), а в качестве его носителя используют сульфат калия. Функцию подложки для катализатора, как правило, исполняет диоксид кремния или глинокремнеземы, которые характеризуются очень высокой пористостью, обеспечивая тем самым большую площадь для протекания реакции. Скорость протекания процесса зависит также от температуры. На практике ее поддерживают на уровне около 500oC, чтобы обеспечить достаточную скорость реакции при максимально высокой конверсии.
Последний этап производства серной кислоты заключается в абсорбции SO3 в концентрированной H2SO4 или олеуме с целью предотвращения образования трудно поддающегося конденсации т.н. тумана серной кислоты. Серная кислота с концентрацией 98% циркулирует с такой скоростью, что вновь поглощаемый SO3 вызывает очень незначительное повышение ее концентрации. Весь процесс осуществляется при температуре около 70oC, тем самым максимизируя эффективность поглощения SO3. Кроме того, в бак с кислотой добавляют также воду, разбавляющую кислоту до соответствующей концентрации. Поток серной кислоты постоянно сливают и охлаждают с помощью пластинчатых теплообменников перед подачей в резервуары для хранения. Общее преобразование серы в серную кислоту составляет примерно 99%.
Применение серной кислоты
Серная кислота имеет огромное значение во многих отраслях промышленности. Наибольший расход H2SO4 наблюдается в производстве минеральных удобрений. Это, в основном, связано с производством суперфосфатов, а также фосфата и сульфата аммония. Серная кислота имеет также большое значение при производстве других кислот, например, соляной, азотной и фосфорной кислот. Ее используют также в производстве взрывчатых веществ в качестве одного из видов сырья для производства тротила (TNT). В свою очередь, в нефтехимической промышленности H2SO4 применяют, в основном, для осушения масел, керосина и парафина. Она выполняет также роль катализатора в реакции получения изооктана, являющегося одним из основных компонентов бензина. Серную кислоту используют также в горнодобывающей и металлургической промышленностях в процессах обогащения руд меди. H2SO4 является также электролитом в популярных свинцово-кислотных аккумуляторах. Кроме того, серная кислота находит широкое применение в производстве моющих средств (напр. лаурилсульфата натрия), а также в косметической промышленности, где ее используют для производства сырья и полуфабрикатов (напр. нитрата серебра), а также перекиси водорода или же душистых веществ.
Такое широкое применение серной кислоты приводит к тому, что в случае ее отсутствия невозможным или просто невыгодным было бы проведение многих основных и весьма важных промышленных процессов.
Серная кислота в Группе РСС
PCC Rokita имеет устойчивую позицию поставщика водной серной кислоты с концентрацией 77%. H2SO4 мы производим в Комплексе Хлора контактным способом, что гарантирует очень высокую чистоту и однородность получаемого продукта. Предложение на поставку серной кислоты Группы РСС адресовано, прежде всего, производителям фосфорных удобрений, бумаги и глауберовой соли, т.е. сульфата натрия (Na2SO4). Последний продукт может быть также использован в производстве древесной массы, стекла, красителей и моющих средств. Сульфат натрия применяют также в медицине в качестве слабительного средства.
Серная кислота – это незаменимое сырье во многих технологических процессах, а ее чрезвычайно разнообразный рынок стоит на пороге многих вызовов. Опасения, связанные с негативным воздействием на окружающую среду, могут сбалансировать или даже ослабить спрос на это популярное сырье. Однако, тот факт, что H2SO4, несмотря на присутствие в химической промышленности уже столько лет, не теряет свою популярность и по-прежнему является одним из самых необходимых химических веществ, используемых в промышленности в массовом масштабе.
«Oil of vitriol» redirects here. For sweet oil of vitriol, see Diethyl ether.
«Sulphuric acid» redirects here. For the novel by Amélie Nothomb, see Sulphuric Acid (novel).
|
||

|
||
| Names | ||
|---|---|---|
| IUPAC name
Sulfuric acid |
||
| Other names
Oil of vitriol |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.763 |
|
| EC Number |
|
|
| E number | E513 (acidity regulators, …) | |
|
Gmelin Reference |
2122 | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1830 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H2SO4, sometimes expressed (HO)2SO2 | |
| Molar mass | 98.079 g/mol | |
| Appearance | Colorless viscous liquid | |
| Odor | Odorless | |
| Density | 1.8302 g/cm3, liquid[1] | |
| Melting point | 10.31[1] °C (50.56 °F; 283.46 K) | |
| Boiling point | 337[1] °C (639 °F; 610 K) When sulfuric acid is above 300 °C (572 °F; 573 K), it gradually decomposes to SO3 + H2O |
|
|
Solubility in water |
miscible, exothermic | |
| Vapor pressure | 0.001 mmHg (20 °C)[2] | |
| Acidity (pKa) | pKa1 = −2.8 pKa2 = 1.99 |
|
| Conjugate base | Bisulfate | |
| Viscosity | 26.7 cP (20 °C) | |
| Structure[3] | ||
|
Crystal structure |
monoclinic | |
|
Space group |
C2/c | |
|
Lattice constant |
a = 818.1(2) pm, b = 469.60(10) pm, c = 856.3(2) pm α = 90°, β = 111.39(3) |
|
|
Formula units (Z) |
4 | |
| Thermochemistry | ||
|
Std molar |
157 J/(mol·K)[4] | |
|
Std enthalpy of |
−814 kJ/mol[4] | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H314 | |
|
Precautionary statements |
P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |
| NFPA 704 (fire diamond) |
 3 0 2 W |
|
| Flash point | Non-flammable | |
|
Threshold limit value (TLV) |
15 mg/m3 (IDLH), 1 mg/m3 (TWA), 2 mg/m3 (STEL) | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
2140 mg/kg (rat, oral)[5] | |
|
LC50 (median concentration) |
[5] |
|
|
LCLo (lowest published) |
87 mg/m3 (guinea pig, 2.75 hr)[5] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[2] | |
|
REL (Recommended) |
TWA 1 mg/m3[2] | |
|
IDLH (Immediate danger) |
15 mg/m3[2] | |
| Safety data sheet (SDS) | External MSDS | |
| Related compounds | ||
|
Related strong acids |
|
|
|
Related compounds |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sulfuric acid (American spelling and the preferred IUPAC name) or sulphuric acid (Commonwealth spelling), known in antiquity as oil of vitriol, is a mineral acid composed of the elements sulfur, oxygen, and hydrogen, with the molecular formula H2SO4. It is a colorless, odorless, and viscous liquid that is miscible with water.[6]
Pure sulfuric acid does not occur naturally due to its strong affinity to water vapor; it is hygroscopic and readily absorbs water vapor from the air.[6] Concentrated sulfuric acid is highly corrosive towards other materials, from rocks to metals, since it is an oxidant with powerful dehydrating properties. Phosphorus pentoxide is a notable exception in that it is not dehydrated by sulfuric acid but, to the contrary, dehydrates sulfuric acid to sulfur trioxide. Upon addition of sulfuric acid to water, a considerable amount of heat is released; thus, the reverse procedure of adding water to the acid should not be performed since the heat released may boil the solution, spraying droplets of hot acid during the process. Upon contact with body tissue, sulfuric acid can cause severe acidic chemical burns and even secondary thermal burns due to dehydration.[7][8] Dilute sulfuric acid is substantially less hazardous without the oxidative and dehydrating properties; however, it should still be handled with care for its acidity.
Sulfuric acid is a very important commodity chemical; a country’s sulfuric acid production is a good indicator of its industrial strength.[9][non-primary source needed] It is widely produced with different methods, such as contact process, wet sulfuric acid process, lead chamber process, and some other methods.[which?][10] Sulfuric acid is also a key substance in the chemical industry. It is most commonly used in fertilizer manufacture[11] but is also important in mineral processing, oil refining, wastewater processing, and chemical synthesis. It has a wide range of end applications, including in domestic acidic drain cleaners,[12] as an electrolyte in lead-acid batteries, in dehydrating a compound, and in various cleaning agents.
Sulfuric acid can be obtained by dissolving sulfur trioxide in water.
Physical properties[edit]
Grades of sulfuric acid[edit]
Although nearly 100% sulfuric acid solutions can be made, the subsequent loss of SO3 at the boiling point brings the concentration to 98.3% acid. The 98.3% grade, which is more stable in storage, is the usual form of what is described as «concentrated sulfuric acid». Other concentrations are used for different purposes. Some common concentrations are:[13][14]
| Mass fraction H2SO4 |
Density (kg/L) |
Concentration (mol/L) |
Common name |
|---|---|---|---|
| <29% | 1.00-1.25 | <4.2 | diluted sulfuric acid |
| 29–32% | 1.25–1.28 | 4.2–5.0 | battery acid (used in lead–acid batteries) |
| 62–70% | 1.52–1.60 | 9.6–11.5 | chamber acid fertilizer acid |
| 78–80% | 1.70–1.73 | 13.5–14.0 | tower acid Glover acid |
| 93.2% | 1.83 | 17.4 | 66 °Bé («66-degree Baumé») acid |
| 98.3% | 1.84 | 18.4 | concentrated sulfuric acid |
«Chamber acid» and «tower acid» were the two concentrations of sulfuric acid produced by the lead chamber process, chamber acid being the acid produced in the lead chamber itself (<70% to avoid contamination with nitrosylsulfuric acid) and tower acid being the acid recovered from the bottom of the Glover tower.[13][14] They are now obsolete as commercial concentrations of sulfuric acid, although they may be prepared in the laboratory from concentrated sulfuric acid if needed. In particular, «10 M» sulfuric acid (the modern equivalent of chamber acid, used in many titrations), is prepared by slowly adding 98% sulfuric acid to an equal volume of water, with good stirring: the temperature of the mixture can rise to 80 °C (176 °F) or higher.[14]
Sulfuric acid[edit]
Sulfuric acid contains not only H2SO4 molecules, but is actually an equilibrium of many other chemical species, as it is shown in the table below.
| Species | mMol/kg |
|---|---|
| HSO−4 | 15.0 |
| H3SO+4 | 11.3 |
| H3O+ | 8.0 |
| HS2O−7 | 4.4 |
| H2S2O7 | 3.6 |
| H2O | 0.1 |
Sulfuric acid is a colorless oily liquid, and has a vapor pressure of <0.001 mmHg at 25 °C and 1 mmHg at 145.8 °C,[16] and 98% sulfuric acid has a vapor pressure of <1 mmHg at 40 °C.[17]
In the solid state, sulfuric acid is a molecular solid that forms monoclinic crystals with nearly trigonal lattice parameters. The structure consists of layers parallel to the (010) plane, in which each molecule is connected by hydrogen bonds to two others.[3] Hydrates H2SO4·nH2O are known for n = 1, 2, 3, 4, 6.5, and 8, although most intermediate hydrates are stable against disproportionation.[18]
Polarity and conductivity[edit]
Anhydrous H2SO4 is a very polar liquid, having a dielectric constant of around 100. It has a high electrical conductivity, a consequence of autoprotolysis, i.e. self-protonation :[15]
The equilibrium constant for autoprotolysis ( (25 °C) is:[15]
- [H3SO4]+[HSO4]− = 2.7 x 10-4
The corresponding equilibrium constant for water, Kw is 10−14, a factor of 1010 (10 billion) smaller.
In spite of the viscosity of the acid, the effective conductivities of the H3SO+4 and HSO−4 ions are high due to an intramolecular proton-switch mechanism (analogous to the Grotthuss mechanism in water), making sulfuric acid a good conductor of electricity. It is also an excellent solvent for many reactions.
Chemical properties[edit]
Acidity[edit]
The hydration reaction of sulfuric acid is highly exothermic, dilution.[19]
As indicated by its acid dissociation constant, sulfuric acid is a strong acid:
- H2SO4 → H3O+ + HSO−4 Ka1 = 1000
The product of this ionization is HSO−4, the bisulfate anion. Bisulfate is a far weaker acid:
- HSO−4 + H2O → H3O+ + SO2−4 Ka2 = 0.01[20]
The product of this second dissociation is SO2−4, the sulfate anion.
Dehydration[edit]
Concentrated sulfuric acid has a powerful dehydrating property, removing water (H2O) from other chemical compounds such as table sugar (sucrose) and other carbohydrates, to produce carbon, steam, and heat. Dehydration of table sugar (sucrose) is a common laboratory demonstration.[21] The sugar darkens as carbon is formed, and a rigid column of black, porous carbon called a carbon snake may emerge[22] as shown in the figure.
Similarly, mixing starch into concentrated sulfuric acid gives elemental carbon and water. The effect of this can be seen when concentrated sulfuric acid is spilled on paper, which is composed of cellulose; the cellulose reacts to give a burnt appearance in which the carbon appears much like soot that results from fire.
Although less dramatic, the action of the acid on cotton, even in diluted form, destroys the fabric.
The reaction with copper(II) sulfate can also demonstrate the dehydration property of sulfuric acid. The blue crystals change into white powder as water is removed:
Reactions with salts[edit]
Sulfuric acid reacts with most bases to give the corresponding sulfate or bisulfate.
Sulfuric acid reacts with sodium chloride, and gives hydrogen chloride gas and sodium bisulfate:
- NaCl + H2SO4 → NaHSO4 + HCl
Aluminium sulfate, also known as paper maker’s alum, aluminium sulfate is made by treating bauxite with sulfuric acid:
- 2 AlO(OH) + 3 H2SO4 → Al2(SO4)3 + 4 H2O
Sulfuric acid can also be used to displace weaker acids from their salts. Reaction with sodium acetate, for example, displaces acetic acid, CH3COOH, and forms sodium bisulfate:
- H2SO4 + CH3CO2Na → NaHSO4 + CH3COOH
Similarly, treating potassium nitrate with sulfuric acid produces nitric acid.
When combined with nitric acid, sulfuric acid acts both as an acid and a dehydrating agent, forming the nitronium ion NO+2, which is important in nitration reactions involving electrophilic aromatic substitution. This type of reaction, where protonation occurs on an oxygen atom, is important in many organic chemistry reactions, such as Fischer esterification and dehydration of alcohols.
When allowed to react with superacids, sulfuric acid can act as a base and can be protonated, forming the [H3SO4]+ ion. Salts of [H3SO4]+ have been prepared (e.g. trihydroxyoxosulfonium hexafluoroantimonate(V) [H3SO4]+[SbF6]−) using the following reaction in liquid HF:
- [(CH3)3SiO]2SO2 + 3 HF + SbF5 → [H3SO4]+[SbF6]− + 2 (CH3)3SiF
The above reaction is thermodynamically favored due to the high bond enthalpy of the Si–F bond in the side product. Protonation using simply fluoroantimonic acid, however, has met with failure, as pure sulfuric acid undergoes self-ionization to give [H3O]+ ions:
- 2 H2SO4 ⇌ [H3O]+ + [HS2O7]−
which prevents the conversion of H2SO4 to [H3SO4]+ by the HF/SbF5 system.[23]
Reactions with metals[edit]
Even dilute sulfuric acid reacts with many metals via a single displacement reaction, like other typical acids, producing hydrogen gas and salts (the metal sulfate). It attacks reactive metals (metals at positions above copper in the reactivity series) such as iron, aluminium, zinc, manganese, magnesium, and nickel.
- Fe + H2SO4 → H2 + FeSO4
Concentrated sulfuric acid can serve as an oxidizing agent, releasing sulfur dioxide:[7]
- Cu + 2 H2SO4 → SO2 + 2 H2O + SO2−4 + Cu2+
Lead and tungsten, however, are resistant to sulfuric acid.
Reactions with carbon and sulfur[edit]
Hot concentrated sulfuric acid oxidizes carbon[24] (as bituminous coal) and sulfur:
- C + 2 H2SO4 → CO2 + 2 SO2 + 2 H2O
- S + 2 H2SO4 → 3 SO2 + 2 H2O
Electrophilic aromatic substitution[edit]
Benzene undergoes electrophilic aromatic substitution with sulfuric acid to give the corresponding sulfonic acids:[25]
Sulfur–iodine cycle[edit]
Sulfuric acid can be used to produce hydrogen from water:
-
2 I2 + 2 SO2 + 4 H2O → 4 HI + 2 H2SO4 (120 °C, Bunsen reaction) 2 H2SO4 → 2 SO2 + 2 H2O + O2 (830 °C) 4 HI → 2 I2 + 2 H2 (320 °C)
The compounds of sulfur and iodine are recovered and reused, hence the process is called the sulfur–iodine cycle. This process is endothermic and must occur at high temperatures, so energy in the form of heat has to be supplied. The sulfur–iodine cycle has been proposed as a way to supply hydrogen for a hydrogen-based economy. It is an alternative to electrolysis, and does not require hydrocarbons like current methods of steam reforming. But note that all of the available energy in the hydrogen so produced is supplied by the heat used to make it.[26][27]
Occurrence[edit]
Sulfuric acid is rarely encountered naturally on Earth in anhydrous form, due to its great affinity for water. Dilute sulfuric acid is a constituent of acid rain, which is formed by atmospheric oxidation of sulfur dioxide in the presence of water – i.e. oxidation of sulfurous acid. When sulfur-containing fuels such as coal or oil are burned, sulfur dioxide is the main byproduct (besides the chief products carbon oxides and water).
Sulfuric acid is formed naturally by the oxidation of sulfide minerals, such as pyrite:
- 2 FeS2(s) + 7 O2 + 2 H2O → 2 Fe2+ + 4 SO2−4 + 4 H+
The resulting highly acidic water is called acid mine drainage (AMD) or acid rock drainage (ARD).
The Fe2+ can be further oxidized to Fe3+:
- 4 Fe2+ + O2 + 4 H+ → 4 Fe3+ + 2 H2O
The Fe3+ produced can be precipitated as the hydroxide or hydrous iron oxide:
- Fe3+ + 3 H2O → Fe(OH)3↓ + 3 H+
The iron(III) ion («ferric iron») can also oxidize pyrite:
- FeS2(s) + 14 Fe3+ + 8 H2O → 15 Fe2+ + 2 SO2−4 + 16 H+
When iron(III) oxidation of pyrite occurs, the process can become rapid. pH values below zero have been measured in ARD produced by this process.
ARD can also produce sulfuric acid at a slower rate, so that the acid neutralizing capacity (ANC) of the aquifer can neutralize the produced acid. In such cases, the total dissolved solids (TDS) concentration of the water can be increased from the dissolution of minerals from the acid-neutralization reaction with the minerals.
Sulfuric acid is used as a defense by certain marine species, for example, the phaeophyte alga Desmarestia munda (order Desmarestiales) concentrates sulfuric acid in cell vacuoles.[28]
Stratospheric aerosol[edit]
In the stratosphere, the atmosphere’s second layer that is generally between 10 and 50 km above Earth’s surface, sulfuric acid is formed by the oxidation of volcanic sulfur dioxide by the hydroxyl radical:[29]
- SO2 + HO• → HSO3
- HSO3 + O2 → SO3 + HO2
- SO3 + H2O → H2SO4
Because sulfuric acid reaches supersaturation in the stratosphere, it can nucleate aerosol particles and provide a surface for aerosol growth via condensation and coagulation with other water-sulfuric acid aerosols. This results in the stratospheric aerosol layer.[29]
[edit]
The permanent Venusian clouds produce a concentrated acid rain, as the clouds in the atmosphere of Earth produce water rain.[30] Jupiter’s moon Europa is also thought to have an atmosphere containing sulfuric acid hydrates.[31]
Manufacturing[edit]
Sulfuric acid is produced from sulfur, oxygen and water via the conventional contact process (DCDA) or the wet sulfuric acid process (WSA).
Contact process[edit]
In the first step, sulfur is burned to produce sulfur dioxide.
- S(s) + O2 → SO2
The sulfur dioxide is oxidized to sulfur trioxide by oxygen in the presence of a vanadium(V) oxide catalyst. This reaction is reversible and the formation of the sulfur trioxide is exothermic.
- 2 SO2 + O2 ⇌ 2 SO3
The sulfur trioxide is absorbed into 97–98% H2SO4 to form oleum (H2S2O7), also known as fuming sulfuric acid or pyrosulphuric acid. The oleum is then diluted with water to form concentrated sulfuric acid.
- H2SO4 + SO3 → H2S2O7
- H2S2O7 + H2O → 2 H2SO4
Directly dissolving SO3 in water, called the «wet sulfuric acid process», is rarely practiced because the reaction is extremely exothermic, resulting in a hot aerosol of sulfuric acid that requires condensation and separation.
Wet sulfuric acid process[edit]
In the first step, sulfur is burned to produce sulfur dioxide:
- S + O2 → SO2 (−297 kJ/mol)
or, alternatively, hydrogen sulfide (H2S) gas is incinerated to SO2 gas:
- 2 H2S + 3 O2 → 2 H2O + 2 SO2 (−1036 kJ/mol)
The sulfur dioxide then oxidized to sulfur trioxide using oxygen with vanadium(V) oxide as catalyst.
- 2 SO2 + O2 ⇌ 2 SO3 (−198 kJ/mol) (reaction is reversible)
The sulfur trioxide is hydrated into sulfuric acid H2SO4:
- SO3 + H2O → H2SO4(g) (−101 kJ/mol)
The last step is the condensation of the sulfuric acid to liquid 97–98% H2SO4:
- H2SO4(g) → H2SO4(l) (−69 kJ/mol)
Other methods[edit]
A method that is the less well-known is the metabisulfite method, in which metabisulfite is placed at the bottom of a beaker and 12.6 molar concentration hydrochloric acid is added. The resulting gas is bubbled through nitric acid, which will release brown/red vapors of nitrogen dioxide as the reaction proceeds. The completion of the reaction is indicated by the ceasing of the fumes. This method does not produce an inseparable mist, which is quite convenient.
- 3 SO2 + 2 HNO3 + 2 H2O → 3 H2SO4 + 2 NO
Burning sulfur together with saltpeter (potassium nitrate, KNO3), in the presence of steam, has been used historically. As saltpeter decomposes, it oxidizes the sulfur to SO3, which combines with water to produce sulfuric acid.
Alternatively, dissolving sulfur dioxide in an aqueous solution of an oxidizing metal salt such as copper(II) or iron(III) chloride:
- 2 FeCl3 + 2 H2O + SO2 → 2 FeCl2 + H2SO4 + 2 HCl
- 2 CuCl2 + 2 H2O + SO2 → 2 CuCl + H2SO4 + 2 HCl
Two less well-known laboratory methods of producing sulfuric acid, albeit in dilute form and requiring some extra effort in purification. A solution of copper(II) sulfate can be electrolyzed with a copper cathode and platinum/graphite anode to give spongy copper at cathode and evolution of oxygen gas at the anode, the solution of dilute sulfuric acid indicates completion of the reaction when it turns from blue to clear (production of hydrogen at cathode is another sign):
- 2 CuSO4 + 2 H2O → 2 Cu + 2 H2SO4 + O2
More costly, dangerous, and troublesome yet novel is the electrobromine method, which employs a mixture of sulfur, water, and hydrobromic acid as the electrolytic solution. The sulfur is pushed to bottom of container under the acid solution. Then the copper cathode and platinum/graphite anode are used with the cathode near the surface and the anode is positioned at the bottom of the electrolyte to apply the current. This may take longer and emits toxic bromine/sulfur bromide vapors, but the reactant acid is recyclable. Overall, only the sulfur and water are converted to sulfuric acid and hydrogen (omitting losses of acid as vapors):
- 2 HBr → H2 + Br2 (electrolysis of aqueous hydrogen bromide)
- Br2 + Br− ↔ Br−3 (initial tribromide production, eventually reverses as Br− depletes)
- 2 S + Br2 → S2Br2 (bromine reacts with sulfur to form disulfur dibromide)
- S2Br2 + 8 H2O + 5 Br2 → 2 H2SO4 + 12 HBr (oxidation and hydration of disulfur dibromide)
Prior to 1900, most sulfuric acid was manufactured by the lead chamber process.[32] As late as 1940, up to 50% of sulfuric acid manufactured in the United States was produced by chamber process plants.
In the early to mid 19th century «vitriol» plants existed, among other places, in Prestonpans in Scotland, Shropshire and the Lagan Valley in County Antrim Ireland, where it was used as a bleach for linen. Early bleaching of linen was done using lactic acid from sour milk but this was a slow process and the use of vitriol sped up the bleaching process.[33]
Uses[edit]
Sulfuric acid is a very important commodity chemical, and indeed, a nation’s sulfuric acid production is a good indicator of its industrial strength.[9] World production in the year 2004 was about 180 million tonnes, with the following geographic distribution: Asia 35%, North America (including Mexico) 24%, Africa 11%, Western Europe 10%, Eastern Europe and Russia 10%, Australia and Oceania 7%, South America 7%.[34] Most of this amount (≈60%) is consumed for fertilizers, particularly superphosphates, ammonium phosphate and ammonium sulfates. About 20% is used in chemical industry for production of detergents, synthetic resins, dyestuffs, pharmaceuticals, petroleum catalysts, insecticides and antifreeze, as well as in various processes such as oil well acidicizing, aluminium reduction, paper sizing, and water treatment. About 6% of uses are related to pigments and include paints, enamels, printing inks, coated fabrics and paper, while the rest is dispersed into a multitude of applications such as production of explosives, cellophane, acetate and viscose textiles, lubricants, non-ferrous metals, and batteries.[35]
Industrial production of chemicals[edit]
The dominant use for sulfuric acid is in the «wet method» for the production of phosphoric acid, used for manufacture of phosphate fertilizers. In this method, phosphate rock is used, and more than 100 million tonnes are processed annually. This raw material is shown below as fluorapatite, though the exact composition may vary. This is treated with 93% sulfuric acid to produce calcium sulfate, hydrogen fluoride (HF) and phosphoric acid. The HF is removed as hydrofluoric acid. The overall process can be represented as:
Ammonium sulfate, an important nitrogen fertilizer, is most commonly produced as a byproduct from coking plants supplying the iron and steel making plants. Reacting the ammonia produced in the thermal decomposition of coal with waste sulfuric acid allows the ammonia to be crystallized out as a salt (often brown because of iron contamination) and sold into the agro-chemicals industry.
Sulfuric acid is also important in the manufacture of dyestuffs solutions.
Industrial cleaning agent[edit]
Sulfuric acid is used in large quantities by the iron and steelmaking industry to remove oxidation, rust, and scaling from rolled sheet and billets prior to sale to the automobile and major appliances industry.[citation needed] Used acid is often recycled using a spent acid regeneration (SAR) plant. These plants combust spent acid[clarification needed] with natural gas, refinery gas, fuel oil or other fuel sources. This combustion process produces gaseous sulfur dioxide (SO2) and sulfur trioxide (SO3) which are then used to manufacture «new» sulfuric acid. SAR plants are common additions to metal smelting plants, oil refineries, and other industries where sulfuric acid is consumed in bulk, as operating a SAR plant is much cheaper than the recurring costs of spent acid disposal and new acid purchases.
Hydrogen peroxide (H2O2) can be added to sulfuric acid to produce piranha solution, a powerful but very toxic cleaning solution with which substrate surfaces can be cleaned. Piranha solution is typically used in the microelectronics industry, and also in laboratory settings to clean glassware.
Catalyst[edit]
Sulfuric acid is used for a variety of other purposes in the chemical industry. For example, it is the usual acid catalyst for the conversion of cyclohexanone oxime to caprolactam, used for making nylon. It is used for making hydrochloric acid from salt via the Mannheim process. Much H2SO4 is used in petroleum refining, for example as a catalyst for the reaction of isobutane with isobutylene to give isooctane, a compound that raises the octane rating of gasoline (petrol). Sulfuric acid is also often used as a dehydrating or oxidizing agent in industrial reactions, such as the dehydration of various sugars to form solid carbon.
Electrolyte[edit]
Sulfuric acid acts as the electrolyte in lead–acid batteries (lead-acid accumulator):
At anode:
- Pb + SO2−4 ⇌ PbSO4 + 2 e−
At cathode:
- PbO2 + 4 H+ + SO2−4 + 2 e− ⇌ PbSO4 + 2 H2O
Overall:
- Pb + PbO2 + 4 H+ + 2 SO2−4 ⇌ 2 PbSO4 + 2 H2O
Domestic uses[edit]
Sulfuric acid at high concentrations is frequently the major ingredient in domestic acidic drain cleaners[12] which are used to remove grease, hair, tissue paper, etc. Similar to their alkaline versions, such drain openers can dissolve fats and proteins via hydrolysis. Moreover, as concentrated sulfuric acid has a strong dehydrating property, it can remove tissue paper via dehydrating process as well. Since the acid may react with water vigorously, such acidic drain openers should be added slowly into the pipe to be cleaned.
History[edit]
Vitriols[edit]
Ancient history[edit]
The study of vitriols (hydrated sulfates of various metals forming glassy minerals from which sulfuric acid can be derived) began in ancient times. Sumerians had a list of types of vitriol that they classified according to the substances’ color. Some of the earliest discussions on the origin and properties of vitriol is in the works of the Greek physician Dioscorides (first century AD) and the Roman naturalist Pliny the Elder (23–79 AD). Galen also discussed its medical use. Metallurgical uses for vitriolic substances were recorded in the Hellenistic alchemical works of Zosimos of Panopolis, in the treatise Phisica et Mystica, and the Leyden papyrus X.[36]
Jabir ibn Hayyan, Abu Bakr al-Razi, Ibn Sina, et al.[edit]
Medieval Islamic chemists like the authors writing under the name of Jabir ibn Hayyan (died c. 806 – c. 816 AD, known in Latin as Geber), Abu Bakr al-Razi (865 – 925 AD, known in Latin as Rhazes), Ibn Sina (980 – 1037 AD, known in Latin as Avicenna), and Muhammad ibn Ibrahim al-Watwat (1234 – 1318 AD) included vitriol in their mineral classification lists.[37]
The Jabirian authors and al-Razi experimented extensively with the distillation of various substances, including vitriols.[38] In one recipe recorded in his Kitāb al-Asrār (‘Book of Secrets’), al-Razi may have created sulfuric acid without being aware of it:[39]
Take white (Yemeni) alum, dissolve it and purify it by filtration. Then distil (green?) vitriol with copper-green (the acetate), and mix (the distillate) with the filtered solution of the purified alum, afterwards let it solidify (or crystallise) in the glass beaker. You will get the best qalqadis (white alum) that may be had.[40]
— Abu Bakr al-Razi, Kitāb al-Asrār
In an anonymous Latin work variously attributed to Aristotle (under the title Liber Aristotilis, ‘Book of Aristotle’),[41] to al-Razi (under the title Lumen luminum magnum, ‘Great Light of Lights’), or to Ibn Sina,[42] the author speaks of an ‘oil’ (oleum) obtained through the distillation of iron(II) sulfate (green vitriol), which was likely ‘oil of vitriol’ or sulfuric acid.[43] The work refers multiple times to Jabir ibn Hayyan’s Book of Seventy (Liber de septuaginta), one of the few Arabic Jabir works that were translated into Latin.[44] The author of the version attributed to al-Razi also refers to the Liber de septuaginta as his own work, showing that he erroneously believed the Liber de septuaginta to be a work by al-Razi.[45] There are several indications that the anonymous work was an original composition in Latin,[46] although according to one manuscript it was translated by a certain Raymond of Marseilles, meaning that it may also have been a translation from the Arabic.[47]
According to Ahmad Y. al-Hassan, three recipes for sulfuric acid occur in an anonymous Karshuni manuscript containing a compilation taken from several authors and dating from before c. 1100 AD.[48] One of them runs as follows:
The water of vitriol and sulphur which is used to irrigate the drugs: yellow vitriol three parts, yellow sulphur one part, grind them and distil them in the manner of rose-water.[49]
A recipe for the preparation of sulfuric acid is mentioned in Risālat Jaʿfar al-Sādiq fī ʿilm al-ṣanʿa, an Arabic treatise falsely attributed to the Shi’i Imam Ja’far al-Sadiq (died 765). Julius Ruska dated this treatise to the 13th century, but according to Ahmad Y. al-Hassan it likely dates from an earlier period:[50]
Then distil green vitriol in a cucurbit and alembic, using medium fire; take what you obtain from the distillate, and you will find it clear with a greenish tint.[51]
Vincent of Beauvais, Albertus Magnus, and pseudo-Geber[edit]
Sulfuric acid was called ‘oil of vitriol’ by medieval European alchemists because it was prepared by roasting iron(II) sulfate or green vitriol in an iron retort. The first allusions to it in works that are definitely European in origin appear in the thirteenth century AD, as for example in the works of Vincent of Beauvais, in the Compositum de Compositis ascribed to Albertus Magnus, and in pseudo-Geber’s Summa perfectionis.[52]
Producing sulfuric acid from sulfur[edit]
In the seventeenth century, the German-Dutch chemist Johann Glauber prepared sulfuric acid by burning sulfur together with saltpeter (potassium nitrate, KNO3), in the presence of steam. As saltpeter decomposes, it oxidizes the sulfur to SO3, which combines with water to produce sulfuric acid. In 1736, Joshua Ward, a London pharmacist, used this method to begin the first large-scale production of sulfuric acid.
Lead chamber process[edit]
In 1746 in Birmingham, John Roebuck adapted this method to produce sulfuric acid in lead-lined chambers, which were stronger, less expensive, and could be made larger than the previously used glass containers. This process allowed the effective industrialization of sulfuric acid production. After several refinements, this method, called the lead chamber process or «chamber process», remained the standard for sulfuric acid production for almost two centuries.[4]
Distillation of pyrite[edit]
Sulfuric acid created by John Roebuck’s process approached a 65% concentration. Later refinements to the lead chamber process by French chemist Joseph Louis Gay-Lussac and British chemist John Glover improved concentration to 78%. However, the manufacture of some dyes and other chemical processes require a more concentrated product. Throughout the 18th century, this could only be made by dry distilling minerals in a technique similar to the original alchemical processes. Pyrite (iron disulfide, FeS2) was heated in air to yield iron(II) sulfate, FeSO4, which was oxidized by further heating in air to form iron(III) sulfate, Fe2(SO4)3, which, when heated to 480 °C, decomposed to iron(III) oxide and sulfur trioxide, which could be passed through water to yield sulfuric acid in any concentration. However, the expense of this process prevented the large-scale use of concentrated sulfuric acid.[4]
Contact process[edit]
In 1831, British vinegar merchant Peregrine Phillips patented the contact process, which was a far more economical process for producing sulfur trioxide and concentrated sulfuric acid. Today, nearly all of the world’s sulfuric acid is produced using this method.[53]
Safety[edit]
Laboratory hazards[edit]
Sulfuric acid is capable of causing very severe burns, especially when it is at high concentrations. In common with other corrosive acids and alkali, it readily decomposes proteins and lipids through amide and ester hydrolysis upon contact with living tissues, such as skin and flesh. In addition, it exhibits a strong dehydrating property on carbohydrates, liberating extra heat and causing secondary thermal burns.[7][8] Accordingly, it rapidly attacks the cornea and can induce permanent blindness if splashed onto eyes. If ingested, it damages internal organs irreversibly and may even be fatal.[6] Protective equipment should hence always be used when handling it. Moreover, its strong oxidizing property makes it highly corrosive to many metals and may extend its destruction on other materials.[7] Because of such reasons, damage posed by sulfuric acid is potentially more severe than that by other comparable strong acids, such as hydrochloric acid and nitric acid.

Sulfuric acid must be stored carefully in containers made of nonreactive material (such as glass). Solutions equal to or stronger than 1.5 M are labeled «CORROSIVE», while solutions greater than 0.5 M but less than 1.5 M are labeled «IRRITANT». However, even the normal laboratory «dilute» grade (approximately 1 M, 10%) will char paper if left in contact for a sufficient time.
The standard first aid treatment for acid spills on the skin is, as for other corrosive agents, irrigation with large quantities of water. Washing is continued for at least ten to fifteen minutes to cool the tissue surrounding the acid burn and to prevent secondary damage. Contaminated clothing is removed immediately and the underlying skin washed thoroughly.
Dilution hazards[edit]
Preparation of the diluted acid can be dangerous due to the heat released in the dilution process. To avoid splattering, the concentrated acid is usually added to water and not the other way around. A saying used to remember this is «Do like you oughta, add the acid to the water».[54][better source needed] Water has a higher heat capacity than the acid, and so a vessel of cold water will absorb heat as acid is added.
| Physical property | H2SO4 | Water | Units |
|---|---|---|---|
| Density | 1.84 | 1.0 | kg/L |
| Volumetric heat capacity | 2.54 | 4.18 | kJ/L |
| Boiling point | 337 | 100 | °C |
Also, because the acid is denser than water, it sinks to the bottom. Heat is generated at the interface between acid and water, which is at the bottom of the vessel. Acid will not boil, because of its higher boiling point. Warm water near the interface rises due to convection, which cools the interface, and prevents boiling of either acid or water.
In contrast, addition of water to concentrated sulfuric acid results in a thin layer of water on top of the acid. Heat generated in this thin layer of water can boil, leading to the dispersal of a sulfuric acid aerosol or worse, an explosion.
Preparation of solutions greater than 6 M (35%) in concentration is dangerous, unless the acid is added slowly enough to allow the mixture sufficient time to cool. Otherwise, the heat produced may be sufficient to boil the mixture. Efficient mechanical stirring and external cooling (such as an ice bath) are essential.
Reaction rates double for about every 10-degree Celsius increase in temperature.[55] Therefore, the reaction will become more violent as dilution proceeds, unless the mixture is given time to cool. Adding acid to warm water will cause a violent reaction.
On a laboratory scale, sulfuric acid can be diluted by pouring concentrated acid onto crushed ice made from de-ionized water. The ice melts in an endothermic process while dissolving the acid. The amount of heat needed to melt the ice in this process is greater than the amount of heat evolved by dissolving the acid so the solution remains cold. After all the ice has melted, further dilution can take place using water.
Industrial hazards[edit]
Sulfuric acid is non-flammable.
The main occupational risks posed by this acid are skin contact leading to burns (see above) and the inhalation of aerosols. Exposure to aerosols at high concentrations leads to immediate and severe irritation of the eyes, respiratory tract and mucous membranes: this ceases rapidly after exposure, although there is a risk of subsequent pulmonary edema if tissue damage has been more severe. At lower concentrations, the most commonly reported symptom of chronic exposure to sulfuric acid aerosols is erosion of the teeth, found in virtually all studies: indications of possible chronic damage to the respiratory tract are inconclusive as of 1997. Repeated occupational exposure to sulfuric acid mists may increase the chance of lung cancer by up to 64 percent.[56] In the United States, the permissible exposure limit (PEL) for sulfuric acid is fixed at 1 mg/m3: limits in other countries are similar. There have been reports of sulfuric acid ingestion leading to vitamin B12 deficiency with subacute combined degeneration. The spinal cord is most often affected in such cases, but the optic nerves may show demyelination, loss of axons and gliosis.
Legal restrictions[edit]
International commerce of sulfuric acid is controlled under the United Nations Convention Against Illicit Traffic in Narcotic Drugs and Psychotropic Substances, 1988, which lists sulfuric acid under Table II of the convention as a chemical frequently used in the illicit manufacture of narcotic drugs or psychotropic substances.[57]
See also[edit]
- Aqua regia
- Diethyl ether – also known as «sweet oil of vitriol»
- Piranha solution
- Sulfur oxoacid
- Sulfuric acid poisoning
References[edit]
- ^ a b c Haynes, William M. (2014). CRC Handbook of Chemistry and Physics (95 ed.). CRC Press. pp. 4–92. ISBN 9781482208689. Retrieved 18 November 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0577». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Kemnitz, E.; Werner, C.; Trojanov, S. (15 November 1996). «Reinvestigation of Crystalline Sulfuric Acid and Oxonium Hydrogensulfate». Acta Crystallographica Section C Crystal Structure Communications. 52 (11): 2665–2668. doi:10.1107/S0108270196006749.
- ^ a b c d Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ a b c «Sulfuric acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c «Sulfuric acid safety data sheet» (PDF). arkema-inc.com. Archived from the original (PDF) on 17 June 2012.
Clear to turbid oily odorless liquid, colorless to slightly yellow.
- ^ a b c d «Sulfuric acid – uses». dynamicscience.com.au. Archived from the original on 9 May 2013.
- ^ a b «BASF Chemical Emergency Medical Guidelines – Sulfuric acid (H2SO4)» (PDF). BASF Chemical Company. 2012. Archived from the original (PDF) on 14 June 2019. Retrieved 18 December 2014.
- ^ a b Chenier, Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. pp. 45–57. ISBN 978-0-471-01077-7.
- ^ Hermann Müller «Sulfuric Acid and Sulfur Trioxide» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. 2000 doi:10.1002/14356007.a25_635
- ^ «Sulfuric acid».
- ^ a b «Sulphuric acid drain cleaner» (PDF). herchem.com. Archived from the original (PDF) on 29 October 2013.
- ^ a b «Sulfuric Acid». The Columbia Encyclopedia (6th ed.). 2009. Retrieved 16 March 2010.
- ^ a b c «Sulphuric acid». Encyclopædia Britannica. Vol. 26 (11th ed.). 1910–1911. pp. 65–69. Please note, no EB1911 wikilink is available to this article
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ «Sulfuric acid» (PDF). Determination of Noncancer Chronic Reference Exposure Levels Batch 2B December 2001. 2001. Archived from the original (PDF) on 22 May 2003. Retrieved 1 October 2012.
- ^ «Sulfuric Acid 98%» (PDF). rhodia.com. 2009. Archived from the original (PDF) on 7 January 2011. Retrieved 2 July 2014.
- ^ Giauque, W. F.; Hornung, E. W.; Kunzler, J. E.; Rubin, T. R. (January 1960). «The Thermodynamic Properties of Aqueous Sulfuric Acid Solutions and Hydrates from 15 to 300K. 1». Journal of the American Chemical Society. 82 (1): 62–70. doi:10.1021/ja01486a014.
- ^ «Consortium of Local Education Authorities for the Provision of Science Equipment -STUDENT SAFETY SHEETS 22 Sulfuric(VI) acid» (PDF). Archived from the original (PDF) on 31 March 2013.
- ^ «Ionization Constants of Inorganic Acids». .chemistry.msu.edu. Retrieved 30 May 2011.
- ^ Dolson, David A.; et al. (1995). «Carbohydrate Dehydration Demonstrations». J. Chem. Educ. 72 (10): 927. Bibcode:1995JChEd..72..927D. doi:10.1021/ed072p927. ISSN 0021-9584.
- ^ Helmenstine, Anne (18 February 2020). «Carbon Snake Demo (Sugar and Sulfuric Acid)». Science Notes and Projects. Retrieved 5 July 2022.
- ^ Housecroft, Catherine E.; Sharpe, Alan G. (2008). «Chapter 16: The group 16 elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 523. ISBN 978-0-13-175553-6.
- ^ Kinney, Corliss Robert; Grey, V. E. (1959). Reactions of a Bituminous Coal with Sulfuric Acid (PDF). Pennsylvania State University. Archived from the original (PDF) on 28 April 2017.
- ^ Carey, F. A. «Reactions of Arenes. Electrophilic Aromatic Substitution». On-Line Learning Center for Organic Chemistry. University of Calgary. Archived from the original on 6 July 2008. Retrieved 27 January 2008.
{{cite web}}: CS1 maint: unfit URL (link) - ^ Ngo, Christian; Natowitz, Joseph (2016). Our Energy Future: Resources, Alternatives and the Environment. John Wiley & Sons. pp. 418–419. ISBN 9781119213369.
- ^ Pickard, Paul (25 May 2005). «2005 DOE Hydrogen Program Review: Sulfur-Iodine Thermochemical Cycle» (PDF). Sandia National Labs. Retrieved 8 October 2021.
- ^ Pelletreau, K.; Muller-Parker, G. (2002). «Sulfuric acid in the phaeophyte alga Desmarestia munda deters feeding by the sea urchin Strongylocentrotus droebachiensis». Marine Biology. 141 (1): 1–9. doi:10.1007/s00227-002-0809-6. S2CID 83697676.
- ^ a b Kremser, S.; Thomson, L.W. (2016). «Stratospheric aerosol—Observations, processes, and impact on climate» (PDF). Reviews of Geophysics. 54 (2): 278–335. Bibcode:2016RvGeo..54..278K. doi:10.1002/2015RG000511.
- ^ Krasnopolsky, Vladimir A. (2006). «Chemical composition of Venus atmosphere and clouds: Some unsolved problems». Planetary and Space Science. 54 (13–14): 1352–1359. Bibcode:2006P&SS…54.1352K. doi:10.1016/j.pss.2006.04.019.
- ^ Orlando, T. M.; McCord, T. B.; Grieves, G. A. (2005). «The chemical nature of Europa surface material and the relation to a subsurface ocean». Icarus. 177 (2): 528–533. Bibcode:2005Icar..177..528O. doi:10.1016/j.icarus.2005.05.009.
- ^ Jones, Edward M. (1950). «Chamber Process Manufacture of Sulfuric Acid». Industrial and Engineering Chemistry. 42 (11): 2208–2210. doi:10.1021/ie50491a016.
- ^ (Harm), Benninga, H. (1990). A history of lactic acid making: a chapter in the history of biotechnology. Dordrecht [Netherland]: Kluwer Academic Publishers. p. 4. ISBN 9780792306252. OCLC 20852966.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Davenport, William George & King, Matthew J. (2006). Sulfuric acid manufacture: analysis, control and optimization. Elsevier. pp. 8, 13. ISBN 978-0-08-044428-4. Retrieved 23 December 2011.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 653. ISBN 978-0-08-037941-8.
- ^ Karpenko, Vladimír; Norris, John A. (2002). «Vitriol in the History of Chemistry». Chemické listy. 96 (12): 997–1005.
- ^ Karpenko & Norris 2002, pp. 999–1000.
- ^ Multhauf, Robert P. (1966). The Origins of Chemistry. London: Oldbourne. pp. 140-142.
- ^ Needham, Joseph; Ping-Yü, Ho; Gwei-Djen, Lu; Sivin, Nathan (1980). Science and Civilisation in China. Volume 5, Chemistry and Chemical Technology. Part IV, Spagyrical Discovery and Invention: Apparatus, Theories and Gifts. Cambridge: Cambridge University Press. ISBN 978-0-521-08573-1. p. 195, note d. Stapleton, Henry E.; Azo, R.F.; Hidayat Husain, M. (1927). «Chemistry in Iraq and Persia in the Tenth Century A.D.» Memoirs of the Asiatic Society of Bengal. VIII (6): 317–418. OCLC 706947607. pp. 333 (on the Liber Bubacaris, cf. p. 369, note 3), 393. Quote from p. 393: «It is extremely curious to see how close ar-Rāzī came to the discovery of Sulphuric acid, without actually recognising the powerful solvent properties of the distillate of vitriols and alum. This is all the more surprising, as he fully realised the reactive powers of both Arsenic sulphide and Sal-ammoniac, the ‘Spirits’ with which he must have associated the distillate from alum».
- ^ Needham et al. 1980, p. 195, note d.
- ^ Pattin, Adriaan (1972). «Un recueil alchimique: le manuscrit Firenze, Bibl. Riccardiana, L. III. 13. 119 — Description et documentation». Bulletin de Philosophie Médiévale. 14: 89–107. doi:10.1484/J.BPM.3.143. pp. 93–94.
- ^ Moureau, Sébastien (2020). «Min al-kīmiyāʾ ad alchimiam. The Transmission of Alchemy from the Arab-Muslim World to the Latin West in the Middle Ages». Micrologus. 28: 87–141. hdl:2078.1/211340. p. 114 (no. 20). Moureau mentions that the work also sometimes occurs anonymously. He gives its incipit as «cum de sublimiori atque precipuo rerum effectum …«. Some parts of it have been published by Ruska, Julius (1939). «Pseudepigraphe Rasis-Schriften». Osiris. 7: 31–94. doi:10.1086/368502. S2CID 143373785. pp. 56–65.
- ^ Hoefer, Ferdinand (1866). Histoire de la chimie (2nd ed.). Paris: Librairie de Firmin Didot. p. 341.
- ^ Ruska 1939, p. 58; Pattin 1972, p. 93; Halleux, Robert (1996). «The Reception of Arabic Alchemy in the West». In Rashed, Roshdi (ed.). Encyclopedia of the History of Arabic Science. Vol. 3. London: Routledge. pp. 886–902. ISBN 9780415020633. p. 892. On the Latin Liber de septuaginta and the two other known Latin translations of Arabic Jabir works, see Moureau 2020, pp. 111–112.
- ^ Ruska 1939, p. 58.
- ^ Ruska 1939, pp. 58–61.
- ^ Halleux 1996, p. 892; Moureau 2020, p. 114. Moureau mentions that ‘Raymond of Marseilles’ may be the astronomer by that name (fl. 1141). Hoefer 1866, p. 343 still firmly believed that the work belonged to al-Razi, but this view has been abandoned ever since the studies done by Ruska 1939; cf. Moureau 2020, p. 117, quote «although many alchemical Latin texts are attributed to Rāzı̄, only one is, in the current state of research, known to be a translation of the famous physician and alchemist» (i.e., the Liber secretorum Bubacaris, a paraphrase of al-Razi’s Kitāb al-asrār); Ferrario, Gabriele (2009). «An Arabic Dictionary of Technical Alchemical Terms: MS Sprenger 1908 of the Staatsbibliothek zu Berlin (fols. 3r–6r)». Ambix. 56 (1): 36–48. doi:10.1179/174582309X405219. PMID 19831258. S2CID 41045827. p. 42, quote «A strong and yet to be refuted critique of this traditional attribution was proposed by Ruska […]».
- ^ Al-Hassan 2001, pp. 60, 63. On the dating of this manuscript, see also Berthelot, Marcellin; Houdas, Octave V. (1893). La Chimie au Moyen Âge. Paris: Imprimerie nationale. vol. II, p. xvii.
- ^ Al-Hassan 2001, p. 60.
- ^ Williams, Alan (2012). The Sword and the Crucible: A History of the Metallurgy of European Swords Up to the 16th Century. Leiden: Brill. ISBN 978-90-04-22783-5. p. 104. Al-Hassan, Ahmad Y. (2001). Science and Technology in Islam: Technology and applied sciences. UNESCO. ISBN 978-92-3-103831-0. p. 60.
- ^ Al-Hassan 2001, p. 60.
- ^ Karpenko & Norris 2002, pp. 1002–1004.
- ^ Philip J. Chenier (1 April 2002). Survey of industrial chemistry. Springer. pp. 28–. ISBN 978-0-306-47246-6. Retrieved 23 December 2011.
- ^ Snyder, Lucy A. (4 November 2005). «Do like you oughta, add acid to water». Lucy A. Snyder. Retrieved 23 January 2022.
- ^ Pauling, L.C. (1988) General Chemistry, Dover Publications
- ^ Beaumont, JJ; Leveton, J; Knox, K; Bloom, T; McQuiston, T; Young, M; Goldsmith, R; Steenland, NK; Brown, DP; Halperin, WE (1987). «Lung cancer mortality in workers exposed to sulfuric acid mist and other acid mists». J Natl Cancer Inst. 79 (5): 911–21. doi:10.1093/jnci/79.5.911. PMID 3479642.
- ^ «Annex to Form D («Red List»), 11th Edition» (PDF). Vienna, Austria: International Narcotics Control Board. January 2007. p. 4. Archived (PDF) from the original on 27 February 2008.
External links[edit]
- International Chemical Safety Card 0362
- Sulfuric acid at The Periodic Table of Videos (University of Nottingham)
- NIOSH Pocket Guide to Chemical Hazards
- CDC – Sulfuric Acid – NIOSH Workplace Safety and Health Topic
- External Material Safety Data Sheet Archived 11 October 2007 at the Wayback Machine
- Calculators: surface tensions, and densities, molarities and molalities of aqueous sulfuric acid
- Sulfuric acid analysis – titration freeware
- Process flowsheet of sulfuric acid manufacturing by lead chamber process
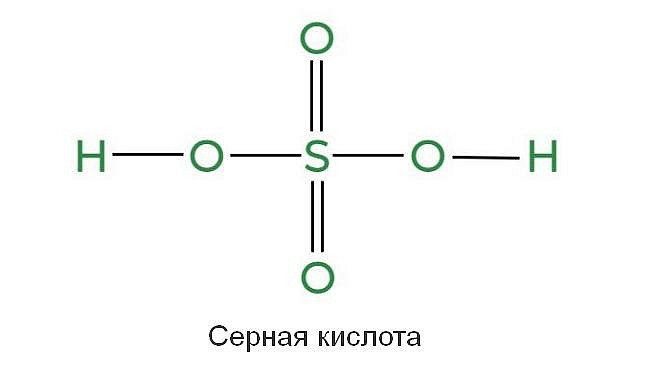
Серная кислота (VI) (H₂SO₄) — неорганическое химическое соединение, относящееся к группе кислородных кислот, построенное из центрально расположенного атома серы (S), соединенного одинарными ковалентными связями с двумя гидроксильными группами (ОН) и двойными ковалентными связями.
Серная кислота (VI) (H₂SO₄) — неорганическое химическое соединение, относящееся к группе кислородных кислот, построенное из центрально расположенного атома серы (S), соединенного одинарными ковалентными связями с двумя гидроксильными группами (ОН) и двойными ковалентными связями. с двумя атомами кислорода (О). Проще говоря, серная кислота имеет два атома водорода, один атом серы и четыре атома кислорода.
Это интересно. До 19 века серная кислота также имела тривиальное название купоросное масло (производное от купороса), которое сегодня больше не используется.
Содержание:
- Свойства серной кислоты
- Концентрированная и разбавленная серная кислота
- Производство серный кислоты
- Серная кислота в природе
- Серная кислота опасность и меры предосторожности
Свойства серной кислоты
|
Молярная масса |
98,079 г/моль |
|
Плотность (при стандартных условиях) |
1,84 г/ см3 |
|
Растворимость |
хорошо растворяется в воде |
|
Значение рКа |
-3 |
|
Значение pH |
2,75 |
|
Точка кипения |
+337 °С |
|
Температура плавления |
+10,31 °С |
|
Особенности |
|
Концентрированная и разбавленная серная кислота
Очень высокая концентрация называется концентрированной серной кислотой, т.е. не менее 98,3% или количество вещества 17,966 моль/л. Обычно он имеет плотность 1,836 г/см 3.
Разбавленная серная кислота с концентрацией около 10% или количеством вещества 1,087 моль/л имеет меньшую плотность, чем концентрированная кислота, а именно всего около 1,066 г/см 3.
Серная кислота представляет собой бесцветную маслянистую жидкость без запаха с плотностью 1,84 г/см³ (20°С). Обладает сильными гигроскопическими свойствами; проявляет способность поглощать водяные пары, содержащиеся в атмосферном воздухе. При нагревании выше 300°C серная кислота начинает постепенно разлагаться на воду (H₂O) и удушающие пары триоксида серы (SO₃). Хорошо растворяется в воде и других полярных растворителях; разбавление водой протекает с выделением большого количества теплоты (экзотермический процесс). Серная кислота — одна из сильнейших неорганических кислот, проявляющая высокую химическую активность. В водных растворах почти полностью диссоциирует с образованием ионов гидроксония (H₃O⁺) и кислых гидросульфатов (HSO₄⁻) и нейтральных сульфатов (SO₄²⁻). Разбавленная серная кислота растворяет большинство металлов (кроме драгоценных металлов). Концентрированная серная кислота при повышенной температуре окисляет большинство металлов (включая благородные металлы) и неметаллы (например, углерод, серу); является сильным дегидратирующим агентом, обугливающим органические вещества (например, углеводы). Серная кислота, получаемая в промышленных масштабах контактным способом, применяется в химической, фармацевтической, текстильной, бумажной, кожевенной и металлургической промышленности; разбавленная серная кислота (аккумуляторная кислота) действует как электролит в свинцовых батареях.
Производство серный кислоты
Сегодня серную кислоту в основном производят так называемым контактным способом. Метод работает в три этапа. Однако, прежде чем это может произойти, элементарная сера должна еще прореагировать с кислородом с образованием диоксида серы (SO 2):
S + O2 → SO2
Шаг 1: Триоксид серы (SO 3) образуется из диоксида серы и кислорода:
2 SO2 + O2 → 2 SO3
Шаг 2: Триоксид серы плохо растворим в воде. Однако для получения серной кислоты необходим оксид. Поэтому SO 3 необходимо предварительно растворить в концентрированной серной кислоте. Это создает дисерную кислоту (H₂S₂O₇):
SO 3 + H 2 SO 4 → H 2 S 2 O 7
Шаг 3: Если вы позволите серной кислоте вступить в реакцию с водой, вы, наконец, получите серную кислоту:
H2S2O7 + H2O → 2H2SO4 _ _ _ _ _ _ _
В интернет-магазине Химбаза вы можете купить серную кислоту по цене от 450 руб. за литр.
Серная кислота в природе
Свободная серная кислота, не диссоциированная на оксониевые соединения и сульфат-ионы, в природе встречается очень редко. В атмосфере образуется из диоксида серы, который образуется при сжигании серосодержащих веществ или при извержении вулканов. Диоксид серы окисляется до триоксида серы гидроксильными радикалами и кислородом. Наконец, с водой образуется свободная серная кислота. Другими окислителями, которые способствуют образованию триоксида серы, являются озон или перекись водорода. Под кислотным дождем затем он достигает земли в виде разбавленной кислоты (в основном в виде гидросульфата и сульфата).
Небольшое количество свободной серной кислоты также содержится в некоторых вулканических источниках, называемых сольфатарами.
В отличие от свободной кислоты ее соли, особенно сульфаты, встречаются в природе гораздо чаще. Существует множество различных сульфатных минералов. Наиболее известны и наиболее важны гипс (CaSO4.2H2O), барит (BaSO₄), халькантит (CuSO4∙5H2O) или глауберова соль (Na2SO4 · 10H2O).
Серная кислота, образующаяся в воздухе из двуокиси серы, является компонентом кислотных дождей наряду с азотной кислотой, образующейся из окислов азота. Кислотные дожди могут привести к снижению значения pH.
За пределами Земли серная кислота содержится в верхних слоях атмосферы Венеры. Это создается фотохимическими реакциями между диоксидом серы и водой. Образуются капли, содержащие 80-85% серной кислоты. В более глубоких слоях из-за высоких температур кислота разлагается на сернистый газ, кислород и воду, которые могут снова подняться и образовать серную кислоту.
Серная кислота опасность и меры предосторожности
Серная кислота очень едкая, окисляющая и обезвоживающая, поэтому при попадании на ткани может сильно повредить их. Даже незначительное количество серной кислоты при контакте с кожей может вызвать сильные химические ожоги. Контакт с глазами может привести к необратимым повреждениям зрения и слепоте.
Следует также соблюдать осторожность при вдыхании газа, выделяющегося при реакциях серной кислоты с другими веществами, так как он вызывает одышку и жжение в дыхательной системе.
Серная кислота сама по себе не представляет опасности возгорания или взрыва, но следует учитывать, что она может быть горючей в сочетании с другими материалами, даже с водой. Одной из мер предосторожности при обращении с серной кислотой заключается в том, что ее всегда нужно добавлять в воду, а не наоборот. Поскольку при разбавлении серной кислоты выделяется много тепла, добавление воды к серной кислоте может вызвать экзотермическую реакцию, вызывающую возгорание или брызги кислоты.
По этой причине при контакте кожи с серной кислотой ее нельзя сразу же промывать водой, как это происходит с большинством кислот. Вместо этого первым делом нужно нейтрализовать серную кислоту мыльной или известковой водой. После этого любые следы едкого вещества будут удалены путем обильного стекания воды по коже. Кроме того, необходимо снять одежду, украшения или любой другой предмет, который контактировал с кислотой. Важно делать это до тех пор, пока химический агент присутствует, он будет продолжать повреждать ткани.
Серная кислота – двухосновная субстанция, являющаяся одной из самых опасных, высоко токсичных и самых едких химических реагентов. Особенно касается это концентрированных жидкостей. Но даже при таких характеристиках данная кислота в ряде случаев является высоко востребованным и незаменимым химическим веществом, без которого не было бы многих удобрений, лекарственных препаратов, средств очищение нефтепродуктов, различной химической и другой продукции.
Товары
Серная кислота
В наличии
ЗАКАЗАТЬ
Аккумуляторная серная кислота
В наличии
ЗАКАЗАТЬ
Техническая серная кислота
В наличии
ЗАКАЗАТЬ
Свойства и характеристики серной кислоты
Чистая серная кислота являет собой вязкую едкую маслянистую жидкость без цвета и запаха с выраженным медным вкусом, которая при температуре 10,4° С превращается в кристаллическую твердую субстанцию. Концентрированный раствор (выше 40%) легко реагирует с водой, в результате чего образуются гидраты и выделяется большое количество тепла.
Благодаря высокой гигроскопичности реагент хорошо поглощает из воздуха водные пары. За счет этой способности может использоваться для осушения газов, которые не реагируют с кислотой.
В концентрированном виде раствор является мощным окислителем. Разбавленный реагент не обладает окислительными свойствами, взаимодействует с расположенными слева от водорода в электрохимическом ряду металлами.
Сферы применения
В жизнедеятельности человека серная кислота применяется в многих производственных направлениях – в производстве пластмасс, изготовлении красок, моющих средств и других материалов. Но основное применение серной кислоты приходится на производство разнообразных минеральных удобрений.
С недавних пор серную кислоту активно начали использовать при сборе картофеля. Реагент высушивает и останавливает рост побегов, расщепляя при этом значительную часть почвы и упрощая процесс сбора урожая машинным способом.
Около 200 млн. тонн ежегодно составляет потребление человечеством серной кислоты для самых различных нужд. Рассмотрим более подробно в каких направлениях и для чего используют едкий и в многих случаях смертельно опасный реагент.
Серная кислота в промышленности
Серная кислота активно применяется в различных областях промышленности. За счет постоянного спроса этот химический реагент называют «едкой кровью» промышленности. С раствором работают инженеры и ученые, ученики и студенты. Без данной кислоты трудно представить функционирование современной экономики.
Если выделить только основные области применения серной кислоты на производственных объектах, то в этом направлении стоит отметить следующие:
- производство удобрений составляет наибольший расход H2SO4. Востребована кислота в изготовлении различных суперфосфатов, сульфата и фосфата аммония;
- в черной металлургии жидкость с помощью жидкости эффективно и легко очищают от окалины, ржавчины и оксидной пленки проволоки, разные заготовки и листовой металлопрокат перед их цинкованием. Также продукт эффективен в травлении металлов перед их покрытием никелем, хромом, медью и другими материалами;
- в цветной металлургии раствор задействуют при получении цветных металлов, а также как средство для восстановления алюминия;
- в пищевой промышленности H2SO4 выполняет роль эмульгатора и употребляется в виде пищевой добавки Е513, которая регулирует кислотность разнообразных напитков;
- в целлюлозно-бумажной отрасли раствор используют в изготовлении тканей и бумаги с цветным покрытием, в получении целлофана, ацетата, вискозы и капролактама. Нередко задействуют в качестве средства для проклейки бумаги;
- в добывающей промышленности с помощью кислоты из разных видов руд выделяют редкоземельные элементы.
Промышленный органический синтез невозможно представить без серной кислоты. Она активно задействуется в реакциях гидратации, дегидратации и алкилирования. Изготовление эмалей, красок, чернил и различных пигментов, получение разных неорганических соединений (борной, соляной, фосфорной и других кислот), синтез органических веществ (анилиновых красителей, сложных эфиров, моющих средств, синтетических смол, лекарственных средств) – в этих и многих других целях серная кислота активно задействуется.
Серная кислота в быту
H2SO4 входит в состав средств, используемых для очистки водопроводных труб. Жидкость отлично решает задачи устранения заторов в системах водоснабжения и очистки воды.
Также в бытовых условиях повышенным спросом среди автовладельцев пользуется аккумуляторная серная кислота. Она добавляется к электролиту для свинцовых автомобильных аккумуляторов.
Крайне важно при работе с кислотой соблюдать правила безопасности. При заправке аккумулятора нужно кислоту к воде добавлять постепенно, но ни в коем случае не наоборот. Поскольку при вступлении в реакцию с раствором вода сильно нагревается, что может спровоцировать ее разбрызгивание. Если жидкость попадет на лицо или в глаза, то это чревато ожогами.
Разлитая на металл кислота хорошо нейтрализуется с помощью мела или извести. При попадании реактива на одежду ее нужно снять. В случае попадания жидкости на кожу необходимо сразу же тщательно промыть пораженные места чистой проточной водой.
Хранить раствор следует в закрытой герметической емкости в месте, недоступном для детей.
Серная кислота в сельском хозяйстве
Сельскохозяйственная отрасль – еще одна область применения серной кислоты. Из нее изготавливают различные ядохимикаты, используемые для борьбы с сорными травами и вредителями культур.
Соли и разбавленные растворы серной кислоты применяют:
- для дезинфекции овощехранилищ, оранжерей, теплиц и парников;
- в качестве средства для предотвращения образования плесени и грибков;
- для борьбы с различными вредителями и противодействия разным видам клещей;
- как средство для борьбы с болезнями, в частности для предотвращения корневой гнили и противодействия появления мучнистой росы на плодовых деревьях, виноградниках и хлопчатниковых плантациях;
- для удобрения растений. Сера укрепляет корневую систему и ускоряет процесс усвоения растениями микроэлементов.
Для повышения кислотности почвы жидкая сера является самым простым и быстрым решением. Вносить ее можно непосредственно в грунт.
Серная кислота в медицине
Широкое применение серная кислота нашла также в медицине. В этом направлении высоким спросом пользуются ее соли.
Известным производным реагента является натрий тиосульфат, который задействуется в качестве противоядия при отравлении свинцом, ртутью, цианидом или галогенами. Также препарат эффективен в лечении разных дерматологических заболеваний.
В виде действенного спазмолитика больным гипертоническими болезнями вводят магний сульфат – производное серной кислоты. Этот же препарат назначают людям с проблемами желчеотделения.
Гинекологи используют магния сульфат для обезболивания родов методом внутримышечного введения. Также препарат известен как эффективное антисудорожное средство.
Биологическая опасность серной кислоты и особенности ее применения
Независимо для каких целей используется серная кислота применение ее требует строгого соблюдения правил безопасности. По уровню токсичности жидкость принадлежит ко 2 классу опасности. Испаряемые раствором пары поражают слизистые оболочки, кожу, дыхательные пути, вызывая рвоту, отравления, затруднение дыхания и тяжелые химические ожоги.
Поэтому работать с жидкостью необходимо предельно осторожно, обязательно используя средства личной защиты и спецодежду.
В процессе приготовления электролита категорически нельзя в серную кислоту вливать воду, поскольку это чревато поражениями кожи, глаз и других органов. Электролит перед заливкой в аккумулятор обязательно следует охладить как минимум до 25° С. Хранить состав нужно в плотно закрытой керамической, фаянсовой или эбонитовой посуде, но ни в коем случае не в металлической.
Для хранения серной кислоты в больших объемах на производственных предприятиях нужно применять специализированные емкости, оснащенные смотровыми окнами, датчиками контроля и надежной запорной арматурой.
Поэтому работать с кислотой необходимо в маске и очках. Если кислота используется внутри помещений, то в нем обязательно должна быть вытяжка, способная быстро выводить едкие пары.
Всегда нужно помнить о том, что любое неосторожное обращение с кислотой может повлечь за собой серьезные проблемы со здоровьем, в том числе опасность для жизни.
Читайте также

Сертификаты и паспорта поставляемой продукции
ЧИТАТЬ

Производство серной кислоты
ЧИТАТЬ
Многие считают, что серная кислота является очень опасной для человека. При непосредственном взаимодействии так оно и есть. Этот продукт активно используется в разных отраслях, так как обладает отличными эксплуатационными характеристиками. Компания «Химия и Технология» предоставляет приобрести серную кислоту на выгодных условиях.
Продукт отличается маслянистой структурой и прозрачностью, обладает достаточно резким запахом. В чистом виде является бесцветным, а дополнительный оттенок указывает на появление определённых соединений. Легко соединяется с водой, выделяя при этом теплоту в больших количествах.
Серная кислота считается мощным окислителем. Активно используется в разных промышленных отраслях. Применяется при изготовлении удобрений, солей и кислот, всевозможных красителей, в металлургической и нефтяной отрасли. Пищевая индустрия также используется серную кислоту.
Высококонцентрированное соединение вещества активно реагирует с водой. Поэтому нужно разбавлять химическую жидкость водой, а не наоборот.
Она хорошо поглощает пары жидкости из воздуха, поэтому используется для осушения газов. По причине низкой летучести, используется для вытеснения летучих кислот из солей. После чего образуются гидраты серной кислоты.
Как упоминалось выше, в высокой концентрации кислота является серьёзным окислителем. Она воздействует на разные металлы, а продукты реакции зависят от активности металла, образуя два ряда солей. В разбавленном виде вещество также взаимодействует с металлами, только без характерных окислительных свойств.
В промышленной индустрии этот химический элемент получают несколькими способами: контактным и нитрозным. Существует несколько видов – аккумуляторная (чистая), техническая и другие.
Применяется при изготовлении удобрений и в качестве аккумуляторного электролита. Используется в красителях и моющих средствах, пластиках и прочих реактивах, при обогащении руд и для очищения нефтепродуктов. В текстильной и фармацевтической отрасли также не обходятся без серной кислоты.
ХимЭксперт осуществляет оптовые продажи серной кислоты с возможностью доставки заказываемого химического реагента в различные регионы России. Купить серную кислоту по видам с заявленной концентрацией, упакованную в тару по ценам завода-изготовителя можно в компании Химэксперт, для этого позвоните нам или оставьте заявку на сайте через форму обращения. Виды серной кислоты Вам подскажут наши менеджеры и проведут консультацию по каждому продукту.
Условия транспортировки и хранения серной кислоты
Растворы серной кислоты перевозятся железнодорожным и автомобильным транспортом в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта. Хранят в специальных герметичных резервуарах (цистернах, бочках, канистрах) в крытых не отапливаемых складских помещениях или под навесом. В процессе хранения необходима полная изоляция от металлических порошков, солей хлорноватой и азотной кислот, карбидов, а также от различных горючих материалов, влаги, прямых солнечных лучей.
ВНИМАНИЕ: серная кислота пожаро- и взрывобезопасна, но при соприкосновении с водой происходит бурная реакция с большим выделением тепла, паров и газов.
При попадании на кожу, в глаза, а также при вдыхании паров вызывает сильные химические ожоги.
Применение серной кислоты кратко
Серная кислота применяется в самых различных сферах и промышленных отраслях:
- производство минеральных удобрений;
- в качестве электролита свинцовых аккумуляторов;
- источник для генерации минеральных кислот и солей;
- в нефтяной отрасли;
- в кожевенной и текстильной промышленностях;
- создание фильтров для получения дистиллированной воды;
- в пищевой промышленности, как основа эмульгатора E513;
- как важный элемент органического синтеза.
Химэксперт продает серную кислоту оптом в различных объемах со склада производителя. Качественная химия поставляется в канистрах, еврокубах и автоцистернах. Чтобы купить кислоту серную по доступной цене, воспользуйтесь звонком в офис компании. Продажа кислот по ее видам и по ГОСТу: кислоты серная, азотная, борная, лимонная, ортофосфорная, серная аккумуляторная, серная хч, соляная, сульфамининовая, уксусная ледяная, фтористоводородная, щавелевая. Приобрести серную кислоту по оптовым ценам можно у нас. Мы предлагаем соответствующую ГОСТ продукцию и ее поставки соответствующим транспортом, упакованной в тару. Серная кислота (H2SO4) – двухосновное маслянистое жидкое вещество с медным вкусом, без цвета и без запаха. Наша компания предлагает купить cерную кислоту различных концентраций Серная кислота – смертельный и токсичный реагент, без которого в то же время не существовало бы большое количество лечебных препаратов, удобрений, химической продукции и средств очищения нефтепродуктов. Он представляет собой вязкую субстанцию, у которой отсутствуют запах и цвет, однако вкус описывается как «медный».
Сфера применения серной кислоты
• Сельское хозяйство. Серную кислоту в очень больших объемах используют для производства минеральных удобрений, и на это уходит около 40% всей вырабатываемой кислоты. По этой причине производящие H2SO4 заводы строят рядом с предприятиями, выпускающими удобрения. Это сульфат аммония, суперфосфат и т.д. При их производстве серная кислота берется в чистом виде (100% концентрация).
• Оборонная промышленность. H2SО4 используется для производства взрывчатых веществ.
• Очистка нефтепродуктов. Для получения керосина, бензина минеральных масел требуется очистка углеводородов, которая происходит с применением серной кислоты. В процессе переработки нефти на очистку углеводородов данная индустрия «забирает» целых 30% мирового тоннажа H2SO4. Вдобавок, серной кислотой увеличивают октановое число топлива и при добыче нефти обрабатывают скважины.
• В металлургической промышленности. Серная кислота в металлургии используется для очистки от окалины и ржавчины проволоки, листового металла, а также для восстановления алюминия при производстве цветных металлов. Перед тем как покрывать металлические поверхности медью, хромом или никелем, поверхность протравливается серной кислотой.
• При производстве лекарственных препаратов.
• Пищевая промышленность. Производство сахара.
• При производстве красок.
• В химической промышленности. H2SO4 используется при производстве моющих средств, этилового средства, инсектицидов и т.д., и без нее эти процессы невозможны.
• Для получения других известных кислот, органических и неорганических соединений, используемых в промышленных целях.
Основные физические и химические свойства серной кислоты
Серная кислота в чистом виде (формула H2SO4), при концентрации 100% представляет собой бесцветную густую жидкость. Самое важное свойство H2SO4 заключается в высокой гигроскопичности – это способность отнимать из воздуха воду. Данный процесс сопровождается масштабным выделением тепла. H2SO4 – это сильная кислота. Серная кислота называется моногидратом – в ней на 1 моль SO3 приходится 1 моль Н2О (воды). Из-за ее внушительных гигроскопических свойств ее используют для извлечения влаги из газов. Температура кипения – 330 °С. При этом происходит разложение кислоты на SO3 и воду. Плотность – 1,84. Температура плавления – 10,3 °С/. Концентрированная серная кислота представляет собой мощный окислитель. Чтобы запустить окислительно-восстановительную реакцию кислоту требуется нагреть. Итог реакции – SO2. S+2H2SO4=3SO2+2H2O В зависимости от концентрации серная кислота по-разному вступает в реакцию с металлами. В разбавленном состоянии серная кислота способна окислять все металлы, которые стоят в ряду напряжений до водорода. Исключение составляют платина и золото как самые стойкие к окислению. Разбавленная серная кислота взаимодействует с солями, основаниями, амфотерными и основными оксидами. Серная кислота концентрированная способна окислять все металлы, стоящие в ряду напряжений, причем серебро тоже. Серная кислота образует два вида солей: кислые (это гидросульфаты) и средние (сульфаты) H2SO4 вступает в активную реакцию с органическими веществами и неметаллами, причем некоторые из них она способна превратить в уголь. Серный ангидрит отлично растворяется в H2SО4, и при этом образуется олеум – раствор SО3 в серной кислоте. Внешне это выглядит так: дымящаяся серная кислота, выделяющая серный ангидрит. Серная кислота в водных растворах является сильной двухосновной, и при добавлении ее к воде выделяется огромное количество теплоты. Когда готовят разбавленные растворы H2SО4 из концентрированных, необходимо небольшой струйкой добавлять более тяжелую кислоту к воде, а не наоборот. Это делается во избежание вскипания воды и разбрызгивания кислоты.
Виды серной кислоты
Серная кислота (H2SO4) — один из важнейших и наиболее потребляемых продуктов химической промышленности. Она относится к числу относительно дешевых кислот. Химической промышленностью нашей страны выпускаются различные виды и сорта серной кислоты, отличающиеся между собой концентрацией и содержанием посторонних примесей. Концентрированная, или безводная, серная кислота (моногидрат) Н2S04 представляет собой тяжелую маслянистую жидкость без цвета и запаха. Плотность моногидрата 1,85 г/см3, температура кипения 296 °С, температура кристаллизации 10°С. Однако эти свойства серной кислоты меняются с изменением ее концентрации. Наличие посторонних примесей меняет цвет кислоты до желтоватого или темноватого. Согласно ГОСТу серная кислота выпускается определенной концентрации, обеспечивающей низкую температуру замерзания, удобство хранения и транспортирования. Характерная особенность серной кислоты — хорошая смешиваемость с водой, причем процесс разбавления сопровождается выделением большого количества тепла. Раствор SО3,ч в 100%-й серной кислоте называется олеумом (H2SO4•nSO3,). Олеум представляет собой бесцветную маслянистую жидкость плотностью 1,9 г/см3; на воздухе дымит, образуя туман из серной кислоты. Безводная серная кислота очень активна и растворяет оксиды металлов, а при повышенной температуре вытесняет все другие кислоты из их солей. Концентрированная серная кислота — это эффективное водоотнимающее средство от других кислот, кристаллогидратов солей, а также углеводов. Поэтому она применяется для концентрирования азотной и других кислот, сушки влажных газов и т. д. При реакции с серной кислотой сахар, целлюлоза, крахмал и другие органические продукты обугливаются. На концентрацию и качество серной кислоты в значительной мере влияет способ производства.
Срок годности и срок хранения серной кислоты
Изготовитель гарантирует соответствие серной кислоты требованиям настоящего стандарта при соблюдении условий транспортирования и хранения, как правило, 1 — один месяц со дня изготовления. Это гарантии производителя, указанные на период совершения сделки и отгрузки со склада. Непосредственно сам срок хранения и годности серной кислоты, при соблюдении правил хранения данного продукта, составляет 3 — три года со дня изготовления.
Что такое прекурсор?
Прекурсор — вещество, участвующее в реакции, приводящей к образованию целевого вещества. Например, в биохимии слово применяется в отношении промежуточного участника. Законодательное определение понятия «прекурсоры» дано в Федеральном законе №3-ФЗ от 08.01.1998 г. «О наркотических средствах и психотропных веществах». В соответствии с данным нормативно-правовым актом к прекурсорам относятся вещества, часто используемые при производстве, изготовлении, переработке наркотических средств и психотропных веществ. Таким образом, прекурсор – это специфический химический элемент (или смесь), который может выступать в качестве исходного компонента для синтеза какого-либо сложного запрещенного вещества. Прекурсоры — вещества, часто используемые при производстве, изготовлении, переработке наркотических средств, включенных в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации. Список прекурсоров, оборот которых в Российской Федерации ограничен и в отношении которых устанавливаются меры контроля в соответствии с законодательством Российской Федерации и международными договорами Российской Федерации (список IV) (в ред. Постановления Правительства РФ от 02.07.2015 N 665).






![{\displaystyle {\underset {\text{polysaccharide}}{{\ce {[C6H10O5]}}_{n}}}\longrightarrow 6n\ {\ce {C}}+5n\ {\ce {H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc5b432fe56cddc7fd4e08fda4502ba801cd3d07)