Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Олодатерол
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Олодатерол
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Олодатерол
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Источники информации
-
Торговые названия с действующим веществом Олодатерол
Структурная формула
Русское название
Олодатерол
Английское название
Olodaterol
Латинское название
Olodaterolum (род. Olodateroli)
Химическое название
6-Гидрокси-8-[(1R)-1-гидрокси-2-[[1-(4-метоксифенил)-2-метилпропан-2-ил]амино]этил]-4H-1,4-бензоксазин-3-он (и в виде гидрохлорида)
Брутто формула
C21H26N2O5
Фармакологическая группа вещества Олодатерол
Нозологическая классификация
Код CAS
868049-49-4
Фармакологическое действие
—
бронходилатирующее, бета2-адреномиметическое.
Характеристика
Бронхолитическое средство, бета2-адреномиметик длительного действия.
Олодатерола гидрохлорид — белый или почти белый порошок, трудно растворим в воде, мало растворим в этаноле.
Фармакология
Фармакодинамика
Олодатерол обладает высоким сродством и селективностью к бета2-адренорецепторам. Активация бета2-адренорецепторов в дыхательных путях приводит к стимуляции внутриклеточной аденилатциклазы, которая участвует в синтезе цАМФ. Повышение уровня цАМФ вызывает бронходилатацию, расслабляя гладкомышечные клетки в дыхательных путях. Олодатерол является селективным агонистом бета2-адренорецепторов длительного действия, характеризуется быстрым началом действия и длительным сохранением эффекта в течение не менее 24 ч. Бета2-адренорецепторы присутствуют не только в гладких мышцах дыхательных путей, но и на поверхности многих других клеток, в т.ч. в эпителии и эндотелии сосудов легких и сердца. Точная функция бета2-рецепторов в сердце неизвестна, но их присутствие указывает на возможность влияния на сердце бета2-адренергических агонистов.
RxList.com (обновление 2021 г.)
Исследования in vitro показали, что олодатерол обладает в 241 раз большей агонистической активностью в отношении бета2-адренорецепторов по сравнению с бета1-адренорецепторами и в 2299 раз большей агонистической активностью по сравнению с бета3-адренорецепторами. Клиническое значение этих результатов неизвестно.
Установлено, что однократное применение олодатерола в дозах 10, 20, 30 и 50 мкг приводило через 20 мин — 2 ч к увеличению (по сравнению с плацебо) интервала QT (пo сравнению с исходным значением), который по мере повышения дозы в среднем возрастал с 1,6 мс (олодатерол в дозе 10 мкг) до 6,5 мс (олодатерол в дозе 50 мкг).
Не было обнаружено каких-либо тенденций к изменению средних величин ЧСС или частоты экстрасистол и их типа в зависимости от величины дозы олодатерола (5 или 10 мкг) или от времени.
RxList.com
Электрофизиология. Влияние олодатерола на интервал QT/QTc на ЭКГ было исследовано у 24 здоровых мужчин и женщин-добровольцев в двойном слепом рандомизированном плацебо- и актив-контролируемом (моксифлоксацин) исследовании при однократных дозах олодатерола 10, 20, 30 и 50 мкг. Было отмечено дозозависимое удлинение интервала QTcI (интервал QT, скорректированный в соответствии с методом индивидуальной коррекции). Максимальные значения (односторонний 95% верхний доверительный предел) отличия QTcI от плацебо после базовой коррекции составляли 2,5 (5,6) мс, 6,1 (9,2) мс, 7,5 (10,7) мс и 8,5 (11,6) мс при дозах олодатерола 10, 20, 30 и 50 мкг соответственно.
Влияние олодатерола в дозах 5 и 10 мкг на ЧСС и ритм сердца оценивали с помощью непрерывной 24-часовой записи ЭКГ (холтеровское мониторирование) в подгруппе 772 пациентов в 48-недельных плацебо-контролируемых исследованиях фазы 3. Не было обнаружено каких-либо тенденций к изменению средних значений ЧСС или числа и типа экстрасистол в зависимости от дозы или времени. Не обнаружено значимых изменений параметров экстрасистол в конце лечения по сравнению с исходными показателями для доз олодатерола 5 мкг, 10 мкг и плацебо.
Исследования показали: применение олодатерола в дозе 5 мкг 1 раз в день, утром, приводило к значительному улучшению (р<0,0001) функции легких в течение 5 мин после первой дозы (среднее увеличение объема форсированного выдоха за 1-ю секунду (ОФВ1) составляло 0,13 л по сравнению с исходным значением до лечения 1,18 л). Существенное улучшение функции легких сохранялось в течение 24 ч, среднее увеличение AUC0–3 ОФВ1 составляло 0,162 л по сравнению с плацебо, р<0,0001; среднее увеличение базального (через 24 ч) ОФВ1 составляло 0,071 л по сравнению с плацебо, р<0,0001.
В двух исследованиях переносимости физической нагрузки было установлено, что олодатерол по сравнению с плацебо увеличивает время до наступления усталости. Олодатерол по сравнению с плацебо так же уменьшает гиперинфляцию легких (функциональную остаточную емкость легких), что приводит к увеличению емкости вдоха в покое и во время осуществления физической нагрузки.
Фармакокинетика
Фармакокинетика олодатерола носит линейный характер. При однократном ингаляционном применении доз, составлявших от 5 до 70 мкг, а также после многократного применения олодатерола 1 раз в день в дозах, составлявших от 2 до 20 мкг, системное воздействие увеличивалось пропорционально повышению дозы. После повторного ежедневного применения олодатерола равновесное состояние достигалось через 8 дней, а степень воздействия увеличивалась в 1,8 раза по сравнению с применением однократной дозы.
Всасывание. Олодатерол быстро всасывается, Cmax в плазме обычно достигается в течение 10–20 мин после ингаляции. У здоровых добровольцев после ингаляции абсолютная биодоступность олодатерола составляла около 30%, тогда как абсолютная биодоступность олодатерола после приема внутрь в виде раствора была <1%. Таким образом, системное воздействие олодатерола после ингаляционного применения в основном реализуется путем всасывания в легких, а вклад проглатываемой части дозы в системное воздействие незначителен.
Распределение. Олодатеролу после ингаляционного применения и в/в введения свойственна мультикомпартментная кинетика распределения. Vd — 1110 л, что свидетельствует о хорошем распределении олодатерола по тканям. Связывание [14С]олодатерола с белками плазмы человека in vitro не зависит от концентрации и составляет примерно 60%.
Биотрансформация. Олодатерол в значительной степени метаболизируется путем непосредственной глюкуронизации и О-деметилирования метоксилированной части молекулы с последующей конъюгацией. Из 6 идентифицированных метаболитов с бета2-рецепторами связывается только одно неконъюгированное деметилированное производное (SOM 1522), однако этот метаболит не обнаруживался в плазме после длительного ингаляционного применения олодатерола в рекомендуемой терапевтической дозе или в дозах, превышавших терапевтическую в 4 раза. В связи с этим считается, что фармакологическое действие обусловлено самим олодатеролом.
В О-деметилировании олодатерола участвуют изоферменты CYP2C9 и CYP2C8 цитохрома Р450 и (в незначительной степени) CYP3A4. В образовании глюкуронидов олодатерола участвуют изоформы УДФ-ГТ — 2B7, 1A1, 1А7 и 1А9.
Выведение. Общий клиренс олодатерола у здоровых добровольцев составляет 872 мл/мин, почечный клиренс — 173 мл/мин. Конечный T1/2 после в/в применения — 22 ч, после ингаляционного применения — примерно 45 ч.
RxList.com (обновление 2021 г.)
Элиминация. T1/2 после ингаляции определяется скорее абсорбцией, чем процессами выведения. Однако эффективный T1/2 при суточной дозе 5 мкг, рассчитанный исходя из Cmax у пациентов с ХОБЛ, составляет 7,5 ч.
После в/в введения [14С]олодатерола общая радиоактивная доза (включая исходное соединение и все метаболиты), выделявшаяся через почки, составляла 38%, после приема внутрь — 9%. Количество неизмененного олодатерола, выделявшегося через почки после в/в введения составляло 19%. Общая меченная изотопом доза, выделявшаяся через кишечник, составляла после в/в введения 53% и 84% после приема внутрь. Более 90% дозы олодатерола выводилось после в/в введения в течение 5 дней и после приема внутрь в течение 6 дней. После ингаляционного применения экскреция неизмененного олодатерола с мочой на протяжении интервала дозирования составляла у здоровых добровольцев в равновесном состоянии 5–7% от величины дозы.
Зависимость параметров фармакокинетики от некоторых факторов
Изменение дозы олодатерола в зависимости от массы тела, пола и возраста не требуется.
Нарушения функции почек. У пациентов с выраженным поражением почек (Cl креатинина <30 мл/мин) системное воздействие олодатерола увеличивалось в среднем в 1,4 раза. Такое повышение воздействия не вызывает опасений в отношении безопасности, учитывая опыт, полученный в ходе применения олодатерола в клинических исследованиях.
Нарушения функции печени. У пациентов с небольшим и умеренным поражением печени системное воздействие олодатерола не изменялось. Системное воздействие олодатерола у пациентов со значительным поражением печени не изучалось.
RxList.com
Фармакокинетический метаанализ показал, что возраст, пол, масса тела не оказывают влияние на системное воздействие олодатерола после ингаляции у пациентов с ХОБЛ. Коррекция дозы не требуется.
Нарушение функции почек. У пациентов с выраженным нарушением функции почек (Cl креатинина <30 мл/мин) уровни олодатерола повышались примерно на 40%. Исследования у пациентов с нарушением функции почек умеренной или легкой степени не проведены.
Нарушение функции печени. У пациентов с легким и умеренным нарушением функции печени изменение Cmax и AUC олодатерола не отмечалось. Системное воздействие олодатерола у пациентов с тяжелым поражением печени не изучалось.
Раса. Сравнение фармакокинетических данных, полученных в клинических исследованиях, выявило тенденцию к более высокому системному воздействию олодатерола у пациентов азиатской расы по сравнению с пациентами европеоидной расы.
В клинических исследованиях олодатерола, применявшегося в дозах, которые превышали рекомендуемую терапевтическую дозу в 2 раза, у пациентов европеоидной и азиатской расы каких-либо опасений в отношении безопасности установлено не было.
Применение вещества Олодатерол
Длительная поддерживающая терапия ХОБЛ, включая хронический бронхит и эмфизему легких, для уменьшения обструкции дыхательных путей, улучшения качества жизни и переносимости физических нагрузок.
RxList.com (обновление 2021 г.)
Важные ограничения использования
Олодатерол не показан для лечения острых обострений ХОБЛ (см. «Меры предосторожности»).
Олодатерол не показан для лечения астмы. Безопасность и эффективность олодатерола при астме не установлены.
Противопоказания
Гиперчувствительность, возраст до 18 лет (безопасность и эффективность применения не определены).
RxList.com (обновление 2021 г.)
Применение длительно действующих агонистов бета2-адренорецепторов, включая олодатерол, без ингаляционных кортикостероидов противопоказано пациентам с астмой (см. «Меры предосторожности»). Олодатерол не показан для лечения астмы.
Ограничения к применению
Сердечно-сосудистые заболевания, в.т.ч. нестабильная ИБС, нарушение сердечного ритма, удлинение интервала QT, гипертрофическая обструктивная кардиомиопатия, артериальная гипертензия, тиреотоксикоз, судороги. Пациенты, в анамнезе которых отмечались инфаркт миокарда или госпитализация по поводу сердечной недостаточности (в течение предшедствующего года), жизнеугрожающая аритмия, пароксизмальная тахикардия с ЧСС>100 уд./мин.
Применение при беременности и кормлении грудью
Клинических данных о влиянии олодатерола на беременность нет. В доклинических исследованиях при использовании высоких доз олодатерола, в несколько раз превышавших терапевтические дозы, установлено влияние, типичное для бета2-адреномиметиков. Олодатерол не должен применяться у беременных женщин, если только потенциальная польза для матери не превышает потенциальный риск для плода.
Следует учитывать ингибирующее влияние олодатерола на сократительную способность матки.
Клинических данных о влиянии олодатерола на женщин, кормящих грудью, нет. Олодатерол не должен применяться у кормящих грудью женщин, если только потенциальная польза для матери не превышает потенциальный риск для ребенка.
RxList.com
Категория действия на плод по FDA — C.
Адекватные и строго контролируемые исследования применения олодатерола у беременных женщин не проведены. Применение олодатерола при беременности возможно только в случае, если ожидаемый эффект терапии превышает потенциальный риск для плода. В доклинических исследованиях при использовании высоких доз олодатерола, в несколько раз превышавших терапевтические, олодатерол оказывал тератогенное действие у кроликов.
Роды и родоразрешение. Адекватные и строго контролируемые исследования по влиянию олодатерола на роды не проведены. Поскольку бета-агонисты влияют на сократительную активность матки, использование олодатерола во время родов возможно только у тех пациенток, у которых преимущества терапии несомненно перевешивают риск.
Олодатерол и/или его метаболиты экскретируются в молоко лактирующих крыс. Возможно, олодатерол и/или его метаболиты проникают в молоко кормящих женщин. Исследований влияния олодатерола на организм младенцев, находящихся на грудном вскармливании, не проведено. Следует проявлять осторожность при использовании олодатерола у кормящих женщин.
RxList.com (обновление 2021 г.)
Беременность
Резюме рисков. Нет адекватных и хорошо контролируемых клинических исследований олодатерола у беременных женщин, чтобы информировать об ассоциированном с ним риске неблагоприятных последствий при беременности. Есть клинические соображения по применению олодатерола у беременных женщин (см. выше — Роды и родоразрешение). В исследованиях на животных олодатерол не обладал тератогенным действием при применении у беременных крыс или кроликов во время органогенеза в ингаляционных дозах, примерно в 2731 или 1353 раз превышающих максимальную рекомендуемую суточную ингаляционную дозу для человека (на основе AUC), у крыс или кроликов соответственно.
Предполагаемый фоновый риск серьезных врожденных дефектов и выкидыша у женщин неизвестен. При любой беременности существует фоновый риск развития врожденного порока, выкидыша или других неблагоприятных исходов. В общей популяции в США оцениваемый фоновый уровень риска серьезных врожденных пороков развития и выкидыша при клинически установленной беременности составляет от 2 до 4% и от 15 до 20% соответственно.
Период грудного вскармливания
Резюме рисков. Нет доступных данных о наличии олодатерола в грудном молоке женщин, его влиянии на грудного ребенка или воздействии на выработку молока. Олодатерол и/или его метаболиты присутствуют в молоке лактирующих крыс, однако из-за видоспецифических различий в физиологии лактации клиническая значимость этих данных неясна (см. Исследования у животных). Следует учитывать преимущества грудного вскармливания для развития и здоровья, а также клиническую потребность матери в применении олодатерола и любые возможные неблагоприятные эффекты для ребенка, находящегося на грудном вскармливании, или основного состояния матери.
Исследования у животных. Распределение олодатерола в молоке исследовали после однократного в/в введения 0,4 мкмоль/кг лактирующим крысам. Олодатерол и/или его метаболиты присутствуют в молоке лактирующих крыс в концентрациях выше, чем в плазме.
Побочные действия вещества Олодатерол
Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований олодатерола.
Олодатерол относится к группе бета2-адреномиметиков длительного действия. Поэтому следует принимать во внимание возможность возникновения нежелательных эффектов, характерных для всего класса бета-адреномиметиков, таких как тахикардия, аритмия, сердцебиение, ишемия миокарда, стенокардия, гипертензия или гипотензия, тремор, головная боль, нервозность, бессонница, головокружение, сухость во рту, тошнота, мышечный спазм, усталость, недомогание, гипокалиемия, гипергликемия и метаболический ацидоз.
Инфекции и инвазии: назофарингит.
Со стороны нервной системы: головокружение.
Со стороны ССС: гипертензия.
Со стороны кожных покровов: сыпь.
Костно-мышечная система и связанные с ней заболевания соединительной ткани: артралгия.
Возникновение сыпи может рассматриваться как реакция гиперчувствительности на олодатерол. Возможны и другие реакции гиперчувствительности (как и в случае местного применения любых всасывающихся ЛС).
RxList.com
Побочные эффекты, наблюдавшиеся в клинических испытаниях у больных ХОБЛ
Поскольку клинические испытания проводятся в разных условиях, частота возникновения неблагоприятных реакций, наблюдаемых в ходе клинического исследования ЛС не может непосредственно сравниваться с частотой побочных эффектов в других клинических исследованиях и может не отражать частоту этих эффектов в клинической практике.
Программа клинических испытаний олодатерола включала в себя 15 исследований, из них 7 — по оценке клинической эффективности и безопасности разных доз олодатерола и 8 — подтверждающих испытаний. Четыре из подтверждающих испытаний — 6-недельные перекрестные исследования и четыре — 48-недельные испытания в параллельных группах. Данные о побочных реакциях, наблюдавшихся в исследованиях эффективности различных доз и в четырех 6-недельных перекрестных исследованиях, соответствовали полученным в 48-недельных испытаниях в параллельных группах, которые сформировали первичную базу данных по безопасности.
Первичная база данных по безопасности включает объединенные данные четырех 48-недельных двойных слепых актив- и плацебо-контролируемых подтверждающих клинических испытаний в параллельных группах. В эти исследования были включены 3104 взрослых пациента с ХОБЛ (77% мужчин и 23% женщин) в возрасте 40 лет и старше. Из этих пациентов 876 больных применяли олодатерол 1 раз в день в дозе 5 мкг и 883 — в дозе 10 мкг. Группу пациентов, получавших олодатерол, составляли в основном представители европеоидной расы (66%) со средним возрастом 64 года. Контроль для сравнения включал группы плацебо во всех 4 исследованиях и формотерол в дозе 12 мкг в 2 исследованиях.
В этих четырех клинических испытаниях 72% пациентов, получавших олодатерол в какой-либо из доз, сообщили о неблагоприятных реакциях, по сравнению с 71% в группе плацебо. Доля пациентов, которые прекратили лечение олодатеролом из-за возникновения побочных эффектов — 7,2% по сравнению с 8,8% в группе плацебо. Наиболее распространенным побочным эффектом, который приводил к прекращению лечения олодатеролом, было ухудшение течения ХОБЛ. Наиболее серьезными неблагоприятными эффектами были обострение ХОБЛ, пневмония и мерцательная аритмия.
Далее представлены объединенные данные четырех 48-недельных двойных слепых плацебо-контролируемых испытаний у пациентов с ХОБЛ в возрасте 40 лет и старше. Указаны побочные эффекты, которые наблюдались у пациентов с ХОБЛ, применявших олодатерол в дозе 5 мкг/сут (n=876) или плацебо (n=885), отмеченные не менее чем у 2% пациентов и превышающие по частоте плацебо. Рядом с названием указана частота встречаемости данного побочного эффекта, в скобках — аналогичные данные в группе плацебо.
Инфекции и инвазии: назофарингит — 11,3% (7,7%), инфекции верхних дыхательных путей — 8,2% (7,5%), бронхит — 4,7% (3,6%), инфекции мочеполового тракта — 2,5% (1%).
Со стороны респираторной системы: кашель — 4,2% (4%).
Со стороны нервной системы: головокружение — 2,3% (2,1%).
Со стороны кожных покровов: сыпь — 2,2% (1,1%).
Со стороны органов ЖКТ: диарея — 2,9% (2,5%).
Со стороны опорно-двигательного аппарата: боль в спине — 3,5% (2,7%), артралгия — 2,1% (0,8%).
Дополнительные побочные эффекты, которые отмечались более чем у 2% пациентов, применявших 10 мкг олодатерола (и превышающие по частоте плацебо) — пневмония, запор, гипертермия.
Рак легких наблюдался у 0,7%, 0,3% и 0,2% пациентов, получавших 10 мкг, 5 мкг олодатерола и плацебо соответственно.
RxList.com (обновление 2021 г.)
Агонисты бета2-адренорецепторов длительного действия, такие как олодатерол, в качестве монотерапии (без ингаляционных кортикостероидов) при астме повышают риск астмаассоциированных событий. Олодатерол не показан для лечения астмы (см. «Меры предосторожности»).
Взаимодействие
Одновременное применение других адренергических ЛС может усиливать нежелательные эффекты олодатерола.
RxList.com
Адренергические ЛС. Следует соблюдать осторожность при сочетанном применении с адренергическими ЛС, т.к. они могут потенцировать симпатомиметические эффекты олодатерола.
Ксантиновые производные, стероиды, диуретики. Одновременное применение ксантиновых производных, стероидов или диуретиков (не относящихся к группе калийсберегающих) может усиливать гипокалиемический эффект олодатерола (см. «Меры предосторожности»).
RxList.com
Некалийсберегающие диуретики. Изменения на ЭКГ и/или гипокалиемия, которые могут возникнуть в результате применения некалийсберегающих диуретиков (например петлевые или тиазидные диуретики), могут резко усугубляться бета-агонистами, особенно когда рекомендуемая доза бета-агониста превышена. Хотя клиническое значение этих эффектов неизвестно, рекомендуется проявлять осторожность при совместном применении бета-агонистов с некалийсберегающими диуретиками.
Бета-адреноблокаторы. Бета-адреноблокаторы могут ослаблять эффект олодатерола или противодействовать этому эффекту. Поэтому олодатерол должен применяться вместе с адренергическими бета-блокаторами (включая глазные капли) только в вынужденных ситуациях. В этом случае предпочтительно применение кардиоселективных бета-адреноблокаторов, хотя и они должны применяться с осторожностью.
RxList.com
Бета-адреноблокаторы. При одновременном применении бета-адреноблокаторы и олодатерол могут изменять эффекты друг друга. Бета-адреноблокаторы не только снижают терапевтический эффект олодатерола, но могут привести к тяжелому бронхоспазму у пациентов с ХОБЛ. Поэтому олодатерол у пациентов с ХОБЛ должен применяться вместе с бета-адреноблокаторами (включая глазные капли) только в вынужденных ситуациях (например в качестве профилактики после инфаркта миокарда). В этом случае предпочтительно применение кардиоселективных бета-адреноблокаторов, хотя и они должны применяться с осторожностью.
Ингибиторы МАО, трициклические антидепрессанты и ЛС, удлиняющие интервал QTс. Ингибиторы МАО, трициклические антидепрессанты или другие ЛС, способные удлинять интервал QTc, могут усиливать действие олодатерола на ССС, совместное применение должно осуществляться с крайней осторожностью. Одновременное применение ЛС, удлиняющих интервал QT, ассоциировано с повышенным риском желудочковых аритмий.
Кетоконазол. Совместное применение олодатерола с кетоконазолом приводило к увеличению системного воздействия олодатерола в 1,7 раза, однако это не влияло на безопасность. Изменений дозирования не требуется.
RxList.com
Кетоконазол. Совместное применение олодатерола с кетоконазолом (400 мг 1 раз в день в течение 14 дней) — сильным ингибитором Р-gp и CYP3А4, CYP2C8, CYP2C9 — приводило к увеличению Cmax олодатерола на 66% и AUC на 68%. Изменений дозирования не требуется.
Флуконазол. Сочетанное применение олодатерола с флуконазолом (400 мг 1 раз в день в течение 14 дней) — сильным ингибитором CYP2C9 — не оказывало значимого влияния на системную экспозицию олодатерола.
Тиотропия бромид. При сочетанном применении тиотропия бромида с олодатеролом в фиксированной комбинации доз в течение 21 дня не выявлено существенного влияния этих ЛС на экспозицию друг друга.
Передозировка
Симптомы: передозировка олодатерола может привести к выраженным эффектам, типичным для бета2-адреномиметиков, например к ишемии миокарда, гипертензии или гипотензии, тахикардии, аритмиям, сердцебиению, головокружению, нервозности, бессоннице, беспокойству, головной боли, тремору, сухости во рту, спазму мышц, тошноте, усталости, недомоганию, гипокалиемии, гипергликемии и метаболическому ацидозу.
RxList.com
Симптомы: чрезмерная бета-адренергическая стимуляция и возникновение или усиление любого из симптомов — ишемия миокарда, стенокардия, гипертензия или гипотензия, тахикардия, аритмия, пальпитация, головокружение, нервозность, инсомния, беспокойство, головная боль, тремор, сухость во рту, спазм мышц, тошнота, усталость, недомогание, гипокалиемия, гипергликемия, метаболический ацидоз. Возможна остановка сердца и летальный исход.
Лечение: прием олодатерола должен быть прекращен. Показано поддерживающее и симптоматическое лечение. В серьезных случаях необходима госпитализация. Может рекомендоваться применение кардиоселективных бета-адреноблокаторов, но только при соблюдении особой осторожности, т.к. использование этих ЛС может вызвать бронхоспазм.
RxList.com (обновление 2021 г.)
Недостаточно доказательств, чтобы определить, полезен ли диализ при передозировке олодатерола. В случае передозировки рекомендуется сердечный мониторинг.
Способ применения и дозы
Ингаляционно. Взрослым, 5 мкг 1 раз в сутки.
У пожилых пациентов, пациентов с легким и умеренным нарушением функции печени и пациентов с нарушением функции почек коррекция дозы не требуется. Данных о применении олодатерола у пациентов с тяжелыми нарушениями функции печени нет.
Меры предосторожности
Олодатерол предназначен для поддерживающего лечения больных ХОБЛ. В связи с тем обстоятельством, что в общей популяции ХОБЛ существенно преобладают больные в возрасте старше 40 лет, при назначении олодатерола пациентам до 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ.
Бронхиальная астма. Олодатерол не должен использоваться при бронхиальной астме. Долговременная эффективность и безопасность олодатерола при бронхиальной астме не изучались.
RxList.com
Смертность от астмы
Длительно действующие агонисты бета2-адренорецепторов, в т.ч. олодатерол, увеличивают риск смертности, ассоциированной с астмой.
Масштабное 28-недельное плацебо-контролируемое исследование в США по оценке безопасности другого бета2-адреномиметика длительного действия (салметерол) у пациентов с астмой показало, что добавление салметерола к стандартной терапии астмы приводило к увеличению смертности, связанной с астмой, — 13 летальных исходов в группе больных, дополнительно получавших салметерол (13176 пациентов), против 3 смертей в группе, получавшей плацебо (13179 пациентов). Повышение риска астмаассоциированной смертности считается класс-эффектом бета2-агонистов длительного действия, включая олодатерол.
RxList.com (обновление 2021 г.)
Серьезные события, связанные с астмой, — госпитализация, интубация, смерть
Использование бета2-адренергических агонистов длительного действия в качестве монотерапии (без ингаляционных кортикостероидов) при астме связано с повышенным риском астмаассоциированной смерти. Имеющиеся данные контролируемых клинических испытаний также предполагают, что применение бета2-адренергических агонистов длительного действия в качестве монотерапии увеличивает риск госпитализации по поводу астмы у педиатрических пациентов и пациентов подросткового возраста. Эти данные свидетельствуют о класс-эффекте агонистов бета2-адренорецепторов длительного действия при монотерапии астмы. Данные крупных клинических испытаний не показывают значительного увеличения риска серьезных событий, связанных с астмой (госпитализация, интубация, смерть), если агонисты бета2-адренорецепторов длительного действия используются в комбинации с фиксированной дозой кортикостероидов в сравнении с одними кортикостероидами.
Не проводилось адекватных исследований для определения того, увеличивается ли уровень смертности от астмы у пациентов, получавших олодатерол.
Доступные данные не предполагают повышенного риска смертности при применении бета2-адренергических агонистов длительного действия у пациентов с ХОБЛ.
Острый бронхоспазм. Олодатерол не предназначен для лечения острых эпизодов бронхоспазма, т.е. в качестве средства скорой помощи.
RxList.com (обновление 2021 г.)
Обострение болезни и острые эпизоды
Олодатерол не следует назначать пациентам с резко ухудшающейся ХОБЛ, которая может быть опасным для жизни состоянием. Олодатерол не изучался у пациентов с резко ухудшающейся ХОБЛ. Использование его в этом случае недопустимо.
Олодатерол не следует использовать для купирования острых симптомов, т.е. в качестве средства скорой помощи для лечения острых эпизодов бронхоспазма. Не изучали применение олодатерола для облегчения острых симптомов, и дополнительные дозы не должны использоваться для этой цели. Острые симптомы следует лечить ингаляционными бета2-агонистами короткого действия.
При начале применения олодатерола пациенты, которые принимали ингаляционные бета2-агонисты короткого действия на регулярной основе (например, 4 раза в день), должны быть проинструктированы о прекращении регулярного использования этих ЛС и применять их только для симптоматического облегчения острых респираторных симптомов. При назначении олодатерола врач должен также назначить ингаляционный бета2-агонист короткого действия и проинструктировать пациента о том, как его следует применять. Увеличение использования ингаляционных бета2-агонистов является признаком ухудшения состояния, при котором требуется немедленная медицинская помощь.
ХОБЛ может резко ухудшаться в течение нескольких часов или хронически в течение нескольких дней или дольше. Если олодатерол больше не контролирует симптомы бронхоспазма, или вдыхаемый бета2-агонист короткого действия для пациента становится менее эффективным, или пациенту требуется больше ингаляций бета2-агониста короткого действия, чем обычно, это может быть маркером обострения заболевания. В таких условиях следует сразу же провести повторную оценку состояния пациента и схемы лечения ХОБЛ. Повышение суточной дозы олодатерола сверх рекомендуемой дозы в этой ситуации нецелесообразно.
Олодатерол, являющийся бета2-адреномиметиком, не должен использоваться чаще, чем рекомендовано, в более высоких дозах, чем рекомендовано, или в сочетании с другими ЛС, содержащими бета2-агонисты длительного действия, т.к. это может привести к передозировке. Сообщалось о клинически значимых сердечно-сосудистых эффектах и фатальных исходах в связи с чрезмерным использованием ингаляционных симпатомиметиков.
Гиперчувствительность. После применения олодатерола возможно развитие реакций гиперчувствительности немедленного типа (как и при использовании любых ЛС).
RxList.com
Гиперчувствительность. После применения олодатерола возможно развитие реакций гиперчувствительности немедленного типа, включая ангионевротический отек. В случае развития таких реакций терапию олодатеролом следует прекратить и рассмотреть вопрос об альтернативном лечении.
Парадоксальный бронхоспазм. Применение олодатерола может привести к парадоксальному бронхоспазму, иногда жизнеугрожающему. В случае развития парадоксального бронхоспазма применение олодатерола должно быть немедленно прекращено и назначена альтернативная терапия.
Системные эффекты. Бета-адреномиметики длительного действия следует применять с осторожностью у пациентов с необычными реакциями на симпатомиметические амины.
Сердечно-сосудистые эффекты. Олодатерол может оказывать клинически существенное влияние на ССС у некоторых пациентов (учащение пульса, повышение АД и/или появление соответствующих жалоб). В этих случаях может потребоваться прекращение лечения. Кроме того, сообщалось, что бета2-адреномиметики приводили к таким изменениям на ЭКГ, как уплощение зубца Т и депрессия сегмента ST, хотя клиническое значение этих изменений неизвестно.
RxList.com
Бета2-адреномиметики длительного действия следует назначать с осторожностью пациентам с сердечно-сосудистыми заболеваниями, особенно коронарной недостаточностью, сердечной аритмией, гипертрофической обструктивной кардиомиопатией и артериальной гипертензией (см. «Ограничения к применению»).
RxList.com (обновление 2021 г.)
Сопутствующие состояния
Олодатерол, как и другие симпатомиметические амины, следует применять с осторожностью у пациентов с судорожными расстройствами или тиреотоксикозом, пациентов с известным или предполагаемым удлинением интервала QT, а также пациентов, которые очень чувствительны к симпатомиметическим аминам. Сообщалось, что дозы родственного бета2-агониста албутерола при в/в введении усугубляют ранее существовавший сахарный диабет и кетоацидоз.
Гипокалиемия. Бета2-адреномиметики у некоторых пациентов могут вызывать существенную гипокалиемию, создающую предпосылки для возникновения нежелательных влияний на ССС. Снижение концентрации калия в сыворотке обычно кратковременно и не требует его восполнения. У пациентов с тяжелой ХОБЛ гипокалиемия может усиливаться гипоксией и сопутствующим лечением (см. «Взаимодействие») и увеличивать риск развития аритмий.
Гипергликемия. Ингаляционное применение больших доз бета2-адреномиметиков может привести к увеличению концентрации глюкозы в плазме.
RxList.com
Гипокалиемия и гипергликемия. Изменения уровня калия в сыворотке крови были оценены у больных ХОБЛ в двойных слепых исследованиях фазы 3. Объединенные данные показывают, что при рекомендуемой дозе 5 мкг не было клинически значимых изменений содержания калия по сравнению с плацебо.
В ходе клинических исследований с долгосрочным применением олодатерола клинически заметное изменение уровня глюкозы в крови было нечастым и проявлялось с частотой, аналогичной плацебо. Применение олодатерола у пациентов с сахарным диабетом, который не контролируется, не исследовано.
Олодатерол не следует применять в комбинации с каким-либо другим ЛС, содержащим бета2-адреномиметики длительного действия.
Пациентов, часто применяющих ингаляционные бета2-адреномиметики короткого действия (например 4 раза в день), необходимо проинструктировать о том, что эти ЛС используются только для облегчения острых симптомов бронхоспазма.
RxList.com (обновление 2021 г.)
Применение в педиатрии. Олодатерол не показан для применения у детей. Безопасность и эффективность олодатерола в педиатрической популяции не установлены.
Применение в гериатрии. На основании имеющихся данных, корректировка дозы олодатерола у гериатрических пациентов не требуется.
Из 876 пациентов, применявших олодатерол в рекомендованной дозе 5 мкг 1 раз в день в клинических исследованиях, по данным объединенной одногодичной базы, 485 были в возрасте ≤65 лет, а 391 (44,6%) — старше 65 лет.
Каких-либо общих различий в эффективности не наблюдалось, и по объединенным данным за 1 год, профили побочных реакций были сходными в популяции пожилых пациентов по сравнению с пациентами популяции в целом.
Печеночная недостаточность. Не обнаружено каких-либо изменений Cmax или AUC, а также связывания с белками у пациентов с легким и умеренным нарушением функции печени и здоровых людей группы контроля. Исследование с участием пациентов с тяжелой печеночной недостаточностью не проводилось.
Почечная недостаточность. У пациентов с тяжелой почечной недостаточностью не обнаружено клинически значимых изменений Cmax или AUC по сравнению со здоровыми людьми из контрольной группы.
Влияние на способность управлять транспортными средствами и механизмами. Исследования по изучению влияния олодатерола на способность управлять транспортными средствами и механизмами не проводились. Следует соблюдать осторожность при выполнении данных видов деятельности, т.к. возможно развитие головокружения.
Источники информации
www.grls.rosminzdrav.ru, 2013 и www.rxlist.com, 2015, www.rxlist.com, 2021.
Торговые названия с действующим веществом Олодатерол
Фармакологическое действие
Бронхолитическое средство, бета2-адреномиметик. Олодатерол обладает высоким сродством и селективностью к β2-адренорецепторам. Активация β2-адренорецепторов в дыхательных путях приводит к стимуляции внутриклеточной аденилатциклазы, которая участвует в синтезе циклического 3,5-аденозинмонофосфата (цАМФ). Повышение уровня цАМФ вызывает бронходилатацию, расслабляя гладкомышечные клетки в дыхательных путях. Олодатерол является селективным агонистом β2-адренорецепторов длительного действия, характеризуется быстрым началом действия и длительным сохранением эффекта в течение не менее 24 ч. β2-адренорецепторы присутствуют не только в гладких мышцах дыхательных путей, но и на поверхности многих других клеток, в т.ч. в эпителии и эндотелии легких и сердца. Точная функция β2-рецепторов в сердце не известна, но их присутствие указывает на возможность влияния на сердце даже высокоселективных бета2-адренергических агонистов. Установлено, что однократное применение олодатерола в дозах 10, 20, 30 и 50 мкг приводило через 20 мин-2 ч к увеличению (по сравнению с плацебо) интервала QT (по сравнению с исходным значением), который по мере повышения дозы в среднем возрастал с 1.6 мс (олодатерол в дозе 10 мкг) до 6.5 мс (олодатерол в дозе 50 мкг). Не было обнаружено каких-либо тенденций к изменению средних величин ЧСС или частоты экстрасистол и их типа в зависимости от дозы или от времени.
Олодатерол в дозе 5 мкг 1 раз/сут (утром) приводит к значительному улучшению (р<0.0001) функции легких в течение 5 мин после первой дозы (среднее увеличение ОФВ1 составляло 0.130 л по сравнению с исходным значением до лечения 1.18 л). Существенное улучшение функции легких сохранялось в течение 24 ч, среднее увеличение AUC0-3 ОФВ1 составляло 0.162 л по сравнению с плацебо, р<0.0001; среднее увеличение базального (через 24 ч) ОФВ1 составляло 0.071 л по сравнению с плацебо, р<0.0001.
В двух исследованиях переносимости физической нагрузки было установлено, что олодатерол по сравнению с плацебо увеличивает время до наступления усталости (соответственно на 14% р=0.0002 и на 11.8% р=0.0018). Олодатерол по сравнению с плацебо также уменьшает функциональную остаточную емкость легких, что приводит к увеличению емкости вдоха в покое и при физической нагрузке.
Фармакокинетика
Олодатерол характеризуется линейной фармакокинетикой.
При однократном ингаляционном применении в дозах от 5 до 70 мкг, а также после многократного применения в дозах от 2 до 20 мкг 1 раз/сут биодоступность увеличивалась пропорционально повышению дозы.
После повторного применения 1 раз/сут равновесное состояние достигалось через 8 дней, а биодоступность увеличивалась по сравнению с применением в однократной дозе в 1.8 раза.
Олодатерол быстро всасывается, после ингаляционного применения. Cmax в плазме обычно достигается в течение 10-20 мин. У здоровых добровольцев после ингаляции абсолютная биодоступность олодатерола составляла около 30%, при приеме внутрь — около 1%. Таким образом, системное воздействие олодатерола после ингаляционного применения в основном обусловлено всасыванием в легких, а вклад проглатываемой части дозы в системное воздействие незначителен.
Олодатеролу после ингаляционного применения и в/в введения свойственна мультикомпартментная кинетика распределения. Vd составляет 1110 л, что указывает на обширное распределение препарата в тканях. Связывание олодатерола с белками плазмы человека in vitro не зависит от концентрации и составляет примерно 60%.
Олодатерол в значительной степени метаболизируется путем непосредственной глюкуронизации и O-деметилирования метоксилированной части молекулы с последующей конъюгацией. Из шести идентифицированных метаболитов с β2-рецепторами связывается только одно неконъюгированное деметилированное производное (SOM 1522), однако этот метаболит не обнаруживался в плазме после длительного ингаляционного применения олодатерола в рекомендуемой терапевтической дозе или в дозах, превышавших терапевтическую в 4 раза. В связи с этим считается, что фармакологическое действие обусловлено исключительно самим олодатеролом.
В O-деметилировании олодатерола участвуют изоферменты CYP2C9 и CYP2C8, и (в незначительной степени) CYP3A4. В образовании глюкуронидов олодатерола участвуют изоформы уридиндифосфатглюкоза-глюкуронилтрансферазы, UGT2B7, UGT1A1, 1А7 и 1А9.
Общий клиренс олодатерола у здоровых добровольцев составляет 872 мл/мин, а почечный клиренс 173 мл/мин. Конечный T1/2 после в/в применения препарата составляет 22 ч, тогда как конечный T1/2 после ингаляционного применения составляет примерно 45 ч. Из этого следует, что в последнем случае выведение в большей степени зависит от всасывания.
Общая меченная изотопом доза, выделявшаяся почками (включая исходное соединение и все метаболиты) составляла после в/в введения 38%, после приема внутрь — 9%. Общая меченная изотопом доза, выделявшаяся через почками неизменного олодатерола составляла после в/в введения 19%. Общая меченная изотопом доза, выделявшаяся через кишечник, составляла после в/в введения 53% и 84% — после приема внутрь.
Более 90% дозы выводилось после в/в введения в течение 5 дней и после приема внутрь — в течение 6 дней. После ингаляционного применения экскреция неизмененного олодатерола с мочой на протяжении интервала дозирования составляла у здоровых добровольцев в период равновесного состояния 5-7% от величины дозы.
Показания активного вещества
ОЛОДАТЕРОЛ
Для длительной поддерживающей терапии у пациентов с ХОБЛ, включая хронический бронхит и эмфизему легких, для уменьшения обструкции дыхательных путей, улучшения качества жизни и переносимости физических нагрузок.
Режим дозирования
Для ингаляционного применения.
Рекомендуется терапевтическая доза — 5 мкг 1 раз/сут.
Побочное действие
Со стороны дыхательной системы: назофарингит.
Со стороны нервной системы: головокружение.
Со стороны сердечно-сосудистой системы: артериальная гипертензия.
Со стороны кожных покровов: сыпь.
Со стороны костно-мышечной системы: артралгия.
Следует учитывать возможность развития побочные эффектов, характерных для всего класса β-адреномиметиков: тахикардия, аритмия, сердцебиение, ишемия миокарда, стенокардия, артериальная гипертензия или гипотензия, тремор, головная боль, нервозность, бессонница, головокружение, сухость во рту, тошнота, мышечный спазм, усталость, недомогание, гипокалиемия, гипергликемия и метаболический ацидоз.
Противопоказания к применению
Детский и подростковый возраст до 18 лет, повышенная чувствительность к олодатеролу.
Применение при беременности и кормлении грудью
Применение при беременности и лактации (грудного вскармливания) возможно только в том случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
Клинических данных о влиянии олодатерола на течение беременности нет. В доклинических исследованиях при введении олодатерола в высоких дозах, в несколько раз превышавших терапевтические, наблюдались эффекты, типичные для β2-адреномиметиков.
Следует учитывать ингибирующее влияние олодатерола на сократительную способность матки.
Клинических данных о применении олодатерола в период лактации нет.
Особые указания
С осторожностью следует применять при сердечно-сосудистых заболеваниях, в т.ч. нестабильной ИБС, нарушении сердечного ритма, удлинении интервала QT, гипертрофической обструктивной миокардиопатии, артериальной гипертензии, тиреотоксикозе, судорогах, а также у пациентов, в анамнезе которых имеются указания на такие заболевания как инфаркт миокарда или госпитализация по поводу сердечной недостаточности (в течение предшествующего года), жизнеугрожающая аритмия, пароксизмальная тахикардия с ЧСС >100 уд./мин.
Олодатерол не предназначен для лечения острых эпизодов бронхоспазма, т.е. в качестве средства скорой помощи.
Олодатерол предназначен для поддерживающего лечения больных ХОБЛ. В связи с тем, что в общей популяции ХОБЛ существенно преобладают пациенты в возрасте старше 40 лет, при назначении препарата пациентам в возрасте до 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ.
Олодатерол не следует применять при бронхиальной астме. Долговременная эффективность и безопасность олодатерола при бронхиальной астме не изучались.
β2-адреномиметики длительного действия следует применять с осторожностью у пациентов с необычными реакциями на симпатомиметические амины.
β2-адреномиметики у некоторых пациентов могут вызывать существенную гипокалиемию, создающую предпосылки для возникновения побочных реакций со стороны сердечно-сосудистой системы. Снижение содержания калия в сыворотке обычно кратковременно и не требует его восполнения. У пациентов с тяжелой ХОБЛ гипокалиемия может прогрессировать вследствие гипоксии и сопутствующей терапии и увеличивать риск развития аритмий.
Ингаляционное применение β2-адреномиметиков в высоких дозах может привести к увеличению уровня глюкозы в плазме.
Олодатерол не следует применять в комбинации с каким-либо другим лекарственным препаратом, содержащим β2-адреномиметики длительного действия.
Влияние на способность к управлению транспортными средствами и механизмами
Исследования по изучению влияния олодатерола на способность к управлению транспортными средствами и механизмами не проводились. В период лечения пациенты должны соблюдать осторожность при выполнении данных видов деятельности, т.к. возможно развитие головокружения.
Лекарственное взаимодействие
При одновременном применении с другими адренергическими препаратами возможно усиление побочных эффектов олодатерола.
При одновременном применении ксантиновых производных, стероидов или диуретиков (не относящихся к группе калийсберегающих) возможно усиление гипокалиемического эффекта β-адреномиметиков.
Бета-адреноблокаторы могут ослаблять эффект олодатерола или противодействовать этому эффекту. Поэтому олодатерол следует применять вместе с бета-адреноблокаторами (включая глазные капли) только в вынужденных ситуациях. В этом случае предпочтительно применение кардиоселективных бета-адреноблокаторов (с осторожностью).
Ингибиторы МАО, трициклические антидепрессанты или другие препараты, способные удлинять интервал QTc, могут усиливать действие олодатерола на сердечно-сосудистую систему.
Одновременное применение олодатерола с кетоконазолом приводило к увеличению биодоступности олодатерола в 1.7 раза, однако это не влияло на безопасность; коррекция дозы не требуется.
Фармакокинетика комбинированного препарата Спиолто® Респимат® эквивалентна фармакокинетике отдельно применяемым олодатеролу и тиотропия бромиду.
Олодатеролу и тиотропия бромиду свойственна линейная фармакокинетика.
Устойчивое состояние фармакокинетики олодатерола достигалось через 8 дней при применении 1 раз в день, а степень воздействия увеличивалась по сравнению с применением однократной дозы в 1,8 раза.
Устойчивое состояние фармакокинетики тиотропия бромида при применении 1 раз в день достигалось через 7 дней.
Всасывание. Олодатерол быстро всасывается, после ингаляции препарата Cmax в плазме обычно достигается в течение 10–20 мин. У здоровых добровольцев после ингаляции препарата абсолютная биодоступность олодатерола составляла около 30%, тогда как абсолютная биодоступность олодатерола после приема препарата внутрь в виде раствора была ниже 1%. Таким образом, системное воздействие олодатерола после ингаляционного применения в основном реализуется путем всасывания в легких, а вклад проглатываемой части дозы в системное воздействие незначителен.
После ингаляции раствора тиотропия бромида в системный кровоток поступает около 33% от величины ингаляционной дозы. Абсолютная биодоступность при приеме внутрь составляет 2–3 %. Cmax в плазме наблюдается через 5–7 минут после ингаляции.
Распределение. Связывание олодатерола с белками плазмы составляет примерно 60%, а Vd — 1110 л.
Связывание тиотропия бромида с белками плазмы составляет 72%; Vd — 32 л/кг. Доклинические исследования показали, что тиотропия бромид не проникает через ГЭБ.
Биотрансформация. Олодатерол в значительной степени метаболизируется путем непосредственной глюкуронизации и O-деметилирования с последующей конъюгацией. Из шести идентифицированных метаболитов с β2-рецепторами связывается только одно неконъюгированное деметилированное производное (SOM 1522), однако этот метаболит не обнаруживается в плазме после длительного ингаляционного применения препарата в рекомендуемой терапевтической дозе или в дозах, превышающих терапевтическую в 4 раза. В O-деметилировании олодатерола участвует цитохром P450 (изоферментов CYP2C9, CYP2C8 и в незначительной степени — CYP3A4). В образовании глюкуронидов олодатерола участвуют изоформы УДФ-ГТ — UGT2B7, UGT1A1, 1A7 и 1A9.
Степень биотрансформации тиотропия бромида незначительна. Это подтверждается тем, что после в/в введения тиотропия бромида молодым здоровым добровольцам 74% тиотропия бромида выводится почками в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-N-метилскопин, и дитиенилгликолиевую кислоту; эти соединения не связываются с мускариновыми рецепторами.
В исследованиях in vitro показано, что некоторая часть препарата (<20 % от дозы после в/в введения) метаболизируется путем окисления цитохромом P450 (CYP2D6 и 3A4) с последующей конъюгацией с глутатионом и образованием различных метаболитов.
Выведение. Общий клиренс олодатерола у здоровых добровольцев составляет 872 мл/мин, а почечный клиренс — 173 мл/мин. Конечный T1/2 после в/в применения олодатерола составляет 22 ч, тогда как конечный T1/2 после ингаляционного применения — примерно 45 ч. Из этого следует, что в последнем случае выведение в большей степени зависит от всасывания.
Общая меченная изотопом доза олодатерола, выделявшаяся через почки (включая исходное соединение и все метаболиты) составляла после в/в введения 38%, после приема внутрь — 9%. Общая меченная изотопом доза, выделявшаяся через почки неизмененного олодатерола составляла, после в/в введения — 19%. Общая меченная изотопом доза, выделявшаяся через кишечник, составляла после в/в введения 53% и 84% — после приема внутрь.
Более 90% дозы препарата выводилось после в/в введения в течение 5 дней и после приема внутрь в течение 6 дней. После ингаляционного применения препарата экскреция неизмененного олодатерола почками на протяжении интервала дозирования составляла у здоровых добровольцев в период устойчивого состояния фармакокинетики 5–7% от величины дозы.
Тиотропия бромид после в/в введения в основном выводится почками в неизмененном виде (74%). Общий клиренс после в/в введения тиотропия бромида молодым здоровым добровольцам составляет 880 мл/мин.
После ингаляции раствора у пациентов с ХОБЛ почечная экскреция составляет 18,6% (0,93 мкг), оставшаяся неабсорбировавшаяся часть выводится через кишечник. Почечный клиренс тиотропия бромида превышает клиренс креатинина, что свидетельствует о его канальцевой секреции. Терминальный T1/2 тиотропия бромида после ингаляции составляет от 27 до 45 ч.
Фармакокинетика у пациентов пожилого возраста. Клинические исследования показали: несмотря на влияние возраста, пола и массы тела на системное воздействие олодатерола коррекции дозы не требуется.
В пожилом возрасте отмечается снижение почечного клиренса тиотропия (347 мл/мин у пациентов с ХОБЛ в возрасте до 65 лет и 275 мл/мин у пациентов с ХОБЛ старше 65 лет). Однако это не приводило к увеличению значения AUC0–6,ss и Сmax,ss.
Раса. Сравнение фармакокинетических данных, полученных в клинических исследованиях олодатерола, выявило тенденцию к более высокому системному воздействию олодатерола у пациентов из Японии и других пациентов азиатской расы по сравнению с пациентами европеоидной расы. В клинических исследованиях олодатерола, применявшегося в дозах, которые превышали рекомендуемую терапевтическую дозу в два раза, у пациентов европеоидной и азиатской расы каких-либо опасений в отношении безопасности установлено не было.
Пациенты с нарушением функции почек. У пациентов с почечной недостаточностью тяжелой степени (Cl креатинина <30 мл/мин) системное воздействие олодатерола увеличивалось в среднем в 1,4 раза. Такое повышение воздействия не вызывает опасений в отношении безопасности, учитывая опыт, полученный в ходе применения олодатерола в клинических исследованиях.
После ингаляционного применения тиотропия один раз в день в период устойчивого состояния фармакокинетики у пациентов с ХОБЛ и почечной недостаточностью легкой степени тяжести (Cl креатинина 50–80 мл/мин) отмечалось небольшое увеличение величин AUC0–6,ss на 1,8–30 % и Cmax,ss по сравнению с пациентами с нормальной функцией почек (Cl креатинина >80 мл/мин). У пациентов с ХОБЛ и почечной недостаточностью средней и тяжелой степени тяжести (Cl креатинина <50 мл/мин) в/в применение тиотропия бромида приводило к двукратному увеличению общего воздействия тиотропия бромида (значение AUC0–4 увеличивалось на 82%, а величина Cmax увеличилась на 52%) по сравнению с пациентами с нормальной функцией почек. Аналогичное повышение концентрации в плазме отмечалось и после ингаляции сухого порошка.
Пациенты с нарушением функции печени. У пациентов с печеночной недостаточностью легкой и средней степени тяжести системное воздействие олодатерола не изменялось. Системное воздействие олодатерола у пациентов с печеночной недостаточностью тяжелой степени не изучалось.
Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокинетику тиотропия бромида, так как тиотропия бромид преимущественно выводится почками и с помощью неферментативного расщепления эфирной связи с образованием производных, которые не обладают фармакологической активностью.
Спиолто респимат — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП 003164 — 180416
Торговое название:
Спиолто респимат
Международное непатентованное или групппровочное наименование:
олодатерол + тиотропия бромид
Лекарственная форма:
раствор для ингаляций дозированный
Состав:
Одна ингаляционная доза содержит:
Активное вещество: олодатерол — 0,0025 мг (соответственно олодатерола гидрохлорид 0,002736 мг) и тиотропий 0,0025 мг (соответственно тиотропия бромида моногидрат 0,003124 мг)
Вспомогательные вещества: бензалкония хлорида раствор 0.002200 мг (соответственно бензалкония хлорида 0,001100 мг). динатрия эдетат 0,001100 мг. хлористоводородная кислота 1М до рН 2.9. вода очищенная до 11,05 мг.
Описание
Прозрачный, бесцветный раствор.
Фармакотерапевтическая группа:
Бронхолитическое средство комбинированное ( бета2-адреномиметик длительного действия + м — холиноблокатор)
Код ATX: R03AL06
Фармакологические свойства
Олодатерол — бета2-адреномиметик длительного действия и тиотропия бромид- м-холиноблокатор обеспечивают взаимодополняющую бронходилатацию. в результате различного механизма действия активных веществ и различной локализации целевых рецепторов в легких. Олодатерол обладает высоким сродством и селективностью к бета2-адренорецепторам. Активация бета2-адренррецепторов в дыхательных путях приводит к стимуляции внутриклеточной аденилатниклазы. которая участвует в синтезе циклического 3.5-аденозиимонофосфата (цАМФ). Повышение уровня цАМФ вызывает бронходилатацию. расслабляя гладкомышечиые клетки дыхательных путей. Олодатерол является селективным агонистом бета2-адренорецепторов длительного действия с быстрым началом действия и длительным (не менее 24 ч) сохранением эффекта.
Бета2-адренорецепторы присутствуют не только в гладкомышечных клетках, но и во многих других клетках, в том числе в эпителиальных и эндотелиальных клетках легких и сердца. Точная функция бета2-рецепторов в сердце до конца не изучена, но их присутствие указывает на возможность влияний на сердце даже высокоселективных бета2-адренергических агонистов.
Тиотропия бромид — антагонист мускариновых рецепторов длительного действия, в клинической практике часто называемый м-холпноблокнрующнм средством. Препарат обладает одинаковым сродством к Ml — М5 подтипам мускариновых рецепторов. Результатом индуцирования МЗ-рецепторов вдыхательных путях является расслабление гладкой мускулатуры.
Бронходилатирующий эффект зависит от дозы и сохраняется в течение не менее 24 часов. Значительная продолжительность действия связана, вероятно, с очень медленной диссоциацией препарата от МЗ-рецепторов; период полудиссоциации существенно более длительный, чем у ипратропия бромида. При ингаляционном способе введения тиотропия бромид, как N-четвертичное производное аммония, оказывает местный избирательный эффект (на бронхи), при этом в терапевтических дозах не вызывая системных м-холииоблокирующих побочных эффектов.
Диссоциация от М2-рецепторов происходит быстрее, чем от МЗ-рецепторов, что свидетельствует о преобладании селективности в отношении МЗ подтипа рецепторов над М2-рецепторами.
Высокое сродство к рецепторам и медленная диссоциация препарата из связи с рецепторами обусловливают выраженный и продолжительный бронходилатирующий эффект у пациентов с хронической обструктивной болезнью легких (ХОБЛ).
Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена, в первую очередь, местным (на дыхательные пути), а не системным действием.
В ходе клинических исследований установлено, что препарат СПИОЛТО РЕСПИМАТ, применявшийся одни раз в день, утром приводил к быстрому (в течение 5 минут после первой дозы) улучшению функции легких. Эффект препарата СПИОЛТО РЕСПИМАТ превосходил эффект тиотропия бромида в дозе 5 мкг и олодатерола в дозе 5 мкг, применявшихся в качестве монотерапии (объем форсированного выдоха за 1-ую секунду (ОФВ1) увеличивался при приеме СПИОЛТО РЕСПИМАТ на 0.137 л: при приеме тиотропия бромида на 0.058 л; при приеме олодатерола — на 0.125 л.
При применении препарата СПИОЛТО РЕСПИМАТ по сравнению с применением тиотропия бромида и олодатерола в качестве монотерапии достигался более значительный бронходилатирующий эффект, а также увеличивалась пиковая объемная скорость выдоха в утренние и вечерние часы.
Применение препарата СПИОЛТО РЕСПИМАТ приводило к снижению риска обострений ХОБЛ по сравнению с плацебо.
Препарат СПИОЛТО РЕСПИМАТ значительно улучшал ёмкость вдоха по сравнению с тиотропия бромидом, олодатеролом или плацебо, применявшимися в виде монотерапии.
СПИОЛТО РЕСПИМАТ по сравнению с плацебо значительно улучшал время переносимости физической нагрузки.
Фармакокинетика
Фармакокинетика комбинированною препарата СПИОЛТО РЕСПИМАТ жвивалентна фармакокипетике отдельно применяемым олодатеролу и тиотроппя бромиду. Олодатеролу и тиотропия бромиду свойственна линейная фармакокинетика. Устойчивое состояние фармакокинетики олодатерола достигалось через 8 дней при применении одни раз в день, а степень воздействия увеличивалась по сравнению с применением однократной дозы в 1.8 раза. Устойчивое состояние фармакокинетики тиотроппя бромида при применении один раз в день достигалось через 7 дней.
Всасывание
Олодатерол быстро всасывается, после ингаляции препарата максимальная концентрация в плазме обычно достигается в течение 10-20 минут. У здоровых добровольцев после ингаляции препарата абсолютная биодоступность олодатерола составляла около 30 %. тогда как абсолютная биодоступность олодатерола после приема препарата внутрь в виде раствора была ниже 1%. Таким образом, системное воздействие олодатерола после ингаляционного применения в основном реализуется путем всасывания в легких, а вклад проглатываемой части дозы в системное воздействие незначителен.
После ингаляции раствора тиотроппя бромида в системный кровоток поступает около 33 % от величины ингаляционной дозы. Абсолютная бнодоступность при приеме внутрь составляет 2 -3 %. Максимальная концентрация в плазме наблюдается через 5-7 минут после ингаляции.
Распределение
Связывание олодатерола с белками плазмы составляет примерно 60 %. а объем распределения -1110 л.
Связывание тиотропия бромида с белками плазмы составляет 72%: объем распределения -32 л/кг. Доклинические исследования показали, что тиотроппя бромид не проникает через гематоэнцефалпческий барьер.
Биотрансформация
Олодатерол в значительной степени метаболизируется путем непосредственной глюкуронизации и О-деметилирования с последующей конъюгацией. Из шести идентифицированных метаболитов с бета2-рецепторами связывается только одно некоиъюгированное деметилированное производное (SOM 1522). однако, этот метаболит не обнаруживается в плазме после длительного ингаляционного применения препарата в рекомендуемой терапевтической дозе или в дозах, превышающих терапевтическую в 4 раза. В О-деметилировании олодатерола участвует цитохром Р450 (изоферментов CYP2C9 . CYP2C8 и в незначительной степени CYP3A4). В образовании глюкуронидов олодатерола участвуют изоформы уридпндифоефатглнкозил трансферазы. UGT2B7, UGT1A1, 1А7 и 1А9.
Степень биотрансформации тиотропия бромида незначительна. Это подтверждается тем, что после внутривенного введения тиотропия бромида молодым здоровым добровольцам 74 % тиотропия бромида выводится почками в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-М-метилскопин и дитиенилгликолиевую кислоту; эти соединения не связываются с мускариновыми рецепторами.
В исследованиях in vitro показано, что некоторая часть препарата (< 20 % от дозы после внутривенного введения) метаболизируется путем окисления цитохромом Р450 (CYP2D6 и ЗЛ4) с последующей конъюгацией с глутатпоном и образованием различных метаболитов.
Выведение
Общий клиренс олодатерола у здоровых добровольцев составляет 872 мл/мин. а почечный клиренс 173 мл/мин. Конечный период полувыведения после внутривенного применения олодатсрола составляет 22 ч. тогда как конечный период полувыведения после ингаляционного применения — примерно 45 ч. Из этого следует, что в последнем случае выведение в большей степени зависит от всасывания.
Общая меченная изотопом доза олодатсрола. выделявшаяся через почки (включая исходное соединение и все метаболиты) составляла после внутривенного введения 38 %. после приема внутрь 9%. Общая меченная изотопом доза, выделявшаяся через ночки неизмененного олодатсрола составляла, после внутривенного введения 19 % . Общая меченная изотопом доза, выделявшаяся через кишечник, составляла после внутривенного введения 53% и 84 % после приема внутрь.
Более 90 % дозы препарата выводилось после внутривенного введения в течение 5 дней и после приема внутрь в течение 6 дней. 11осле ингаляционного применения препарата экскреция неизмененного олодатерола почками на протяжении интервала дозирования составляла у здоровых добровольцев в период устойчивого состояния фармакокпнетики 5-7% от величины дозы.
Тиотропия бромид после внутривенного введения в основном выводится почками в неизмененном виде (74 %). Общий клиренс после внутривенного введения тиотропия бромида молодым здоровым добровольцам составляет 880 мл/мин. После ингаляции раствора у пациентов с ХОБЛ почечная экскреция составляет 18.6% (0.93 мкг). оставшаяся неабсорбировавшаяся часть выводится через кишечник. Почечный клиренс тиотропия бромида превышает клиренс креатинина. что свидетельствует о его каиальцевой секреции. Терминальный период полувыведепия тиотропия бромида после ингаляции составляет от 27 до 45 ч.
Фармакокинетика у пациентов пожилого возраста
Клинические исследования показали: несмотря на влияние возраста, пола и массы тела на системное воздействие олодатерола коррекции дозы не требуется.
В пожилом возрасте отмечается снижение почечного клиренса тиотропия (347 мл/мин у пациентов с ХОБЛ в возрасте до 65 лет и 275 мл/мин у пациентов с ХОБЛ старше 65 лет). Однако это не приводило к увеличению значения AUCo-6,ss и Cmах.ss.
Раса
Сравнение фармакокинетнческнх данных, полученных в клинических исследованиях олодатерола. выявило тенденцию к более высокому системному воздействию олодатерола у пациентов из Японии и других пациентов азиатской расы по сравнению с пациентами евро! еоидной расы. В клинических исследованиях олодатерола. применявшегося в дозах, которые превышали рекомендуемую терапевтическую дозу в два раза, у пациентов европеоидной и азиатской расы каких-либо опасений в отношении безопасности установлено не было.
Пациенты с нарушениями функции почек
У пациентов с почечной недостаточностью тяжелой степени тяжести (клиренс креатинина (КК) <30 мл/мин) системное воздействие олодатерола увеличивалось в среднем в 1.4 раза. Такое повышение воздействия не вызывает опасений в отношении безопасности, учитывая опыт, полученный входе применения олодатерола в клинических исследованиях.
После ингаляционного применения тиотропия один раз в день в период устойчивого состояния фармакокпнетики у пациентов с ХОБЛ и почечной недостаточностью легкой степени тяжести (клиренс креатинина 50-80 мл/мин) отмечалось небольшое увеличение величин AUC0-6.ss на 1.8-30% и Cmax.ss по сравнению с пациентами с нормальной функцией почек (клиренс креатинина >80 мл/мин). У пациентов с ХОБЛ п почечной недостаточностью средней и тяжелой степени тяжести (клиренс креатинина <50 мл/мин) внутривенное применение тиотропия бромида приводило к двукратному увеличению общего воздействия тиотропия бромида (значение AUC0-4 увеличивалась на 82% , а величина Стах увеличилась на 52 %) по сравнению с пациентами с нормальной функцией почек. Аналогичное повышение концентрации в плазме отмечалось и после ингаляции сухого порошка.
Пациенты с нарушениями функции печени
У пациентов с печеночной недостаточностью легкой и средней степени тяжести системное воздействие олодатерола не изменялось. Системное воздействие олодатерола у пациентов с печеночной недостаточностью тяжелой степени тяжести не изучалось.
Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокииетику тиотропия бромида, так как тиотропия бромид преимущественно выводится почками и с помощью неферментативного растепления эфирной связи с образованием производных, которые не обладают фармакологической активностью.
Показания
Препарат СПИОЛТО РЕСПИМАТ, принимаемый один раз в сутки, показан для длительной поддерживаюшей терапии пациентам с хронической обструктивной болезнью легких (ХОБЛ), хроническим бронхитом, эмфиземой легких, для уменьшения обструкции дыхательных путей и сопутствующей одышки; уменьшения частоты обострений; улучшения переносимости физических нагрузок и качества жизни.
Противопоказания
Препарат СПИОЛТО РЕСПИМАТ противопоказан пациентам с гиперчувствительностью к олодатеролу, тиотропия бромиду или к любому компоненту препарата.
Препарат СПИОЛТО РЕСПИМАТ противопоказан пациентам у которых ранее отмечалась гиперчувствительность к атропину или его производным, например ипратропию и окситропию.
Препарат СПИОЛТО РЕСПИМАТ не рекомендуется к применению у детей до 18 лет (ввиду отсутствия данных по эффективности и безопасности).
С осторожностью
У пациентов с остроугольной глаукомой, гиперплазией предстательной железы и обструкцией шейки мочевого пузыря.
У пациентов с сердечно-сосудистыми заболеваниями, в.т.ч. коронарной недостаточностью, нарушениями сердечного ритма, удлинением интервала QT, гипертрофической обструктивной кардпомиопатией. артериальной гипертензией, тиреотоксикозом, судорогами. У пациентов в анамнезе которых отмечались такие заболевания как: инфаркт миокарда или госпитализация по поводку сердечной недостаточности (в течение предшествующего года), жизнеугрожающая аритмия, пароксизмальная тахикардия с ЧСС> 100.
У пациентов с необычными реакциями на симпатомиметические амины.
Беременность и кормление грудью
Клинических данных о влиянии ододагерола/тпотроппя бромида па беременность нет. В доклинических исследованиях при использовании высоких доз олодатерола. в несколько раз превышавших терапевтические дозы, установлены влияния типичные для [32-адреноми.метиков. Следует учитывать ингибирующее влияние олодатерола на сократительную способность матки. Препарат СПИОЛТО РЕСПИМАТ не должен применяться у беременных женщин, если только потенциальная польза для матери не превышает потенциальный риск для плода.
Клинических данных о применении олодатерола/тиотропия бромида у женщин, кормящих грудью, нет. Препарат СПИОЛТО РЕСПИМАТ не должен применяться у кормящих грудью женщин, если только потенциальная польза для матери не превышает потенциальный риск для ребенка.
На период применения препарата необходимо прекратить кормление грудью ребенка
Способ применения и дозы
Рекомендуемая терапевтическая доза составляет две ингаляции спрея из ингалятора РЕСПИМАТ (5 мкг/терапевтическая доза тиотропия бромида и 5 мкг/терапевтическая доза олодатерола) один раз в день, в одно и то же время суток (см.Инструкцию по применению). У пожилых пациентов можно использовать препарат СПИОЛТО РЕСПИМАТ в рекомендуемой дозе. У пациентов с печеночной недостаточностью легкой и средней степени тяжести можно использовать СПИОЛТО РЕСПИМАТ в рекомендуемой дозе. Данных о применении олодатерола у пациентов с печеночной недостаточностью тяжелой степени тяжести не имеется.
У пациентов с нарушениями функции почек можно использовать препарат СПИОЛТО РЕСПИМАТ в рекомендуемой дозе.
Пациенты с почечной недостаточностью средней и тяжелой степени тяжести, применяющие препарат СПИОЛТО РЕСПИМАТ, должны находиться под тщательным наблюдением врача.
Инструкция по применению
Введение
Прочитайте эти инструкции по применению перед началом использования СПИОЛТО РЕСПИМАТ
Вам нужно будет использовать этот ингалятор только ОДИН РАЗ В ДЕНЬ. Каждый раз при его применении ДЕЛАЙТЕ ДВЕ ИНГАЛЯЦИИ
Как ухаживать за ингалятором СПИОЛТО РЕСПИМАТ
Очищайте мундштук, включая металлическую часть мундштука, влажной тряпочкой или тканью, по меньшей мере, один раз в неделю. Любое незначительное изменение цвета мундштука не влияет на работу Вашего ингалятора СПИОЛТО РЕСПИМАТ.
Как определить, когда нужен новый ингалятор СПИОЛТО РЕСПИМАТ
Ингалятор СПИОЛТО РЕСПИМАТ содержит 60 ингаляционных доз (т.е. 30 терапевтических доз) при условии применения в соответствии с указаниями (две ингаляционные дозы один раз в день). Индикатор доз показывает, сколько примерно доз еще осталось.
• Когда индикатор доз покажет на красную область шкалы, это означает, что лекарства осталось примерно на 7 дней (14 ингаляционных доз).
• Когда индикатор доз ингалятора достигнет конца красной шкалы, это означает, что ингалятор СПИОЛТО РЕСПИМАТ пуст, и он автоматически заблокируется (поворот прозрачной гильзы будет невозможен).
• Через три месяца после первого использования СПИОЛТО РЕСПИМАТ следует выбросить, даже если он полностью не использован.
Подготовка к первому использованию
1. Снимите прозрачную гильзу
• Держите колпачок закрытым.
• Нажмите стопорную кнопку и сильно потяните при этом другой рукой за прозрачную гильзу.
2. Вставьте картридж
• Вставьте картридж узким концом в ингалятор.
• Поставьте ингалятор дном картриджа на твердую поверхность и сильно нажмите на него, пока картридж не встанет на место со щелчком.
3. Установите на место прозрачную гильзу
• Установите прозрачную гильзу на место до щелчка.
4. Поверните гильзу
• Держите колпачок закрытым.
• Поверните прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (полоборота).

5. Откройте колпачок
• Откройте колпачок до упора.
6. Нажмите на кнопку
• Направьте ингалятор вниз.
• Нажмите кнопку подачи дозы.
• Закройте колпачок.
• Повторите шаги 4-6 до появления облачка аэрозоля
• Затем повторите шаги 4-6 еще три раза
Ежедневное применение

Поверните
• Держите колпачок закрытым.
• Поверните прозрачную гильзу в направлении, указанном стрелками на этикетке, до щелчка (пол-оборота).
Откройте колпачок
• Откройте колпачок до упора.
Нажмите на кнопку
• Сделайте медленный полный выдох.
• Обхватите мундштук губами, не перекрывая воздухозаборники.
• Делая медленный, глубокий вдох через рот, нажмите кнопку подачи дозы и продолжайте делать вдох.
• Задержите дыхание примерно на 10 секунд.
• Для получения второй ингаляционной дозы повторите операции: Поверните, Откройте, Нажмите.
Побочное действие
Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований препарата СПИОЛТО РЕСПИМАТ
Инфекции и инвазии
Назофарингит;
Нарушения со стороны обмена веществ и питании
Дегидратация:
Нарушения со стороны нервной системы
головокружение, бессоница:
Нарушения со стороны органа зрения
повышение внутриглазного давления, глаукома: нечеткое зрение;
Нарушения со стороны сердечно-сосудистой системы
мерцательная аритмия, ощущение сердцебиения, тахикардия, суправентрикулярная тахикардия, повышение артериального давления;
Нарушения со стороны органов дыхания, органов грудной клетки и средостения
кашель, носовое кровотечение, фарингит, дисфония, бронхоспазм, ларингит, синусит:
Нарушения со стороны желудочно-кишечного тракта
незначительная сухость во рту, запор, кандидоз полости рта, дисфагия, гастроэзофагеальный рефлюкс. гингивит, глоссит, стоматит: кишечная непроходимость, включая паралитическую кишечную непроходимость:
Нарушения со стороны кожных покровов кожные инфекции и язвы на коже, сухость кожи
Аллергические реакции
сыпь, зуд, ангноневротическнп отек, крапивница, гиперчувствительность включая реакции немедленного типа:
Костно-мышечная система и связанные с ней заболевания соединительной ткани артралгия, припухлость в области суставов, боль в спине*
Hapyшения со стороны почек и мочевыделительной системы:
дизурия, задержка мочи (чаше у мужчин с наличием предрасполагающих факторов), инфекция мочены водящих путей.
* нежелательный эффект, относящейся к препарату СПИОЛТО РЕСПИМАТ, а не к его компонентам
Многие из перечисленных нежелательных эффектов относятся к антихолинергичеекпм свойствам гиотрония бромида или к Р-адреномиметпческим свойствам олодатсрола. Поэтому следует принимать во внимание возможность возникновения нежелательных эффектов, характерных для всего класса (3-адрепомиметпков. таких как: аритмия, ишемия миокарда, стенокардия, гипотепзия. тремор, головная боль, нервозность, тошнота, мышечные спазмы, усталость, недомогание, гипокалиемия. гпиергликемпя и метаболический ацидоз.
Передозировка
Симптомы
Передозировка олодатерола может привести к выраженным эффектам, типичным для бета2-адреномиметиков, например, к ишемии миокарда, повышению или снижению артериального давления, тахикардии, аритмиям, ощущению сердцебиения, головокружению, нервозности, бессоннице, беспокойству, головной боли, тремору, сухости во рту, спазму мышц, тошноте, усталости, недомоганию, гпиокалиемии. гипергликемии и метаболическому ацидозу.
При фименении высоких доз пютропия бромида возможны проявления м-холиноблокирующего спс вия. После 14-дневного ингаляционного применения пютропия бромида в дозах, достигавших 40 мкг. у здоровых лиц не наблюдалось значимых неблагоприятных явлении, кроме чувства сухости слизистых оболочек носа и ротоглотки, частота которых зависела от величины дозы (10-40 мкг в день). Исключение составляло отчетливое снижение саливации, начиная с 7 дня применения препарата.
Лечение
Прием препарата СПИОЛТО РЕСПИМАТА должен быть прекращен. Показано поддерживающее и симптоматическое лечение. В тяжелых случаях необходима госпитализация. Может рекомендоваться применение бета1-адреноблокаторов. но только при соблюдении особой осторожности, так как использование этих препаратов может вызвать бронхосиазм.
Взаимодействие с другими лекарственными средствами
Хотя специальных исследовании лекарственных взаимодействий не проводилось, тиотропия бромид применялся совместно с другими препаратами, для лечения ХОБЛ, включая метилксантины, стероиды для приема внутрь и ингаляционного применения, при этом клиш ческих признаков лекарственных взаимодействий не отмечалось.
Длительное совместное применение тиотропия бромида с другими м-холиноблокирующими препаратами не изучалось. Поэтому долгосрочное совместное применение препарата СПИОЛТО РЕСПИМАТ с другими м-холиноблокирующими препаратами не рекомендуется.
Одновременное применение других адренергичееких препаратов может усиливать нежелательные эффекты препарата СПИОЛТО РЕСПИМАТ.
Одновременное применение ксантиновых производных, стероидов или диуретиков (не относящихся к группе калийсберегающих) может усиливать гипокалиемичеекий эффект адреиомиметиков.
Бета-адреноблокаторы могут ослаблять эффект олодатерола или противодействовать этому эффекту. В этом случае предпочтительно применение бета1-адрепоблокаторов, хотя и они должны применяться с осторожностью.
Ингибиторы моноаминооксидазы, трициклическне антидепрессанты или другие препараты, способные удлинять интервал QTc, могут усиливать действие СПИОЛТО PЕСПИМАТА на сердечно-сосудистую систему.
Совместное применение олодатерола с кетоконазолом приводило к увеличению системного воздействия олодатерола в 1.7 раза. Однако это не влияло на безопасность. Изменения дозы не требуется.
Особые указания
Препарат СПИОЛТО РЕСПИМАТ не должен использоваться при бронхиальной астме. Эффективность и безопасность препарата СПИОЛТО РЕСПИМАТ при бронхиальной астме не изучались
Острый бронхоспазм
Препарат СПИОЛТО PECПИМАТ не показан для лечения острых эпизодов бронхоспазма, то есть в качестве средства скорой помощи.
Гиперчувствительность
После применения препарата СПИОЛТО РЕСПИМАТ возможно развитие реакций гиперчувствительности немедленного типа.
Парадоксальный бропхоспазм
Применение препарата СПИОЛТО PEСПИМАТ, как и других ингаляционных лекарственных средств, может привести к парадоксальному бронхоспазму. иногда угрожающему жизни. В случае развития парадоксального ороихоспазма применение препарата СПИОЛТО РЕСПИМАТ должно быть немедленно прекращено и назначена альтернативная терапия.
Пациенты с нарушениями функции почек
Так как тиотропия бромид выводится преимущественно ночками, пациенты с почечной недостаточностью средней и тяжелой степени тяжести (клиренс креатинина < 50 мл/мин) применяющие препарат СПИОЛТО РЕСПИМАТ, должны находиться под тщательным наблюдением врача.
Нарушения со стороны органа зрения
Пациенты должны быть ознакомлены о правильном применении препарата СПИОЛТО РЕСПИМАТ. Не следует допускать попадания раствора или аэрозоля в глаза. Боль или дискомфорт в глазах, нечеткое зрение, зрительные ореолы вокруг источников света в сочетании с покраснением глаз, вызванным отеком конъюнктивы и роговицы могут быть симптомами острой закрытоугольной глаукомы. При развитии любой комбинации этих симптомов следует немедленно обратиться к специалисту. Глазные капли, обладающие миотическим действием, не считаются эффективным лечением.
Сердечно-сосудистые эффекты
Олодатерол, как и другие бета2-адреномиметики, может оказывать клинически существенное влияние на сердечно-сосудистую систему у некоторых пациентов (учащение пульса, повышение артериального давления и/или появление соответствующих симптомов). В случае возникновения таких симптомов может потребоваться прекращение лечения. Кроме того, сообщалось, что бета2— адреномиметики приводили к таким изменениям электрокардиограммы (ЭКГ), как уплощение зубца Т и депрессия сегмента ST. хотя клиническое значение этих изменений неизвестно.
Гипокалиемия
Бета2-адреномиметики у некоторых пациентов могут приводить к развитию гипокалиемии, создающей предпосылки для возникновения нежелательных влиянии на сердечно-сосудистую систему. Снижение концентрации калия в сыворотке крови обычно кратковременно и не требует его восполнения. У пациентов с тяжелой ХОБЛ ппюкалиемня может усиливаться из-за гипоксии и сопутствующего лечения и увеличивать риск развития аритмии.
Гипергликемия
Ингаляционное применение больших доз бета2-адреномиметиков может привести к увеличению концентрации глюкозы в плазме крови. Препарат СПИОЛТО РЕСПИМАТ не следует применять в комбинации с каким-либо другим лекарственным препаратом, содержащим бета2-адреномиметики длительного действия.
Пациентов. часто применяющих ингаляционные бета2-адреномиметики короткого действият (например, четыре раза в день), необходимо проинструктировать о том, что эти препараты используются только для облегчения острых симптомов бронхоспазма.
Препарат СПИОЛТО РЕСПИМАТ предназначен для поддерживающего лечения больных ХОБЛ. В связи с тем обстоятельством, что в общей популяции ХОБЛ существенно преобладают больные в возрасте старше 40 лет. при назначении препарата пациентам моложе 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ
Влияние препарата на способность управлять транспортными средствами и механизмами
Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились. Следует соблюдать осторожность при выполнении данных видов деяте; ыюсти. так как возможно развитие головокружения или нечеткости зрения.
Форма выпуска
Раствор для ингаляций дозированный 2.5 мкг + 2.5 мкг/доза
Ингалятор Респимат® в комплекте с картриджем вместимостью 4.5 мл. помешенным в алюминиевый цилиндр. Ингалятор и цилиндр с картриджем с инструкцией по применению в пачку картонную.
Условия хранения
При температуре не выше 25 °С. Хранить в недоступном для детей месте!
Срок одности
3 года
Использовать в течение 3 месяцев после первой ингаляции.
Нe использовать после истечения срока годности, укачанного на упаковке.
Условия отпуска из аптек
По рецепту врача.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Берингер Ингельханм Интернешнл ГмбХ
Бингер Штрассе 173, 55216 Ингельхайм-на-Рейне. Германия
Наименование и адрес места осуществления производства лекарственного препарата
Берингер Ингельханм Фарма ГмбХ и Ко.КГ
Бингер Штрассе 173. 55216 Ингельхайм-на-Реине. Германия
Получить дополнительную информацию о препарате, а также направить свои претензии и информацию о нежелательных явлениях можно по следующему адресу в России
ООО «Берппгер Ингельханм»
125171, Москва, Ленинградское шоссе, 16А стр.3
Купить Спиолто респимат в Планета Здоровья
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Стриверди® Респимат®
МНН: Олодатерол
Производитель: Берингер Ингельхайм Фарма ГмбХ и Ко. КГ
Анатомо-терапевтическо-химическая классификация: Селективные бета-2-адреномиметики
Номер регистрации в РК:
№ РК-ЛС-5№121771
Информация о регистрации в РК:
05.11.2015 — 05.11.2020
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
13 257.97 KZT
- Скачать инструкцию медикамента
Торговое название
СТРИВЕРДИ РЕСПИМАТ
Международное непатентованное название
Олодатерол
Лекарственная форма
Раствор для ингаляций 2,5 мкг в комплекте с ингалятором РЕСПИМАТ
Состав
1 ингаляция содержит
активное вещество – олодатерола гидрохлорид 0,0027 мг (эквивалентно 0,0025 мг олодатерола),
вспомогательные вещества: бензалкония хлорид (50% раствор), динатрия эдетат, кислота лимонная безводная, вода очищенная.
Описание
Картридж объёмом 4.5 мл содержит прозрачную, бесцветную или слегка желтоватую жидкость, помещен в алюминиевый цилиндр для системы РЕСПИМАТ, с защитой от вскрытия в верхней части и отверстием на дне цилиндра.
Фармакотерапевтическая группа
Препараты для лечения обструктивных заболеваний дыхательных путей. Симпатомиметики ингаляционные. Бета2-адреностимуляторы селективные. Олодатерол.
Код АТХ R03AC19
Фармакологическое действие
Фармакокинетика
Фармакокинетика олодатерола была изучена на здоровых субъектах, а также на пациентах с ХОБЛ и астмой после ингаляции терапевтической и повышенной дозы препарата.
Фармакокинетика олодатерола после ингаляции раствора в терапевтическом диапазоне доз характеризуется линейностью, после однократных ингаляционных доз от 5 до 70 микрограмм и многократных доз от 2 до 20 микрограмм в день.
При повторной ингаляции один раз в день, постоянная концентрация олодатерола в плазме достигается через 8 дней, а степень воздействия увеличивается в 1,8 раза по сравнению с однократной дозой.
Абсорбция. Максимальная концентрация олодатерола в плазме обычно достигается в период между 10 и 20 минутами после ингаляции. Системная доступность олодатерола после ингаляции обусловлена преимущественно всасыванием через легкие.
Распределение. Объем распределения высокий и составляет 1110 л, что свидетельствует об обширном распределении в тканях. Связывание in vitro [14C] олодатерола с белком плазмы человека не зависит от концентрации и составляет приблизительно 60 %.
Олодатерол является субстратом для переносчиков P-гликопротеина, OAT1, OAT3 и OCT1 и не является субстратом для переносчиков BCRP, MRP, OATP2, OATP8, OATP-B, OCT2 и OCT3.
Биотрансформация. Олодатерол в основном метаболизируется путем прямого глюкуронирования и О-деметилирования в метоксильные группы после конъюгации. Из шести распознанных метаболитов, только неконъюгированные продукты демитилирования связываются с бета2-рецепторами. Однако этот метаболит не распознается в плазме после постоянных ингаляций рекомендованной терапевтической дозы или доз, превышающих ее в 4 раза.
Изоферменты CYP2C9 и CYP2C8 (а также CYP3A4 с незначительным воздействием) цитохрома P450 участвуют в процессе О-диметилирования олодатерола, а изоформы UGT2B7, UGT1A1, 1A7 и 1A9 уридиндифосфат-гликозилтрансферазы участвуют в процессе формирования глюкуронидов олодатерола.
Выведение. Общий клиренс олодатерола у здоровых добровольцев составляет 872 мл/мин, почечный клиренс — 173 мл/мин.
После внутривенного введения [14C]-меченого олодатерола 38 % дозы выводится с мочой и 53 % с калом. Объем неизмененного олодатерола в моче после внутривенного введения составляет 19 %. После перорального введения с мочой выводится только 9 % дозы (0,7 % неизмененного олодатерола), а большая часть с калом — (84 %). После внутривенного и перорального введения более 90 % дозы выделяется в течение 6 и 5 дней, соответственно. Концентрация олодатерола в плазме после ингаляции поэтапно снижалась, а конечный период полувыведения составил приблизительно 45 часов.
Особые группы пациентов.
Корректировки дозы препарата в зависимости от возраста, пола и веса у пациентов с ХОБЛ не требуется.
Пациенты с нарушениями функции почек. Клинически значимого увеличения системного воздействия у пациентов с почечной недостаточностью не наблюдалось.
Пациенты с нарушениями функции печени. Не было получено доказательств различий в фармакокинетике между пациентами с легкой или умеренной печеночной недостаточностью и здоровыми добровольцами. Исследований у пациентов с острой печеночной недостаточностью не проводилось.
Раса. При сравнении фармакокинетических данных каждого исследования была выявлена тенденция к более сильному системному воздействию у азиатов по сравнению с европейцами. Профиль безопасности при применении препарата СТРИВЕРДИ РЕСПИМАТ в дозе, достигающей двух рекомендованных терапевтических доз, сохранялся в течение одного года.
Фармакодинамика
Механизм действия
Олодатерол обладает высокой аффинностью и высоким уровнем селективности к бета2‑адренорецепторам человека. Исследования in vitro показали, что олодатерол обладает более сильным действием агонистов на бета2-адренорецепторы по сравнению с бета1‑адренорецепторами, а также более сильным действием агонистов по сравнению с бета3-адренорецепторами.
Фармакологический эффект наблюдается за счет связывания и активации бета2-адренорецепторов после местного введения путем ингаляции.
Активация данных рецепторов в дыхательных путях приводит к стимуляции внутриклеточной аденилциклазы — фермента, который обеспечивает синтез циклических-3’,5’ аденозинмонофосфатов (цАМФ). Повышенный уровень цАМФ приводит к расширению бронхов за счет расслабления клеток гладкой мускулатуры.
Доклинические исследования показали, что олодатерол является селективным агонистом бета2‑адренорецепторов длительного действия (ДДБА), с быстрым началом действия и длительностью в течение 24 часов.
Бета2-агонинсты расширяют бронхи. Бета2-адренорецепторы находятся преимущественно в гладкой мускулатуре дыхательных путей, они также встречаются на поверхности различных клеток других видов, в том числе в клетках эпителия и эндотелия, а также в сердце. Точная функция бета2-адренорецепторов в сердце неизвестна.
Воздействие на кардиоэлектрофизиологию
Воздействие олодатерола на интервал QT/QTc на ЭКГ оценивалось в рамках двойного слепого, рандомизированного исследования, контролируемого плацебо и активным препаратом (моксифлоксацин), в котором приняли участие здоровые добровольцы мужского и женского пола. Исследования применения однократной дозы олодатерола (10, 20, 30 и 50 мкг) по сравнению с плацебо показали, что среднее изменение интервала QT от начального значения через промежуток времени от 20 минут до 2 часов после получения дозы увеличилось в зависимости от дозы с 1,6 мс (10 мкг олодатерола) до 6,5 мс (50 мкг олодатерола). При этом верхняя граница двухсторонних 90 %-ных доверительных интервалов составила менее 10 мс для всех уровней дозы, в случаях индивидуально корригированных интервалов QT (QTcI).
Воздействие дозы 5 мкг и 10 мкм препарата СТРИВЕРДИ РЕСПИМАТ на частоту сердцебиения и сердечный ритм оценивалось на основании результатов суточного ЭКГ (холтеровское мониторирование) в подгруппе из пациентов в рамках 48-недельных, плацебо-контролируемых исследований, фаза 3. Тренды, связанные с дозой или временем, величина среднего изменения частоты сердцебиения или экстрасистолии отсутствовали. Смещение величины экстрасистолии от начального значения к концу лечения не указывает на значительные различия между олодатеролом в дозе 5 мкг, 10 мкг и плацебо.
Показания к применению
-
поддерживающая бронхолитическая терапия пациентов с хронической обструктивной болезнью легких (ХОБЛ)
Способ применения и дозы
Препарат предназначен только для ингаляций. Картридж нужно вставлять и использовать только с ингалятором РЕСПИМАТ.
Две ингаляции препарата СТРИВЕРДИ РЕСПИМАТ составляют одну дозу.
Взрослые.
Рекомендуемая доза составляет 5 мкг олодатерола или две ингаляции раствора из ингалятора РЕСПИМАТ один раз в день, в одно и то же время дня.
Не следует превышать рекомендованную дозу.
Пожилые пациенты
Пожилые пациенты могут применять рекомендованную дозу препарата СТРИВЕРДИ РЕСПИМАТ.
Пациенты с печеночной недостаточностью
Пациенты с легкой или умеренной печеночной недостаточностью могут применять рекомендованную дозу препарата СТРИВЕРДИ РЕСПИМАТ.
Данные о применении препарата СТРИВЕРДИ РЕСПИМАТ у пациентов с острой печеночной недостаточностью отсутствуют.
Пациенты с почечной недостаточностью
Пациенты с почечной недостаточностью могут применять рекомендованную дозу препарата СТРИВЕРДИ РЕСПИМАТ. Данные о применении препарата у пациентов с острой почечной недостаточностью ограничены.
Дети
Препарат СТРИВЕРДИ РЕСПИМАТ не предназначен для применения у детей (до 18 лет).
Инструкции по применению препарата СТРИВЕРДИ РЕСПИМАТ
Пожалуйста, прочитайте эти инструкции и тщательно им следуйте.
| 008124531477976364_ru.doc | 1374 кб |
| 660814021477977570_kz.doc | 1421 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Состав
Активные вещества:
| 1 доза | |
| олодатерол | 2.5 мкг |
| что соответствует содержанию олодатерола гидрохлорид 2.736 мкг, | |
| тиотропий бромид | 2.5 мкг |
| что соответствует содержанию тиотропия бромида моногидрат 3.124 мкг, |
Вспомогательные вещества:
бензалкония хлорида раствор — 2.2 мкг (соответственно бензалкония хлорида — 1.1 мкг), динатрия эдетат — 1.1 мкг, хлористоводородная кислота 1М — до pH 2.9, вода очищенная — до 11.05 мг.
Фармакокинетика
Фармакокинетика комбинированного препарата Спиолто® Респимат® эквивалентна фармакокинетике отдельно применяемым олодатеролу и тиотропия бромиду.
Олодатеролу и тиотропия бромиду свойственна линейная фармакокинетика.
Устойчивое состояние фармакокинетики олодатерола достигалось через 8 дней при применении 1 раз/сут, а степень воздействия увеличивалась по сравнению с применением однократной дозы в 1.8 раза. Устойчивое состояние фармакокинетики тиотропия бромида при применении 1 раз/сут достигалось через 7 дней.
Всасывание
Олодатерол быстро всасывается, после ингаляции препарата Cmax в плазме обычно достигается в течение 10-20 мин. У здоровых добровольцев после ингаляции препарата абсолютная биодоступность олодатерола составляла около 30%, тогда как абсолютная биодоступность олодатерола после приема препарата внутрь в виде раствора была ниже 1%. Таким образом, системное воздействие олодатерола после ингаляционного применения в основном реализуется путем всасывания в легких, а вклад проглатываемой части дозы в системное воздействие незначителен.
После ингаляции раствора тиотропия бромида в системный кровоток поступает около 33% от величины ингаляционной дозы. Абсолютная биодоступность при приеме внутрь составляет 2-3%. Cmax в плазме наблюдается через 5-7 мин после ингаляции.
Распределение
Связывание олодатерола с белками плазмы составляет примерно 60%, а Vd — 1110 л.
Связывание тиотропия бромида с белками плазмы составляет 72%: Vd — 32 л/кг. Доклинические исследования показали, что тиотропия бромид не проникает через ГЭБ.
Метаболизм
Олодатерол в значительной степени метаболизируется путем непосредственной глюкуронизации и О-деметилирования с последующей конъюгацией. Из 6 идентифицированных метаболитов с β2-адренорецепторами связывается только 1 неконъюгированное деметилированное производное (SOM 1522), однако этот метаболит не обнаруживается в плазме после длительного ингаляционного применения препарата в рекомендуемой терапевтической дозе или в дозах, превышающих терапевтическую в 4 раза. В О-деметилировании олодатерола участвует цитохром Р450 (изоферментов CYP2C9, CYP2C8 и в незначительной степени CYP3A4). В образовании глюкуронидов олодатерола участвуют изоформы уридиндифосфатгликозил трансферазы, UGT2B7, UGT1A1, 1А7 и 1А9.
Степень биотрансформации тиотропия бромида незначительна. Это подтверждается тем, что после в/в введения тиотропия бромида молодым здоровым добровольцам 74% тиотропия бромида выводится почками в неизмененном виде. Тиотропия бромид является эфиром, который расщепляется на этанол-N-метилскопин и дитиенилгликолиевую кислоту; эти соединения не связываются с мускариновыми рецепторами.
В исследованиях in vitro показано, что некоторая часть препарата (<20% от дозы после в/в введения) метаболизируется путем окисления цитохромом Р450 (CYP2D6 и 3А4) с последующей конъюгацией с глутатионом и образованием различных метаболитов.
Выведение
Общий клиренс олодатерола у здоровых добровольцев составляет 872 мл/мин, а почечный клиренс 173 мл/мин. Конечный T1/2 после в/в применения олодатерола составляет 22 ч, тогда как конечный T1/2 после ингаляционного применения — примерно 45 ч. Из этого следует, что в последнем случае выведение в большей степени зависит от всасывания.
Общая меченая изотопом доза олодатерола, выделявшаяся почками (включая исходное соединение и все метаболиты), составляла после в/в введения 38%, после приема внутрь — 9%. Общая меченая изотопом доза, выделявшаяся почками, неизмененного олодатерола составляла, после в/в введения 19%. Общая меченая изотопом доза, выделявшаяся через кишечник, составляла после в/в введения 53% и 84% после приема внутрь.
Более 90% дозы препарата выводилось после в/в введения в течение 5 дней и после приема внутрь в течение 6 дней. После ингаляционного применения препарата экскреция неизмененного олодатерола почками на протяжении интервала дозирования составляла у здоровых добровольцев в период устойчивого состояния фармакокинетики 5-7% от величины дозы.
Тиотропия бромид после в/в введения в основном выводится почками в неизмененном виде (74%). Общий клиренс после в/в введения тиотропия бромида молодым здоровым добровольцам составляет 880 мл/мин. После ингаляции раствора у пациентов с ХОБЛ почечная экскреция составляет 18.6% (0.93 мкг), оставшаяся неабсорбировавшаяся часть выводится через кишечник. Почечный клиренс тиотропия бромида превышает КК, что свидетельствует о его канальцевой секреции. Терминальный T1/2 тиотропия бромида после ингаляции составляет от 27 до 45 ч.
Фармакокинетика в особых клинических случаях
Клинические исследования показали: несмотря на влияние возраста, пола и массы тела на системное воздействие олодатерола коррекции дозы не требуется.
У пациентов пожилого возраста отмечается снижение почечного клиренса тиотропия (347 мл/мин у пациентов с ХОБЛ в возрасте до 65 лет и 275 мл/мин у пациентов с ХОБЛ старше 65 лет). Однако это не приводило к увеличению значения AUC0-6,ss и Cmax,ss.
Раса. Сравнение фармакокинетических данных, полученных в клинических исследованиях олодатерола, выявило тенденцию к более высокому системному воздействию олодатерола у пациентов из Японии и других пациентов монголоидной расы по сравнению с пациентами европеоидной расы. В клинических исследованиях олодатерола, применявшегося в дозах, которые превышали рекомендуемую терапевтическую дозу в 2 раза, у пациентов европеоидной и монголоидной расы каких-либо опасений в отношении безопасности установлено не было.
У пациентов с почечной недостаточностью тяжелой степени тяжести (КК <30 мл/мин) системное воздействие олодатерола увеличивалось в среднем в 1.4 раза. Такое повышение воздействия не вызывает опасении в отношении безопасности, учитывая опыт, полученный в ходе применения олодатерола в клинических исследованиях. После ингаляционного применения тиотропия 1 раз/сут в период равновесного состояния у пациентов с ХОБЛ и почечной недостаточностью легкой степени тяжести (КК 50-80 мл/мин) отмечалось небольшое увеличение величин AUC0-6,ss на 1.8-30% и Cmax,ss по сравнению с пациентами с нормальной функцией почек (КК >80 мл/мин). У пациентов с ХОБЛ и почечной недостаточностью средней и тяжелой степени тяжести (КК <50 мл/мин) в/в применение тиотропия бромида приводило к двукратному увеличению общего воздействия тиотропия бромида (значение AUC0-4 увеличивалось на 82%, а величина Cmax увеличилась на 52%) по сравнению с пациентами с нормальной функцией почек. Аналогичное повышение концентрации в плазме отмечалось и после ингаляции сухого порошка.
У пациентов с печеночной недостаточностью легкой и средней степени тяжести системное воздействие олодатерола не изменялось. Системное воздействие олодатерола у пациентов с печеночной недостаточностью тяжелой степени тяжести не изучалось. Предполагается, что печеночная недостаточность не оказывает значительного влияния на фармакокинетику тиотропия бромида, т.к. тиотропия бромид преимущественно выводится почками и с помощью неферментативного расщепления эфирной связи с образованием производных, которые не обладают фармакологической активностью.
Показания к применению
- Длительная поддерживающая терапия у пациентов с ХОБЛ, хроническим бронхитом, эмфиземой легких;
- для уменьшения обструкции дыхательных путей и сопутствующей одышки;
- для уменьшения частоты обострений; улучшения переносимости физических нагрузок и качества жизни.
Противопоказания
- Повышенная чувствительность к олодатеролу, тиотропию бромиду или к любому компоненту препарата;
- повышенная чувствительность к атропину или его производным, в т.ч. к ипратропию и окситропию;
- не рекомендуется к применению у детей до 18 лет (ввиду отсутствия данных по эффективности и безопасности).
С осторожностью следует применять препарат у пациентов с закрытоугольной глаукомой, гиперплазией предстательной железы и обструкцией шейки мочевого пузыря; у пациентов с сердечно-сосудистыми заболеваниями, в т.ч. коронарной недостаточностью, нарушениями сердечного ритма, удлинением интервала QT, гипертрофической обструктивной кардиомиопатией, артериальной гипертензией, тиреотоксикозом, судорогами; у пациентов в анамнезе которых отмечались такие заболевания как инфаркт миокарда или госпитализация по поводу сердечной недостаточности (в течение предшествующего года), жизнеугрожающая аритмия, пароксизмальная тахикардия с ЧСС >100 уд./мин; у пациентов с необычными реакциями на симпатомиметические амины.
Способ применения и дозы
Рекомендуемая терапевтическая доза составляет 2 ингаляции спрея из ингалятора Респимат® (5 мкг/терапевтическая доза тиотропия бромида и 5 мкг/терапевтическая доза олодатерола) 1 раз/сут, в одно и то же время суток.
У пациентов пожилого возраста можно использовать препарат Спиолто® Респимат® в рекомендуемой дозе.
У пациентов с печеночной недостаточностью легкой и средней степени тяжести можно использовать Спиолто® Респимат® в рекомендуемой дозе. Данных о применении олодатерола у пациентов с печеночной недостаточностью тяжелой степени не имеется.
У пациентов с нарушениями функции почек можно использовать препарат Спиолто® Респимат® в рекомендуемой дозе.
Пациенты с почечной недостаточностью средней и тяжелой степени, применяющие препарат Спиолто® Респимат®, должны находиться под тщательным наблюдением врача.
Правила применения ингалятора Спиолто® Респимат®
Перед началом использования препарата следует изучить правила применения ингалятора Спиолто® Респимат®.
Ингалятор предназначен для использования 1 раз/сут. Каждый раз при его применении следует делать 2 ингаляции.

Как хранить ингалятор Спиолто® Респимат®
Хранить Спиолто® Респимат® в недоступном для детей месте.
Не замораживать Спиолто® Респимат®.
Если ингалятор Спиолто® Респимат® не использовался более 7 дней, следует направить его перед применением вниз и нажать один раз на кнопку подачи дозы.
Если ингалятор Спиолто® Респимат® не использовался более 21 дня, следует повторить шаги 4-6 из раздела «Подготовка к первому использованию» до появления облачка аэрозоля. Затем повторить шаги 4-6 еще три раза.
Не использовать ингалятор Спиолто® Респимат® после окончания срока годности.
Не трогать прокалывающий элемент внутри прозрачной гильзы.
Уход за ингалятором Спиолто® Респимат®
Мундштук, включая металлическую часть внутри мундштука, следует очищать влажной тряпочкой или тканью, как минимум, 1 раз в неделю.
Любое незначительное изменение цвета мундштука не влияет на работу ингалятора Спиолто® Респимат®.
Определение момента, когда нужно начать пользоваться новым ингалятором

Ингалятор Спиолто® Респимат® содержит 60 ингаляционных доз (т.е. 30 терапевтических доз) при условии применения в соответствии с режимом дозирования (2 ингаляционные дозы 1 раз/сут).
Индикатор доз показывает, сколько примерно доз еще осталось. Когда индикатор покажет на красную область шкалы, это означает, что лекарства осталось примерно на 7 дней (14 ингаляционных доз).
Когда индикатор доз ингалятора достигнет конца красной области шкалы, ингалятор Спиолто® Респимат® автоматически заблокируется — больше не может быть получено ни одной ингаляционной дозы (поворот прозрачной гильзы будет невозможен).
Через 3 месяца после первого использования ингалятор Спиолто® Респимат® следует выбросить, даже если он полностью не использован.
Подготовка к перовому использованию
1. Снять прозрачную гильзу

- Держать колпачок закрытым.
- Нажать стопорную кнопку и сильно потянуть при этом другой рукой за прозрачную гильзу.
2. Вставить картридж

- Вставить картридж узким концом в ингалятор.
- Поставить ингалятор дном картриджа на твердую поверхность и сильно нажать на него, пока картридж не встанет на место со щелчком.
3. Установить на место прозрачную гильзу
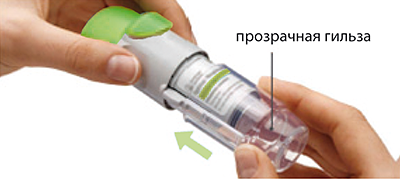
- Установить прозрачную гильзу на место до щелчка.
4. Повернуть

- Держать колпачок закрытым.
- Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, пока не раздастся щелчок (пол-оборота).
5. Открыть

- Открыть колпачок до упора.
6. Нажать

- Направить ингалятор вниз.
- Нажать кнопку подачи дозы.
- Закрыть колпачок.
- Повторить шаги 4-6 до появления облачка аэрозоля.
- После появления облачка аэрозоля повторить шаги 4-6 еще 3 раза.
Ежедневное применение
Повернуть
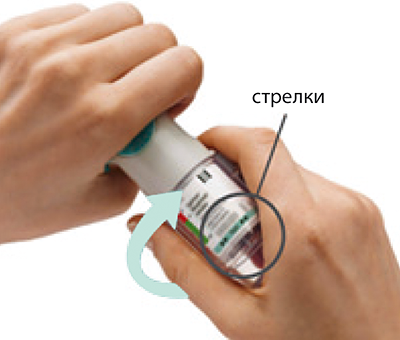
- Держать колпачок закрытым.
- Повернуть прозрачную гильзу в направлении, указанном стрелками на этикетке, до щелчка (пол-оборота).
Открыть

- Открыть колпачок до упора.
Нажать

Сделать медленный полный выдох.
Обхватить мундштук губами, не перекрывая воздухозаборники.
Делая медленный, глубокий вдох через рот, нажать кнопку подачи дозы и продолжать делать вдох.
Задержать дыхание примерно на 10 сек или так долго, как возможно.
Для получения второй ингаляционной дозы повторить операции: Повернуть, Открыть, Нажать.
Ответы на часто задаваемые вопросы
1. Сложно установить картридж на необходимую глубину
Вы случайно повернули прозрачную гильзу до установки картриджа? Откройте колпачок, нажмите на кнопку подачи дозы, затем вставьте картридж.
Вы вставляете картридж широким концом? Вставьте картридж узким концом в ингалятор.
2. Невозможно нажать на кнопку подачи дозы
Повернули ли Вы прозрачную гильзу? Если нет, поверните прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
Индикатор доз ингалятора Спиолто® Респимат® указывает на ноль? Ингалятор Спиолто® Респимат® блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спиолто® Респимат®.
3. Невозможно повернуть прозрачную гильзу
Вы уже повернули прозрачную гильзу? Если прозрачная гильза уже повернута, следуйте по шагам «Открыть» и «Нажать» в разделе «Ежедневное применение» для получения ингаляционной дозы.
Индикатор доз ингалятора Спиолто® Респимат® указывает на ноль? Ингалятор Спиолто® Респимат® блокируется после выпуска 60 ингаляционных доз (30 терапевтических доз). Подготовьте и используйте новый ингалятор Спиолто® Респимат®.
4. Индикатор доз ингалятора Спиолто® Респимат® достигает нуля слишком быстро
Использовали ли Вы Спиолто® Респимат® в соответствии с Режимом дозирования (две ингаляционные дозы 1 раз/сут)? Препарата Спиолто® Респимат® хватает на 30 дней при использовании двух ингаляций 1 раз/сут.
Поворачивали ли Вы прозрачную гильзу до установки картриджа? Индикатор доз считает каждый поворот прозрачной гильзы вне зависимости от того, установлен картридж или нет.
Выпускали ли Вы ингаляционные дозы в воздух для проверки работы Спиолто® Респимат®. После подготовки ингалятора к использованию не требуется ежедневной проверки ингаляции.
Вы установили картридж в использованный ингалятор Спиолто® Респимат®?
Всегда устанавливайте новый картридж в новый ингалятор Спиолто® Респимат®.
5. Ингалятор Спиолто® Респимат® выпускает ингаляционные дозы автоматически
Был ли открыт колпачок, когда Вы поворачивали прозрачную гильзу? Закройте колпачок, затем поверните прозрачную гильзу.
Нажимали ли Вы кнопку подачи дозы во время поворота прозрачной гильзы? Закройте колпачок так, чтобы кнопка подачи дозы была закрыта, затем поверните прозрачную гильзу.
Останавливались ли Вы во время поворота прозрачной гильзы, до звука щелчка? Поверните прозрачную гильзу одним непрерывным движением до щелчка (пол-оборота).
6. Ингалятор Спиолто® Респимат® не выпускает ингаляционную дозу
Установили ли Вы картридж? Если нет, установите картридж.
Вы повторили шаги «Повернуть», «Открыть», «Нажать» менее трех раз после установки картриджа? Повторите шаги «Повернуть», «Открыть», «Нажать» три раза после установки картриджа, как описано в разделе «Подготовка к первому использованию», шаги 4-6.
Индикатор доз ингалятора Спиолто® Респимат® указывает на ноль? Если индикатор доз указывает на ноль, значит ингалятор пуст и заблокирован.
Не снимайте прозрачную гильзу и не вынимайте картридж после подготовки ингалятора к использованию. Всегда устанавливайте новый картридж в новый ингалятор Спиолто® Респимат®.
Условия хранения
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С. Не замораживать.
Срок годности
3 года. Использовать в течение 3 мес после первой ингаляции.
Особые указания
Препарат Спиолто® Респимат® не следует использовать при бронхиальной астме. Эффективность и безопасность препарата Спиолто® Респимат® при бронхиальной астме не изучались.
Острый бронхоспазм
Препарат Спиолто® Респимат® не показан для лечения острых эпизодов бронхоспазма, т.е. в качестве средства скорой помощи.
Гиперчувствительность
После применения препарата Спиолто® Респимат® возможно развитие реакций гиперчувствительности немедленного типа.
Парадоксальный бронхоспазм
Применение препарата Спиолто® Респимат®, как и других ингаляционных лекарственных средств, может привести к парадоксальному бронхоспазму, иногда угрожающему жизни. В случае развития парадоксального бронхоспазма применение препарата Спиолто® Респимат® должно быть немедленно прекращено и назначена альтернативная терапия.
Пациенты с нарушениями функции почек
Т.к. тиотропия бромид выводится преимущественно почками, пациенты с почечной недостаточностью средней и тяжелой степени тяжести (КК <50 мл/мин), применяющие препарат Спиолто® Респимат®, должны находиться под тщательным наблюдением врача.
Нарушения со стороны органа зрения
Пациенты должны быть ознакомлены о правильном применении препарата Спиолто® Респимат®. Не следует допускать попадания раствора или аэрозоля в глаза. Боль или дискомфорт в глазах, нечеткое зрение, зрительные ореолы вокруг источников света в сочетании с покраснением глаз, вызванным отеком конъюнктивы и роговицы могут быть симптомами острой закрытоугольной глаукомы. При развитии любой комбинации этих симптомов следует немедленно обратиться к специалисту. Глазные капли, обладающие миотическим действием, не считаются эффективным лечением.
Сердечно-сосудистые эффекты
Олодатерол, как и другие бета2-адреномиметики, может оказывать клинически существенное влияние на сердечно-сосудистую систему у некоторых пациентов (учащение пульса, повышение АД и/или появление соответствующих симптомов). В случае возникновения таких симптомов может потребоваться прекращение лечения. Кроме того, сообщалось, что бета2-адреномиметики приводили к таким изменениям ЭКГ, как уплощение зубца Т и депрессия сегмента ST, хотя клиническое значение этих изменений неизвестно.
Гипокалиемия
Бета2-адреномиметики у некоторых пациентов могут приводить к развитию гипокалиемии, создающей предпосылки для возникновения нежелательных влиянии на сердечно-сосудистую систему. Снижение концентрации калия в сыворотке крови обычно кратковременно и не требует его восполнения. У пациентов с тяжелой ХОБЛ гипокалиемия может усиливаться из-за гипоксии и сопутствующего лечения и увеличивать риск развития аритмий.
Гипергликемия
Ингаляционное применение больших доз бета2-адреномиметиков может привести к увеличению концентрации глюкозы в плазме крови.
Спиолто® Респимат® не следует применять в комбинации с каким-либо другим лекарственным препаратом, содержащим бета2-адреномиметики длительного действия.
Пациентов, часто применяющих ингаляционные бета2-адреномиметики короткого действия (например, 4 раза/сут), необходимо проинструктировать о том, что эти препараты используются только для облегчения острых симптомов бронхоспазма.
Спиолто® Респимат® предназначен для поддерживающего лечения больных ХОБЛ. В связи с тем обстоятельством, что в общей популяции ХОБЛ существенно преобладают больные в возрасте старше 40 лет, при назначении препарата пациентам моложе 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ.
Описание
Бронхолитическое средство комбинированное (бета2-адреномиметик длительного действия + м-холиноблокатор).
Фармакодинамика
Комбинированный бронхолитический препарат. Олодатерол — бета2-адреномиметик длительного действия и тиотропия бромид — м-холиноблокатор обеспечивают взаимодополняющую бронходилатацию, в результате различного механизма действия активных веществ и различной локализации целевых рецепторов в легких.
Олодатерол обладает высоким сродством и селективностью к β2-адренорецепторам. Активация β2-адренорецепторов в дыхательных путях приводит к стимуляции внутриклеточной аденилатциклазы, которая участвует в синтезе циклического 3.5-аденозинмонофосфата (цАМФ). Повышение уровня цАМФ вызывает бронходилатацию, расслабляя гладкомышечные клетки дыхательных путей. Олодатерол является селективным агонистом β2-адренорецепторов длительного действия с быстрым началом действия и длительным (не менее 24 ч) сохранением эффекта. β2-адренорецепторы присутствуют не только в гладкомышечных клетках, но и во многих других клетках, в т.ч. в эпителиальных и эндотелиальных клетках легких и сердца. Точная функция β2-рецепторов в сердце до конца не изучена, но их присутствие указывает на возможность влияний на сердце даже высокоселективных бета2-адренергических агонистов.
Тиотропия бромид — м-холиноблокатор длительного действия. Препарат обладает одинаковым сродством к M1-М5 подтипам мускариновых рецепторов. Результатом ингибирования М3-холинорецепторов в дыхательных путях является расслабление гладкой мускулатуры. Бронходилатирующий эффект зависит от дозы и сохраняется в течение не менее 24 ч. Значительная продолжительность действия связана, вероятно, с очень медленной диссоциацией препарата от М3-холинорецепторов: период полудиссоциации существенно более длительный, чем у ипратропия бромида. При ингаляционном способе введения тиотропия бромид, как N-четвертичное производное аммония, оказывает местный избирательный эффект (на бронхи), при этом в терапевтических дозах не вызывая системных м-холиноблокирующих побочных эффектов. Диссоциация от М2-холинорецепторов происходит быстрее, чем от М3-холинорецепторов, что свидетельствует о преобладании селективности в отношении М3 подтипа холинорецепторов над М2-холинорецепторами. Высокое сродство к рецепторам и медленная диссоциация препарата из связи с рецепторами обусловливают выраженный и продолжительный бронходилатирующий эффект у пациентов с ХОБЛ.
Бронходилатация, развивающаяся после ингаляции тиотропия бромида, обусловлена, в первую очередь, местным (на дыхательные пути), а не системным действием.
В ходе клинических исследований установлено, что препарат Спиолто® Респимат®, применявшийся 1 раз/сут, утром, приводил к быстрому (в течение 5 мин после первой дозы) улучшению функции легких. Эффект препарата Спиолто® Респимат® превосходил эффект тиотропия бромида в дозе 5 мкг и олодатерола в дозе 5 мкг, применявшихся в качестве монотерапии (ОФВ1 при приеме Спиолто® Респимат® на 0.137 л: при приеме тиотропия бромида на 0.058 л; при приеме олодатерола — на 0.125 л).
При применении препарата Спиолто® Респимат® по сравнению с применением тиотропия бромида и олодатерола в качестве монотерапии достигался более значительный бронходилатирующий эффект, а также увеличивалась пиковая объемная скорость выдоха в утренние и вечерние часы.
Применение препарата Спиолто® Респимат® приводило к снижению риска обострений ХОБЛ по сравнению с плацебо.
Препарат Спиолто® Респимат® значительно улучшал емкость вдоха по сравнению с тиотропия бромидом, олодатеролом или плацебо, применявшимися в виде монотерапии.
Спиолто® Респимат® по сравнению с плацебо значительно улучшал время переносимости физической нагрузки.
Побочные действия
Побочные реакции были выявлены на основании данных, полученных при проведении клинических исследований препарата Спиолто® Респимат®.
Определений категорий частоты побочных реакций: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (от ≥1/1000, <1/100), редко (≥1/10 000, <1/1000), очень редко (<1/10 000), частота неизвестна* (частота не может быть оценена на основании имеющихся данных).
Инфекционные и паразитарные заболевания: редко — назофарингит.
Со стороны обмена веществ: частота неизвестна — дегидратация.
Со стороны нервной системы: нечасто — головокружение, бессонница.
Со стороны органа зрения: редко — нечеткое зрение; частота неизвестна — повышение внутриглазного давления, глаукома.
Со стороны сердечно-сосудистой системы: нечасто — мерцательная аритмия, ощущение сердцебиения, тахикардия, повышение АД; редко — наджелудочковая тахикардия.
Со стороны дыхательной системы: нечасто — кашель, дисфония; редко — ларингит, фарингит, носовое кровотечение; частота неизвестна — бронхоспазм, синусит.
Со стороны пищеварительной системы: часто — сухость во рту (обычно незначительная); нечасто — запор; редко — кандидоз полости рта, гингивит; частота неизвестна — кишечная непроходимость, включая паралитическую кишечную непроходимость, гастроэзофагеальный рефлюкс, дисфагия, глоссит, стоматит.
Со стороны кожи и подкожных тканей: частота неизвестна — кожные инфекции и язвы на коже, сухость кожи.
Аллергические реакции: редко — гиперчувствительность (включая реакции немедленного типа) ангионевротический отек, крапивница, зуд; частота неизвестна — сыпь.
Со стороны костно-мышечной системы: редко — артралгия, боль в спине**; частота неизвестна — отечность в области суставов.
Со стороны почек и мочевыделительной системы: редко — дизурия, задержка мочи (чаще у мужчин с наличием предрасполагающих факторов), инфекция мочевыводящих путей.
* Данные побочные реакции не были выявлены в ходе клинических исследований препарата. С вероятностью 95% частота этих побочных реакций не превышает категорию «нечасто».
**Нежелательный эффект, относящейся к препарату Спиолто® Респимат®, а не к его компонентам.
Многие из перечисленных нежелательных эффектов относятся к антихолинергическим свойствам тиотропия бромида или к бета-адреномиметическим свойствам олодатерола. Поэтому следует принимать во внимание возможность возникновения нежелательных эффектов, характерных для всего класса бета-адреномиметиков, таких как: аритмия, ишемия миокарда, стенокардия, артериальная гипотензия, тремор, головная боль, нервозность, тошнота, мышечные спазмы, усталость, недомогание, гипокалиемия, гипергликемия и метаболический ацидоз.
Применение при беременности и кормлении грудью
Клинических данных о влиянии олодатерола/тиотропия бромида на беременность нет. В доклинических исследованиях при использовании высоких доз олодатерола, в несколько раз превышавших терапевтические дозы, установлены влияния типичные для бета2-адреномиметиков. Следует учитывать ингибирующее влияние олодатерола на сократительную способность матки. Препарат Спиолто® Респимат® не следует применять у беременных женщин, если только потенциальная польза для матери не превышает потенциальный риск для плода.
Клинических данных о применении олодатерола/тиотропия бромида у женщин, кормящих грудью, нет. Препарат Спиолто® Респимат® не следует применять у кормящих грудью женщин, если только потенциальная польза для матери не превышает потенциальный риск для ребенка. На период применения препарата необходимо прекратить грудное вскармливание.
Взаимодействие
Хотя специальных исследований лекарственного взаимодействия не проводилось, тиотропия бромид применяли совместно с другими препаратами, для лечения ХОБЛ, включая метилксантины, стероиды для приема внутрь и ингаляционного применения, при этом клинических признаков лекарственного взаимодействия не отмечалось.
Длительное совместное применение тиотропия бромида с другими м-холиноблокирующими препаратами не изучалось. Поэтому долгосрочное совместное применение препарата Спиолто® Респимат® с другими м-холиноблокирующими препаратами не рекомендуется.
Одновременное применение других адренергических препаратов может усиливать нежелательные эффекты препарата Спиолто® Респимат®.
Одновременное применение ксантиновых производных, стероидов или диуретиков (не относящихся к группе калийсберегающих) может усиливать гипокалиемический эффект адреномиметиков.
Бета-адреноблокаторы могут ослаблять эффект олодатерола или противодействовать этому эффекту. В этом случае предпочтительно применение бета1-адреноблокаторов, хотя и их следует применять с осторожностью.
Ингибиторы МАО, трициклические антидепрессанты или другие препараты, способные удлинять интервал QTc, могут усиливать действие препарата Спиолто® Респимат® на сердечно-сосудистую систему.
Совместное применение олодатерола с кетоконазолом приводило к увеличению системного воздействия олодатерола в 1.7 раза. Однако это не влияло на безопасность. Изменения дозы не требуется.
Передозировка
Симптомы: передозировка олодатерола может привести к выраженным эффектам, типичным для бета2-адреномиметиков, например, к ишемии миокарда, повышению или снижению АД, тахикардии, аритмиям, ощущению сердцебиения, головокружению, нервозности, бессоннице, беспокойству, головной боли, тремору, сухости во рту, спазму мышц, тошноте, усталости, недомоганию, гипокалиемии, гипергликемии и метаболическому ацидозу.
При применении высоких доз тиотропия бромида возможны проявления м-холиноблокирующего действия. После 14-дневного ингаляционного применения тиотропия бромида в дозах, достигавших 40 мкг, у здоровых лиц не наблюдалось значимых неблагоприятных явлений, кроме чувства сухости слизистых оболочек носа и ротоглотки, частота которых зависела от величины дозы (10-40 мкг/сут). Исключение составляло отчетливое снижение саливации, начиная с 7 дня применения препарата.
Лечение: прием препарата Спиолто® Респимат® следует прекратить. Показано поддерживающее и симптоматическое лечение. В тяжелых случаях необходима госпитализация. Может рекомендоваться применение бета1-адреноблокаторов, но только при соблюдении особой осторожности, т.к. использование этих препаратов может вызвать бронхоспазм.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились. Следует соблюдать осторожность при выполнении данных видов деятельности, т.к. возможно развитие головокружения или нечеткости зрения.








