Окревус — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-004503
Торговое наименование
Окревус®
Международное непатентованное или группировочное наименование
Окрелизумаб
Лекарственная форма
Концентрат для приготовления раствора для инфузий
Состав
1 флакон содержит:
действующее вещество: окрелизумаб – 300 мг;
вспомогательные вещества: натрия ацетата тригидрат – 21.4 мг, уксусная кислота ледяная – 2.5 мг, α,α-трегалозы дигидрат – 400.0 мг, полисорбат 20 – 2.0 мг, вода для инъекций до 10 мл.
1 мл концентрата содержит 30 мг окрелизумаба.
Описание
Прозрачная или слегка опалесцирующая жидкость от бесцветного до слегка коричневатого цвета.
Фармакотерапевтическая группа
Иммунодепрессанты, селективные иммунодепрессанты.
Код АТХ
L04AA36
Фармакологические свойства
Фармакодинамика
Механизм действия
Окрелизумаб – рекомбинантное гуманизированное моноклональное антитело, селективно воздействующее на В-клетки, экспрессирующие CD20.
CD20 представляет собой поверхностный антиген, расположенный на пре-В-клетках, зрелых В-клетках и В-клетках памяти. CD20 не экспрессируется на стволовых лимфоидных клетках и плазматических клетках.
Точный механизм, посредством которого достигается терапевтический клинический эффект окрелизумаба при рассеянном склерозе (РС), полностью не установлен. Предполагается, что данный механизм включает процесс иммуномодуляции путем уменьшения количества и подавления функции В-клеток, экспрессирующих CD20. После связывания на поверхности В-клеток, экспрессирующих CD20, окрелизумаб селективно уменьшает их количество посредством антителозависимого клеточного фагоцитоза, антителозависимой клеточной цитотоксичности, комплементзависимой цитотоксичности и апоптоза. Способность к восстановлению В-клеток и существующий гуморальный иммунитет сохраняются. Кроме того, окрелизумаб не влияет на врожденный иммунитет и общее количество Т-клеток.
Фармакодинамические эффекты
К 14 дню терапии (первая точка оценки) окрелизумабом наблюдалось быстрое истощение пула CD19+ В-клеток в крови, которое сохранялось в течение всего периода лечения и являлось ожидаемым фармакологическим эффектом. Для подсчета количества В-клеток используется именно CD19, так как окрелизумаб препятствует распознаванию CD20 при проведении анализа.
В исследованиях III фазы в периодах между введениями окрелизумаба наблюдалось восстановление пула В-клеток (до исходного значения или выше нижней границы нормы (НГН)), как минимум, однократно приблизительно у 5% пациентов.
Степень и длительность истощения пула В-клеток в исследованиях при первично-прогрессирующем рассеянном склерозе (ППРС) и рецидивирующих формах РС были сходными.
По результатам наиболее длительного периода наблюдения с момента последней инфузии окрелизумаба (исследование II фазы, WA21493, N=51) медиана периода восстановления пула В-клеток (возвращение к НГН или к исходному значению, если оно меньше НГН) составила 72 недели (27-175 недель). У 90% пациентов пул В-клеток восстановился до значений НГН или исходного значения приблизительно через два с половиной года после последней инфузии препарата.
Клиническая эффективность и безопасность
Клинические исследования при рецидивирующих формах РС
Профиль эффективности и безопасности окрелизумаба оценивали у пациентов с рецидивирующими формами РС (согласно диагностическим критериям МакДональда 2010) и с признаками активности заболевания (определяемыми клиническими или визуализирующими признаками) в течение предыдущих 2 лет в двух рандомизированных, двойных слепых клинических исследованиях (WA21092, WA21093) с идентичным дизайном, с двойной имитацией и с использованием активного препарата сравнения (интерферон бета-1а). Дизайн исследования и исходные характеристики исследуемой популяции представлены в таблице 1.
Демографические и исходные характеристики были сбалансированы в обеих группах терапии. Пациенты группы А получали окрелизумаб 600 мг каждые 6 месяцев (доза 1 в виде 2 внутривенных (в/в) инфузий по 300 мг с интервалом в 2 недели), последующие дозы вводились в виде однократной в/в инфузии 600 мг. Пациенты группы B получали интерферон бета-1а 44 мкг 3 раза в неделю подкожно.
Таблица 1. Дизайн исследований, демографические и исходные характеристики
| Название исследования | Исследование 1 | Исследование 2 | ||
| WA21092 (OPERA I) (n = 821) |
WA21093 (OPERA II) (n = 835) |
|||
| Дизайн исследования | ||||
| Исследуемая популяция | Пациенты с рецидивирующими формами РС | |||
| История болезни при скрининге | Как минимум два рецидива в течение предшествующих двух лет или один рецидив в течение предшествующего года; оценка по шкале EDSS* от 0 до 5.5 балла включительно | |||
| Продолжительность исследования | 2 года | |||
| Группы лечения | Группа А: окрелизумаб, 600 мг Группа В: интерферон бета-1а, 44 мкг, подкожно |
|||
| Исходные характеристики | Окрелизумаб, 600 мг (n = 410) |
Интерферон бета-1а, 44 мкг (n = 411) |
Окрелизумаб, 600 мг (n = 417) |
Интерферон бета-1а, 44 мкг (n = 418) |
| Средний возраст (лет) | 37.1 | 36.9 | 37.2 | 37.4 |
| Возрастной диапазон (лет) при включении | 18-56 | 18-55 | 18-55 | 18-55 |
| Распределение по полу (%, мужчины/%, женщины) | 34.1/65.9 | 33.8/66.2 | 35.0/65.0 | 33.0/67.0 |
| Среднее значение/медиана продолжительности заболевания с момента постановки диагноза (лет) | 3.82/1.53 | 3.71/1.57 | 4.15/2.10 | 4.13/1.84 |
| Пациенты, ранее не получавшие болезнь-модифицирующие препараты (БМП) (%)** | 73.4 | 71.0 | 72.7 | 74.9 |
| Среднее количество рецидивов за прошедший год | 1.31 | 1.33 | 1.32 | 1.34 |
| Доля пациентов с очагами, накапливающими гадолиний-содержащее контрастное вещество на Т1-взвешенных изображениях | 42.5 | 38.1 | 39.0 | 41.4 |
| Средняя оценка по шкале EDSS* | 2.82 | 2.71 | 2.73 | 2.79 |
* EDSS – расширенная шкала оценки степени инвалидизации (Expanded Disability Status Scale)
** Пациенты, не получавшие БМП в течение 2 лет до рандомизации
Основные клинические результаты и результаты магнитно-резонансной томографии (МРТ) для оценки эффективности представлены в таблице 2 и на рисунке 1.
Результаты этих исследований показывают, что окрелизумаб значительно подавлял рецидивы, субклиническую активность заболевания, определяемую с помощью МРТ, и прогрессирование заболевания по сравнению с интерфероном бета-1а в дозе 44 мкг подкожно.
Таблица 2. Основные клинические конечные точки и конечные точки по данным МРТ в исследованиях WA21092 и WA21093 (рецидивирующие формы РС)
| Конечные точки | Исследование 1: WA21092 (OPERA I) |
Исследование 2: WA21093 (OPERA II) |
||
| Окрелизумаб 600 мг (n = 410) | Интерферон бета-1а, 44 мкг (n = 411) | Окрелизумаб 600 мг (n = 417) | Интерферон бета-1а, 44 мкг (n = 418) | |
| Клинические конечные точки | ||||
| Годовая частота развития рецидивов (первичная конечная точка)8 | 0.156 | 0.292 | 0.155 | 0.290 |
| Относительное сокращение | 46% (p<0.0001) |
47% (p<0.0001) |
||
| Доля пациентов с подтвержденным прогрессированием инвалидизации в течение 12 недель3 | 9.8% в группе окрелизумаба по сравнению с 15.2% в группе интерферона бета-1а | |||
| Снижение риска (объединенный анализ1) | 40% (p = 0.0006)7 |
|||
| Снижение риска (отдельные исследования2) | 43% (p = 0.0139)7 |
37% (p = 0.0169)7 |
||
| Доля пациентов с подтвержденным прогрессированием инвалидизации в течение 24 недель3 | 7.6% в группе окрелизумаба по сравнению с 12.0% в группе интерферона бета-1а | |||
| Снижение риска (объединенный анализ1) | 40% (p = 0.0025)7 |
|||
| Снижение риска (отдельные исследования2) | 43% (p = 0.0278)7 |
37% (p = 0.0370)7 |
||
| Доля пациентов с подтвержденным уменьшением степени инвалидизации в течение как минимум 12 недель4 (объединенный анализ) | 20.7% в группе окрелизумаба по сравнению с 15.6% в группе интерферона бета-1а | |||
| Относительное улучшение (объединенный анализ1) | 33% (p = 0.0194) | |||
| Относительное улучшение (отдельные исследования2) | 61% (p = 0.0106) |
14% (p = 0.4019) |
||
| Доля пациентов без рецидивов через 96 недель2 | 80.4% | 66.7% | 78.9% | 64.3% |
| (p <0.0001) | (p <0.0001) | |||
| Доля пациентов с отсутствием признаков активности заболевания (No Evidence of Disease Activity – NEDA)5 | 48% | 29% | 48% | 25% |
| Относительное улучшение2 | 64% (p<0.0001) | 89% (p<0.0001) | ||
| Конечные точки по данным МРТ | ||||
| Среднее число очагов, накапливающих гадолиний-содержащее контрастное вещество, на Т-1 взвешенных изображениях на МРТ | 0.016 | 0.286 | 0.021 | 0.416 |
| Относительное уменьшение | 94% (p <0.0001) | 95% (p <0.0001) | ||
| Среднее количество новых и/или увеличение существующих гиперинтенсивных очагов на Т-2 взвешенных изображениях на МРТ | 0.323 | 1.413 | 0.325 | 1.904 |
| Относительное уменьшение | 77% (p <0.0001) | 83% (p <0.0001) | ||
| Процентное изменение объема головного мозга с недели 24 по неделю 96 | -0.572 | -0.741 | -0.638 | -0.750 |
| Относительное снижение потери объема головного мозга | 22.8% (p = 0.0042)6 |
14.9% (p = 0.0900) |
1 Проспективно объединены данные из исследований 1 и 2.
2 Неподтвержденный p-критерий; не является частью предварительно определенной иерархии тестирования
3 Определяется как увеличение на ≥1.0 балла по сравнению с исходной оценкой по шкале EDSS у пациентов с исходной оценкой ≤5.5 балла или увеличение на ≥0.5 балла при исходной оценке >5.5 балла, оценка Каплана-Мейера на неделе 96.
4 Определяется как уменьшение на ≥1.0 балла по сравнению с исходной оценкой по шкале EDSS у пациентов с исходным баллом по шкале EDSS ≥2 и ≤5.5 или уменьшение на ≥0.5 балла при исходной оценке >5.5 балла. В анализ не были включены пациенты с исходной оценкой <2 баллов.
5 Статус NEDA определяется как отсутствие определенных в протоколе рецидивов, подтвержденного прогрессирования инвалидизации (ППИ) и любой активности заболевания по результатам МРТ (очаги, накапливающие гадолиний-содержащий контраст, на Т1-взвешенных изображениях, либо появление новых или увеличение существующих очагов на Т2-взвешенных изображениях) в течение всего 96-недельного периода лечения. Результаты поискового анализа получены для всей ITT-популяции.
6 Неподтвержденный р-критерий; процедура иерархического исследования прекращена до достижения конечной точки.
7 Лог-ранговый критерий
8 Подтвержденный рецидив (сопровождающийся клинически значимым изменением в соответствии со шкалой EDSS)
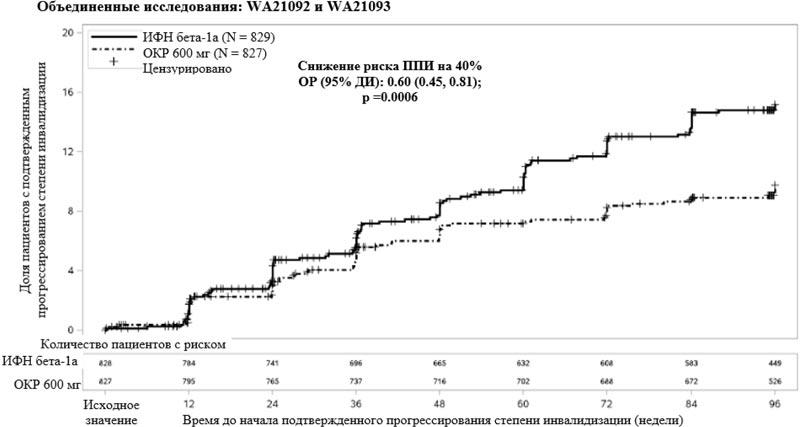
Результаты предварительно заданного объединенного анализа времени до ППИ, сохраняющегося в течение по крайней мере 12 недель (снижение риска на 40% при применении окрелизумаба по сравнению с интерфероном бета-1а, p = 0.0006), в значительной степени сопоставимы с результатами применения в течение, как минимум, 24 недель (снижение риска на 40% при применении окрелизумаба по сравнению с интерфероном бета-1а, р = 0.0025).
В исследования включали пациентов с активным заболеванием, к ним относились как пациенты, ранее не получавшие активного лечения, так и пациенты с недостаточным ответом на лечение, что определялось по клиническим данным или результатам визуализирующих тестов.
Анализ популяций пациентов с различными исходными уровнями активности заболевания, включая активное и высокоактивное заболевание, показал, что эффективность окрелизумаба в снижении годовой частоты развития рецидивов и ППИ в течение 12 недель соответствовала таковой в общей популяции.
Клинические исследования при ППРС
Профиль эффективности и безопасности окрелизумаба оценивали в ходе рандомизированного, двойного слепого, плацебо-контролируемого клинического исследования при участии пациентов с ППРС (WA25046) на ранней стадии заболевания согласно основным критериям включения: возраст 18-55 лет включительно; оценка по шкале EDSS при скрининге от 3.0 до 6.5 баллов; длительность заболевания от появления симптомов РС менее 10 лет у пациентов с оценкой по шкале EDSS при скрининге ≤5.0 баллов или менее 15 лет у пациентов с оценкой по шкале EDSS при скрининге >5.0 баллов. Что касается активности заболевания, признаки, характерные для воспалительной активности, даже при прогрессирующем РС, могут быть связаны с результатами визуализирующих тестов (т. е. очаги, накапливающие гадолиний-содержащее контрастное вещество на Т1-взвешенных изображениях и/или активные (новые или увеличивающиеся) очаги на Т2-взвешенных изображениях). Данные МРТ необходимо использовать для подтверждения воспалительной активности у всех пациентов. Пациентов старше 55 лет не включали в исследование. Дизайн исследования и исходные характеристики исследуемой популяции представлены в таблице 3.
Демографические признаки и исходные характеристики были хорошо сбалансированы в обеих группах терапии. МРТ головного мозга показала признаки, характерные для воспалительной активности, в очагах, накапливающих гадолиний-содержащее контрастное вещество на Т1 – или Т2-взвешенных изображениях.
Во время исследования III фазы пациенты с ППРС получали окрелизумаб в дозе 600 мг каждые 6 месяцев в виде двух инфузий по 300 мг с интервалом в две недели, в течение всего периода лечения. Однократная инфузия 600 мг среди популяции пациентов с рецидивирующими формами РС и 2 инфузии по 300 мг каждая у пациентов с ППРС показали сходные фармакокинетические и фармакодинамические профили.
Профили инфузионных реакций были также сходными независимо от того, вводился ли окрелизумаб в виде однократной в/в инфузии в дозе 600 мг или в виде двух отдельных инфузий по 300 мг каждая с интервалом в 2 недели (см. подраздел «Фармакокинетика» и раздел «Побочное действие»); поскольку суммарное количество инфузий было больше при введении доз по 300 мг с интервалом в 2 недели, то в этой группе общее количество инфузионных реакций было выше.
Таким образом, после введения первой дозы, в последующем рекомендуется применять 600 мг окрелизумаба в виде однократной инфузии (см. раздел «Способ применения и дозы»), чтобы снизить общее количество инфузий (при одновременной профилактической премедикации метилпреднизолоном и антигистаминным препаратом) и связанных с ними инфузионных реакций.
Таблица 3. Дизайн исследования, демографические и исходные характеристики исследования WA25046
| Название исследования | Исследование WA25046 ORATORIO (n=732) | |
| Дизайн исследования | ||
| Популяция исследования | Пациенты с ППРС | |
| Длительность исследования | Определяется на основе наступления событий (минимум 120 недель и 253 подтвержденных случая прогрессирования инвалидизации) Среднее время последующего наблюдения: окрелизумаб 3.0 года, плацебо 2.8 года |
|
| Анамнез заболевания при скрининге | Возраст 18-55 лет Оценка по шкале EDSS: 3.0-6.5 |
|
| Группы лечения | Группа А: окрелизумаб, 600 мг Группа В: плацебо, рандомизация 2:1 |
|
| Исходные характеристики | Окрелизумаб, 600 мг (n=488) | Плацебо (n=244) |
| Средний возраст (годы) | 44.7 | 44.4 |
| Возрастной диапазон (годы) при включении в исследование | 20-56 | 18-56 |
| Распределение по полу (% мужчины/% женщины) | 51.4/48.6 | 49.2/50.8 |
| Средняя/ медианная длительность с момента постановки диагноза ППРС (годы) | 2.9/1.6 | 2.8/1.3 |
| Среднее значение оценки по шкале EDSS | 4.7 | 4.7 |
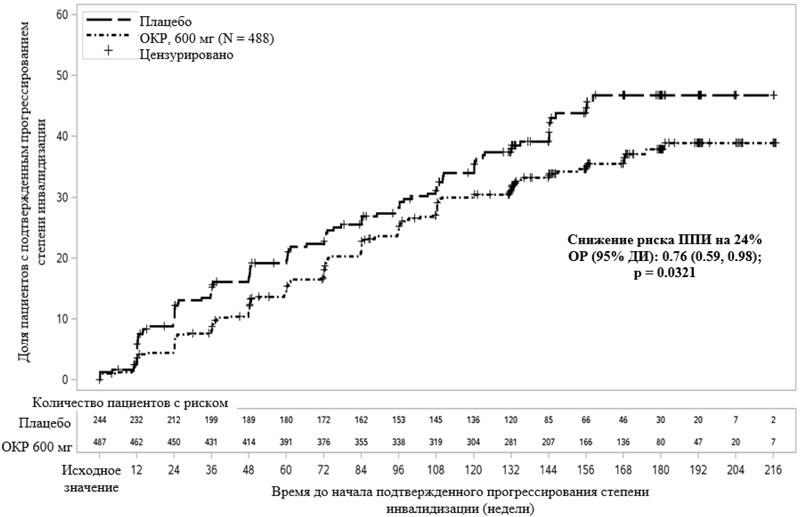
Клинические конечные точки и конечные точки по данным МРТ приведены в таблице 4 и на рисунке 2.
Результаты данного исследования показали, что окрелизумаб значимо замедляет прогрессирование заболевания и снижает ухудшение показателей скорости ходьбы в сравнении с плацебо.
Таблица 4. Клинические конечные точки и конечные точки по данным МРТ в исследовании WA25046 (ППРС)
| Конечные точки | Исследование 3 | |
| WA25046 (ORATORIO) | ||
| Окрелизумаб, 600 мг (n=488) |
Плацебо (n=244) |
|
| Клинические конечные точки | ||
| Первичная конечная точка эффективности Доля пациентов с 12-недельным подтвержденным прогрессированием инвалидизации1 (первичная конечная точка) |
30.2% | 34.0% |
| Снижение риска | 24% (p=0.0321) |
|
| Доля пациентов с 24-недельным подтвержденным прогрессированием инвалидизации1 | 28.3% | 32.7% |
| Снижение риска | 25% (p=0.0365) |
|
| Процентное изменение измеренного времени ходьбы на расстояние 25 футов с начала исследования до 120 недели | 38.9 | 55.1 |
| Относительное снижение скорости увеличения времени ходьбы | 29.4% (p=0.0404) |
|
| Конечные точки по данным МРТ | ||
| Процентное изменение объема гиперинтенсивных очагов на Т2-взвешенных изображениях с начала исследования до 120 недели | -3.4 | 7.4 |
| (p<0.0001) | ||
| Процентное изменение объема мозга с 24-й по 120-ю неделю | -0.902 | -1.093 |
| Темп относительного снижения потери объема мозга | 17.5% (p=0.0206) |
1 Определено как увеличение на ≥1.0 пункт по шкале EDSS для пациентов с исходным уровнем 5.5 или меньше, или увеличение на ≥0.5, если исходный уровень шкалы >5.5, оценка Каплана-Майера была зафиксирована на 120 неделе.
Предварительно определенный анализ первичной конечной точки в подгруппах без заданной статистической мощности позволяет предположить, что более молодые пациенты или пациенты с очагами, изначально накапливающими гадолиний-содержащее контрастное вещество на Т1-взвешенных изображениях, получают большую пользу от лечения, чем более взрослые пациенты или пациенты без очагов, накапливающими гадолиний-содержащее контрастное вещество на Т1-взвешенных изображениях (≤45 лет: ОР = 0.64 [0.45; 0.92], >45 лет: ОР = 0.88 [0.62; 1.26]; с очагами, изначально накапливающими гадолиний-содержащее контрастное вещество на Т1-взвешенных изображениях: ОР = 0.65 [0.40; 1.06]; без очагов, изначально накапливающих гадолиний-содержащее контрастное вещество на Т1-взвешенных изображениях: ОР = 0.84 [0.62; 1.13]).
Кроме того, ретроспективные анализы показали, что у более молодых пациентов с очагами, изначально накапливающими гадолиний-содержащее контрастное вещество на Т1-взвешенных изображениях, терапия более эффективна (≤45 лет: ОР = 0.52 [0.27; 1.00]; ≤46 лет [медиана возраста участников исследования WA25046]: ОР = 0.48 [0.25; 0.92]; <51 года: ОР = 0.53 [0.31; 0.89]).
Был проведен ретроспективный анализ в рамках расширенного контролируемого периода исследования, который включал в себя этап применения препарата в двойном слепом режиме и приблизительно 9 месяцев последующего контролируемого наблюдения до перехода пациентов в открытый расширенный период исследования или до завершения применения препарата в исследовании. Доля пациентов с оценкой ППИ в течение 24 недель по шкале EDSS ≥7.0 балла (24Н-ППИ EDSS ≥7.0 балла, время до начала использования инвалидного кресла) составила 9.1% в группе плацебо по сравнению с 4.8% в группе окрелизумаба на неделе 144. Таким образом, снижение риска в отношении времени до начала использования инвалидного кресла в расширенном контролируемом периоде исследования составило 47% (ОР 0.53 [0.31; 0.92]). Данные результаты носили исследовательский характер и включали данные после расслепления, поэтому их следует интерпретировать с осторожностью.
Дополнительное исследование коротких инфузий
Профиль безопасности короткой (2 часа) инфузии окрелизумаба оценивали у пациентов с рецидивирующими формами РС, не получающих БМП в проспективном многоцентровом рандомизированном, двойном слепом контролируемом дополнительном исследовании с параллельными группами MA30143 (Ensemble). Первую дозу препарата вводили в виде двух инфузий по 300 мг (всего 600 мг) с интервалом 14 дней. Пациенты были рандомизированы после получения второй дозы препарата (со 2-й по 6-ю дозу) в соотношении 1:1 в группу стандартной инфузии окрелизумаба продолжительностью приблизительно 3.5 часа каждые 24 недели или в группу короткой инфузии окрелизумаба продолжительностью приблизительно 2 часа каждые 24 недели. Рандомизация была стратифицирована по региону и дозе препарата, которую пациенты получали после первой рандомизации.
Первичной конечной точкой была доля пациентов с инфузионными реакциями, возникшими в течение 24 часов после получения первой инфузии в соответствии с рандомизацией. Первичный анализ был проведен после рандомизации 580 пациентов. Соотношение пациентов с инфузионными реакциями, развившимися во время инфузии или в течение 24 часов после первой рандомизированной инфузии составило 24.6% в группе короткой инфузии и 23.1% в группе стандартной инфузии. Разница в стратифицированных группах была сопоставимой. Во всех рандомизированных дозах большинство инфузионных реакций было легкой или средней степени тяжести, отмечалось только 2 инфузионные реакции тяжелой степени тяжести, по одной в каждой группе. Не отмечалось жизнеугрожающих, летальных или серьезных инфузионных реакций.
Иммуногенность
У пациентов, участвующих в исследованиях РС (WA21092, WA21093 и WA25046), проводили тестирование на наличие антитерапевтических антител (АТА) в нескольких временных точках (перед первым введением и каждые 6 месяцев в течение всего исследования). Из 1311 пациентов, получавших лечение окрелизумабом, положительный результат анализа на АТА отмечался у 12 пациентов (~1%), из которых у 2 пациентов положительный результат анализа отмечался на нейтрализующие антитела. Оценить влияние возникших во время лечения АТА на профиль безопасности и эффективности терапии не представляется возможным из-за низкой частоты встречаемости АТА к окрелизумабу.
Иммунизация
В рандомизированном открытом исследовании у пациентов с рецидивирующими формами РС (N = 102) доля пациентов с положительным ответом на вакцину от столбняка через 8 недель после вакцинации составляла 23.9% в группе окрелизумаба по сравнению с 54.5% в контрольной группе (без применения БМП, кроме интерферона-бета). Средние геометрические значения титров специфических антител к столбнячному анатоксину через 8 недель составляли 3.74 и 9.81 МЕ/мл, соответственно. Положительный ответ на ≥5 серотипов 23-валентной пневмококковой полисахаридной вакцины (23-PPV) через 4 недели после вакцинации составил 71.6% в группе окрелизумаба и 100% в контрольной группе. У пациентов, получавших окрелизумаб, бустерная 13-валентная пневмококковая конъюгированная вакцина (13-PCV), введенная через 4 недели после введения 23-PPV, не привела к заметному усилению ответа на 12 серотипов, общих с 23-PPV. Доля пациентов с серопротективными титрами в отношении пяти штаммов гриппа в группе окрелизумаба находилась в пределах 20.0-60.0% до вакцинации и 55.6-80.0% через 4 недели после вакцинации; в контрольной группе – 16.7-43.8% до вакцинации и 75.0-97.0% через 4 недели после вакцинации. См. разделы «Взаимодействие с другими лекарственными средствами» и «Особые указания».
Данные доклинической безопасности
Данные доклинической безопасности не выявили потенциального риска для человека на основании результатов фармакологических исследований безопасности, токсичности при многократном введении и эмбриофетального развития. Исследования канцерогенности и мутагенности окрелизумаба не проводили.
В двух исследованиях пре- и постнатального развития у яванских макак введение окрелизумаба с 20-го дня беременности, как минимум, до родов было связано с гломерулопатией, образованием лимфоидных фолликулов в костном мозге, лимфоплазмоцитарным воспалением почек и снижением массы яичек у потомства. Дозы, которые вводились беременным самкам, в данных исследованиях приводили к максимальным средним концентрациям в сыворотке (Cmax), которые были в 4.5-21 раз выше ожидаемых в клинических условиях.
Было зарегистрировано пять случаев смерти новорожденных, одна из которых была связана со слабостью из-за преждевременных родов, сопровождавшихся оппортунистической бактериальной инфекцией, другая – вследствие инфекционного менингоэнцефалита с поражением мозжечка новорожденного от матери с активной бактериальной инфекцией (мастит). В трех случаях новорожденные имели признаки желтухи и поражения печени с подозрением на вирусную этиологию, возможно, полиомавирус. Течение данных 5 подтвержденных или подозреваемых инфекций могло быть потенциально вызвано истощением В-клеток. Отмечено, что у новорожденного потомства самок, которым вводили окрелизумаб в постнатальном периоде наблюдалось истощение пула В-клеток. Измеряемый уровень окрелизумаба был обнаружен в грудном молоке (приблизительно 0.2% от уровня в сыворотке в равновесном состоянии) в течение периода лактации.
Фармакокинетика
Фармакокинетические (ФК) свойства окрелизумаба в исследованиях при РС описаны с помощью двухкамерной модели с зависимым от времени клиренсом и с использованием ФК параметров, характерных для моноклонального антитела класса IgG1.
Суммарные значения площади под кривой «концентрация-время» (AUC) в течение 24-недельных интервалов дозирования были идентичными при двукратном введении 300 мг у пациентов с ППРС и при однократном введении 600 мг препарата в исследованиях у пациентов с рецидивирующими формами РС. Значение площади под кривой «концентрация-время» за период дозирования (AUCτ) после 4-го введения окрелизумаба в дозе 600 мг составило 3510 мкг/мл·сут. Средняя максимальная концентрация (Cmax) составляла 212 мкг/мл при рецидивирующих формах РС (инфузия 600 мг) и 141 мкг/мл при ППРС (инфузия 300 мг).
Абсорбция
Окрелизумаб вводится в/в. Другие пути введения препарата не изучались.
Распределение
Согласно данным популяционной фармакокинетики рассчитанное значение центрального объема распределения составило 2.78 л. Рассчитанные значения периферического объема распределения и межкамерного клиренса составили 2.68 л и 0.294 л/сут, соответственно.
Биотрансформация
Отдельных исследований метаболизма окрелизумаба не проводилось. Как и другие антитела, окрелизумаб преимущественно подвергается катаболизму (т.е. распаду на пептиды и аминокислоты).
Элиминация
Рассчитанный показатель постоянного клиренса составил 0.17 л/сут. Первоначальный зависимый от времени клиренс составил 0.0489 л/сут с дальнейшим уменьшением при периоде полувыведения 33 недели. Терминальный период полувыведения составил 26 дней.
Фармакокинетика у особых групп пациентов
Дети
Исследований фармакокинетики окрелизумаба у детей и подростков в возрасте <18 лет не проводилось.
Лица пожилого возраста
Специальные исследования фармакокинетики окрелизумаба у пациентов ≥55 лет отсутствуют из-за ограниченного клинического опыта применения препарата в данной популяции (см. раздел «Способ применения и дозы»).
Почечная недостаточность
Отдельных исследований фармакокинетики не проводилось. Пациенты с нарушением функции почек легкой степени тяжести были включены в программу клинических исследований. Изменений фармакокинетических параметров окрелизумаба у таких пациентов не наблюдалось. Доступная информация о фармакокинетике у пациентов с нарушением функции почек средней и тяжелой степени тяжести отсутствует.
Печеночная недостаточность
Отдельных исследований фармакокинетики не проводилось. Пациенты с нарушением функции печени легкой степени тяжести были включены в клинические исследования. Изменений ФК параметров окрелизумаба у таких пациентов не наблюдалось. Доступная информация о фармакокинетике у пациентов с нарушением функции печени средней и тяжелой степени тяжести отсутствует.
Показания к применению
Препарат Окревус® показан к применению у взрослых пациентов с рецидивирующими формами рассеянного склероза с активным заболеванием, определяемым клиническими или визуализирующими признаками (см. раздел «Фармакологические свойства»).
Препарат Окревус® показан к применению у взрослых пациентов с ранним первично-прогрессирующим рассеянным склерозом в зависимости от продолжительности заболевания и уровня инвалидизации, а также с признаками воспалительной активности по данным визуализирующих исследований (см. раздел «Фармакологические свойства»).
Противопоказания
Гиперчувствительность к окрелизумабу или любому из вспомогательных веществ.
Активная инфекция (см. раздел «Особые указания»).
Тяжелый иммунодефицит (см. раздел «Особые указания»).
Установленные активные злокачественные новообразования (см. раздел «Особые указания»).
С осторожностью
Применение других БМП для лечения РС.
Применение во время беременности и в период грудного вскармливания
Женщины с детородным потенциалом
Женщины с детородным потенциалом должны использовать эффективные методы контрацепции в период лечения окрелизумабом и в течение 12 месяцев после последней инфузии препарата.
Беременность
Данные по применению окрелизумаба у беременных женщин ограничены.
Окрелизумаб предположительно проникает через плацентарный барьер, так как относится к иммуноглобулинам подтипа G1.
Следует отложить вакцинацию живыми или живыми ослабленными вакцинами у новорожденных и детей, матери которых получали окрелизумаб в ходе беременности.
Изменение числа В-клеток у новорожденных и детей, матери которых получали окрелизумаб, не изучалось в клинических исследованиях. Длительность потенциального истощения пула В-клеток у новорожденных и детей неизвестна (см. раздел «Особые указания»).
У некоторых новорожденных, матери которых получали другие антитела к CD20 во время беременности, наблюдались временное истощение пула периферических В-клеток и лимфоцитопения.
Исследования у животных (эмбриофетальная токсичность) не выявили тератогенных эффектов. Однако отмечалось истощение пула В-клеток во время внутриутробного развития. В ходе пре- и постнатальных исследований развития отмечалась репродуктивная токсичность (см. раздел «Фармакологические свойства», подраздел «Данные доклинической безопасности)».
Следует избегать применения окрелизумаба во время беременности, за исключением случаев, когда потенциальная польза для матери превышает возможный риска для плода.
Лактация
Неизвестно, выводятся ли окрелизумаб/его метаболиты с грудным молоком.
Согласно доступным данным по фармакодинамике/токсикологии, полученным у животных, окрелизумаб проникает в молоко (см. раздел «Фармакологические свойства», подраздел «Данные доклинической безопасности).
Риск для новорожденных и младенцев не может быть исключен.
Женщинам следует рекомендовать прекратить грудное вскармливание во время терапии окрелизумабом.
Фертильность
Согласно доклиническим данным, полученным в результате изучения фертильности у самцов и самок яванских макак, особых рисков для человека не выявлено.
Способ применения и дозы
Лечение следует начинать и проводить под контролем врача-специалиста, имеющего опыт в диагностике и лечении неврологических заболеваний и при наличии доступа к медицинским средствам для купирования тяжелых реакций, таких как серьезные инфузионные реакции.
Премедикация для профилактики инфузионных реакций
Перед каждым введением окрелизумаба с целью снижения частоты и тяжести инфузионных реакций следует проводить следующую двухкомпонентную премедикацию (см. раздел «Особые указания» по дополнительным шагам для снижения частоты и тяжести инфузионных реакций):
- метилпреднизолон (или эквивалентный лекарственный препарат) в дозе 100 мг в/в приблизительно за 30 минут до каждой инфузии;
- антигистаминный препарат приблизительно за 30-60 минут до каждой инфузии.
В дополнение следует рассмотреть премедикацию антипиретиком (например, парацетамолом) приблизительно за 30-60 минут до начала каждой инфузии.
Режим дозирования
Начальная доза
Начальную дозу 600 мг следует вводить в виде двух отдельных в/в инфузий: с первой инфузией вводят 300 мг препарата, затем через 2 недели вводят еще 300 мг препарата (см. таблицу 5).
Последующие дозы
Все последующие дозы окрелизумаба в дальнейшем вводятся в виде однократной в/в инфузии в дозе 600 мг каждые 6 месяцев (см. таблицу 5). Первую из последующих доз 600 мг следует проводить через 6 месяцев после 1-ой инфузии начальной дозы.
Минимальный интервал между каждым введением окрелизумаба должен составлять 5 месяцев.
Коррекция дозы при инфузионных реакциях
Жизнеугрожающие инфузионные реакции
Если во время инфузии возникли симптомы жизнеугрожающих или инвалидизирующих инфузионных реакций, такие как острая гиперчувствительность или острый респираторный дистресс-синдром, инфузию следует немедленно прекратить. Пациент должен получить соответствующее поддерживающее лечение. У таких пациентов применение окрелизумаба следует отменить и не возобновлять в дальнейшем (см. раздел «Противопоказания»).
Тяжелые инфузионные реакции
При развитии тяжелой инфузионной реакции (например, одышки) или при одновременном появлении приливов, лихорадки и боли в горле, инфузию следует немедленно прекратить. Пациенту необходимо провести симптоматическое лечение. Инфузию можно возобновить только после разрешения всех симптомов. Начальная скорость при возобновлении инфузии должна быть в два раза ниже, чем скорость инфузии на момент начала развития реакции. Для последующих инфузий коррекция дозы не требуется, за исключением случаев, когда у пациента разовьется инфузионная реакция.
Инфузионные реакции легкой или средней степени тяжести
При развитии инфузионной реакции легкой или средней степени тяжести (например, головной боли) скорость инфузии следует снизить до половины скорости на момент начала явления. Следует продолжать введение с данной сниженной скоростью в течение минимум 30 минут. В случае хорошей переносимости инфузии, скорость введения можно увеличить в соответствии с изначальным графиком. Для последующих инфузий коррекция дозы не требуется, за исключением случаев, когда у пациента разовьется инфузионная реакция.
Коррекция дозы в ходе терапии
Приведенные выше примеры прерывания инфузии или снижения ее скорости (в случае инфузионных реакций легкой/средней и тяжелой степени тяжести) приведут к изменению скорости инфузии и увеличению общей продолжительности инфузии, но не дозы. Снижение дозы окрелизумаба не рекомендуется.
Задержка или пропуск дозы
При пропуске в плановом введении окрелизумаба необходимо в кратчайшие сроки ввести препарат в рекомендуемой дозе, не дожидаясь следующего запланированного введения.
График введений окрелизумаба должен быть скорректирован с целью поддержания 6-ти месячного (минимум 5-ти месячного) интервала между введениями (см. таблицу 5).
Особые указания по дозированию
Пациенты старше 55 лет и пожилого возраста
Согласно имеющимся ограниченным данным (см. раздел «Фармакологические свойства»), у пациентов >55 лет коррекция дозы не требуется. Пациенты, включенные в текущие клинические исследования, продолжают получать окрелизумаб в дозе 600 мг каждые 6 месяцев после того, как им исполнится 55 лет.
Пациенты с нарушением функции почек
Безопасность и эффективность применения окрелизумаба у пациентов с нарушением функции почек отдельно не изучались. В клинические исследования были включены пациенты с нарушением функции почек легкой степени тяжести. Опыт применения препарата у пациентов с нарушением функции почек средней или тяжелой степени тяжести отсутствует. Так как окрелизумаб представляет собой моноклональное антитело, которое выводится путем катаболизма (распада на пептиды и аминокислоты), предполагается, что у пациентов с нарушением функции почек изменения дозы не требуется (см. раздел «Фармакологические свойства»).
Пациенты с нарушением функции печени
Безопасность и эффективность применения окрелизумаба у пациентов с нарушением функции печени отдельно не изучались. В клинические исследования были включены пациенты с нарушением функции печени легкой степени тяжести. Опыт применения препарата у пациентов с нарушением функции печени средней или тяжелой степени тяжести отсутствует. Так как окрелизумаб представляет собой моноклональное тело, которое выводится путем катаболизма (а не печеночного метаболизма), предполагается, что изменение дозы у пациентов с нарушением функции печени не требуется (см. раздел «Фармакологические свойства»).
Дети
Безопасность и эффективность окрелизумаба у детей в возрасте от 0 до 18 лет не установлены. Данные отсутствуют.
Способ применения
После разведения, препарат вводят путем в/в инфузии через отдельную инфузионную систему. Вводить препарат в/в струйно или болюсно нельзя.
Если в течение всех предыдущих инфузий окрелизумаба у пациента не отмечалось серьезных инфузионных реакций, последующие дозы препарата можно вводить более короткими (2 часа) инфузиями (см. таблицу 5, вариант 2).
Таблица 5. Схема дозирования
| Количество окрелизумаба, подлежащее введению | Инструкции по проведению инфузии | ||
| Начальная доза (600 мг), разделенная на 2 инфузии | 1-ая инфузия | 300 мг в 250 мл | — Начать инфузию со скоростью 30 мл/ч в течение 30 минут. — Затем скорость можно увеличивать с шагом 30 мл/ч каждые 30 минут до максимальной скорости 180 мл/ч. — Каждую инфузию следует проводить в течение приблизительно 2. 5 часов. |
| 2-ая инфузия (через 2 недели после первой) | 300 мг в 250 мл | ||
| Последующие дозы (600 мг) Однократная инфузия каждые 6 месяцев |
Вариант 1
Длительность приблизительно 3.5 часа |
600 мг в 500 мл | — Начать инфузию со скоростью 40 мл/ч в течение 30 минут. — Затем скорость можно увеличивать с шагом 40 мл/ч каждые 30 минут до максимальной скорости 200 мл/ч. — Каждую инфузию следует проводить в течение приблизительно 3.5 часов. |
| или | |||
| Вариант 2
Длительность приблизительно 2 часа |
600 мг в 500 мл | — Начать инфузию со скоростью 100 мл/ч в течение первых 15 минут. — Увеличить скорость до 200 мл/ч в течение следующих 15 минут. — Увеличить скорость до 250 мл/ч в течение следующих 30 минут. — Увеличить скорость до 300 мл/ч в течение оставшихся 60 минут. — Каждую инфузию следует проводить в течение приблизительно 2 часов. |
За пациентами необходимо наблюдать во время инфузии и, как минимум, в течение одного часа после завершения инфузии на предмет возникновения симптомов инфузионных реакций.
Правила приготовления и хранения раствора для инфузий
Подготовка препарата к введению должна проводиться медицинским специалистом в асептических условиях.
Не встряхивать.
Следует использовать стерильную иглу и шприц для приготовления раствора для инфузий окрелизумаба.
Препарат предназначен только для однократного использования.
Концентрат нельзя использовать при изменении окраски или при наличии дискретных посторонних включений.
Лекарственный препарат следует развести перед применением. Чтобы приготовить раствор для в/в введения, концентрат препарата Окревус® следует развести в инфузионном пакете, содержащем 0.9% раствор натрия хлорида в соотношениях 300 мг/250 мл или 600 мг/500 мл. Концентрация готового раствора должна составлять примерно 1.2 мг/мл.
Введение раствора должно проводиться с использованием инфузионной системы со встроенным фильтром с диаметром пор 0.2 или 0.22 микрон.
Непосредственно перед инфузией содержимое инфузионного пакета должно иметь комнатную температуру.
Была показана химическая и физическая стабильность в ходе использования в течение 24 часов при температуре 2-8 °C и далее 8 часов при комнатной температуре.
С точки зрения микробиологической чистоты раствор для инфузии следует использовать сразу после приготовления. Если готовый раствор не был использован сразу после приготовления, то он может храниться не более 24 часов при температуре 2-8 °С и далее 8 часов при комнатной температуре при условии, что разведение проводилось в валидированных асептических условиях.
Если инфузию не удается завершить в указанный период, оставшийся в инфузионном пакете раствор следует уничтожить.
Утилизация
Весь оставшийся лекарственный препарат и отходы следует уничтожить в соответствии с установленными национальным законодательством требованиями.
Совместимость
Не было обнаружено признаков несовместимости с инфузионными пакетами из поливинилхлорида или полиолефина и системами для в/в введения.
Для разведения препарата Окревус® следует использовать только 0.9% раствор натрия хлорида. Разводить препарат в других растворителях нельзя.
Побочное действие
Резюме профиля безопасности
Наиболее важными и частыми нежелательными реакциями (НР) были инфузионные реакции (34.3% при рецидивирующих формах РС и 40.1% при ППРС) и инфекции (58.5% при рецидивирующих формах РС и 72.2% при ППРС) (см. раздел «Особые указания»).
Табличное резюме нежелательных реакций
В Таблице 6 представлены данные о НР, которые наблюдались в клинических исследованиях окрелизумаба, а также были получены из спонтанных сообщений. НР сгруппированы в соответствии с системно-органной классификацией медицинского словаря для нормативно-правовой деятельности MedDRA и категорией частоты. Для описания частоты НР используется следующая классификация: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000) и частота неизвестна (на основании имеющихся данных оценить невозможно). Внутри каждого системно-органного класса НР представлены в порядке уменьшения частоты возникновения.
Таблица 6. Нежелательные реакции
| Системно-органный класс по MedDRA | Очень часто | Часто | Частота неизвестна2 |
| Инфекции и инвазии | Инфекции верхних дыхательных путей, назофарингит, грипп | Синусит, бронхит, герпес полости рта, гастроэнтерит, инфекции дыхательных путей, вирусные инфекции, опоясывающий лишай (Herpes zoster), конъюнктивит, воспаление подкожно-жировой клетчатки | |
| Нарушения со стороны крови и лимфатической системы | Нейтропения | Отсроченная нейтропения2 | |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Кашель, катаральные явления | ||
| Лабораторные и инструментальные данные | Снижение уровня иммуноглобулина М | Снижение уровня иммуноглобулина G | |
| Травмы, интоксикации и осложнения процедур | Инфузионные реакции1 |
1 См. подраздел «Описание отдельных нежелательных реакций»
2 Зарегистрировано в пострегистрационном периоде, на основании имеющихся данных частоту оценить невозможно
Описание отдельных нежелательных реакций
Инфузионные реакции
В исследованиях при рецидивирующих формах РС и ППРС наблюдались следующие симптомы, связанные с инфузионными реакциями, включая, но не ограничиваясь: зуд, сыпь, крапивница, эритема, приливы, понижение артериального давления, пирексия, повышенная утомляемость, головная боль, головокружение, раздражение горла, боль в ротоглотке, одышка, отек глотки или гортани, тошнота, тахикардия. В контролируемых клинических исследованиях случаев летальных инфузионных реакций не было. Кроме того, симптомы инфузионных реакций в пострегистрационном периоде включали анафилаксию.
В клинических исследованиях, контролируемых активным препаратом, при рецидивирующих формах РС, инфузионные реакции были самыми частыми нежелательными реакциями на фоне терапии окрелизумабом. Общие частоты инфузионных реакций составили 34.3% и 9.9% на фоне лечения окрелизумабом и интерфероном бета-1а, соответственно. Частота инфузионных реакций была максимальной во время 1-ой инфузии 1-ой дозы окрелизумаба (27.5%) и снижалась со временем до <10% во время введения 4-ой дозы. Большинство инфузионных реакций в обеих группах лечения были легкой или средней степени тяжести. У 21.7% и 10.1% пациентов, получавших окрелизумаб, наблюдались инфузионные реакции легкой и средней степени тяжести, соответственно; у 2.4% – инфузионные реакции тяжелой степени тяжести и у 0.1% – жизнеугрожающие.
В плацебо-контролируемом клиническом исследовании при ППРС инфузионные реакции были самыми частыми нежелательными реакциями на фоне терапии окрелизумабом с общей частотой 40.1% по сравнению с частотой 25.5% в группе плацебо. Частота инфузионных реакций была максимальной во время 1-ой инфузии 1-ой дозы окрелизумаба (27.4%) и снижалась при введении последующих доз до <10% во время введения 4-ой дозы. У большинства пациентов в обеих группах инфузионные реакции чаще развивались во время первой инфузии каждой дозы по сравнению со второй инфузией этой дозы. Большинство инфузионных реакций были легкой или средней степени тяжести. У 26.7% и 11.9% пациентов, получавших окрелизумаб, наблюдались инфузионные реакции легкой и средней степени тяжести, соответственно; у 1.4% – инфузионные реакции тяжелой степени тяжести. Жизнеугрожающих инфузионных реакций отмечено не было. См. раздел «Особые указания».
Альтернативные короткие инфузии последующих доз
В ходе исследования (MA30143 под-исследование коротких инфузий), которое было разработано для оценки профиля безопасности при проведении коротких (2 часа) инфузий окрелизумаба у пациентов с рецидивирующими формами РС частота, тяжесть и характер симптомов инфузионных реакций были сопоставимы с таковыми при проведении инфузий в течение 3.5 часов (см. раздел «Фармакологические свойства»). Общее количество необходимых вмешательств было низким в обеих группах, однако в группе коротких инфузий (2 часа) потребовалось больше вмешательств (снижение скорости или приостановка инфузии) для контроля инфузионных реакций по сравнению с группой с инфузией длительностью 3.5 часа (8.7% и 4.8%, соответственно).
Инфекции
В клинических исследованиях, контролируемых активным препаратом, инфекции наблюдались у 58.5% пациентов, получавших окрелизумаб, по сравнению с 52.5% пациентов, получавших интерферон бета-1а. Частота серьезных инфекций составила 1.3% и 2.9% у пациентов, получавших окрелизумаб и интерферон бета-1а, соответственно. В плацебо-контролируемом исследовании у пациентов с ППРС инфекции были зарегистрированы у 72.2% пациентов, получавших окрелизумаб, и у 69.9% пациентов, получавших плацебо. Частота серьезных инфекций составила 6.2% и 6.7% у пациентов, получавших окрелизумаб и плацебо, соответственно. Всех пациентов перевели на терапию окрелизумабом в открытом периоде исследований при рецидивирующих формах РС и ППРС. Увеличение числа серьезных инфекций наблюдалось у пациентов с рецидивирующими формами РС между 2 и 3 годами наблюдения, но не в последующие годы. У пациентов с ППРС увеличения не наблюдалось.
Инфекции дыхательных путей
Доля инфекций дыхательных путей была выше у пациентов, получавших окрелизумаб, по сравнению с интерфероном бета-1а и плацебо.
В клинических исследованиях при рецидивирующих формах РС инфекции верхних дыхательных путей наблюдались у 39.9% пациентов, получавших окрелизумаб, и у 33.2% пациентов, получавших интерферон бета-1a; инфекции нижних дыхательных путей – у 7.5% пациентов, получавших окрелизумаб, и 5.2% пациентов, получавших интерферон бета-1а.
В клиническом исследовании при ППРС инфекции верхних дыхательных путей наблюдались у 48.8% пациентов, получавших окрелизумаб, и у 42.7% пациентов, получавших плацебо; инфекции нижних дыхательных путей – у 9.9% пациентов, получавших окрелизумаб, и у 9.2% пациентов, получавших плацебо.
Инфекции дыхательных путей, которые отмечались у пациентов, получавших окрелизумаб, были в основном легкой и средней степени тяжести (80-90%).
Герпес
В клинических исследованиях, контролируемых активным препаратом, у пациентов с рецидивирующими формами РС частота герпетической инфекции была выше на фоне терапии окрелизумабом по сравнению с терапией интерфероном бета-1а. В группах окрелизумаба и интерферона бета-1а частоты следующих нежелательных реакций составляли: опоясывающий лишай (Herpes Zoster) 2.1% и 1.0%, простой герпес 0.7% и 0.1%, герпес полости рта 3.0% и 2.2%, генитальный герпес 0.1% и 0% и герпес-вирусная инфекция 0.1% и 0%, соответственно.
Все инфекции были преимущественно легкой и средней степеней тяжести (за исключением одного явления 3 степени тяжести), и пациенты выздоравливали после стандартного лечения.
В плацебо-контролируемом клиническом исследовании у пациентов с ППРС герпес полости рта возникал с частотой 2.7% и 0.8% на фоне лечения окрелизумабом и в группе плацебо, соответственно.
Изменения лабораторных показателей
Иммуноглобулины
Во время лечения окрелизумабом отмечалось снижение общей концентрации иммуноглобулинов, в основном за счет снижения уровня иммуноглобулина М (IgM). Данные клинических исследований показали очевидную связь между снижением уровня иммуноглобулинов IgG (и в меньшей степени иммуноглобулинов IgA или IgM) и развитием серьезных инфекций.
Лимфоциты
При рецидивирующих формах РС уменьшение числа лимфоцитов ниже НГН наблюдалось у 20.7% пациентов, получавших окрелизумаб, по сравнению с 32.6% пациентов, получавших интерферон бета-1а. При ППРС уменьшение числа лимфоцитов ниже НГН наблюдалось у 26.3% пациентов, получавших окрелизумаб, по сравнению с 11.7% пациентов, получавших плацебо.
Большинство изменений, зарегистрированных у пациентов, получавших окрелизумаб, были 1-й (<НГН – 800 клеток/мм³) и 2-й (500-800 клеток/мм³) степеней тяжести.
Приблизительно у 1% пациентов в группе окрелизумаба была лимфопения 3-й степени тяжести (200-500 клеток/мм³). Ни у одного из пациентов не была зарегистрирована лимфопения 4-й степени тяжести (<200 клеток/мм³).
Повышенная частота серьезных инфекций наблюдалась во время подтвержденного снижения числа лимфоцитов у пациентов, получавших окрелизумаб. Количество серьезных инфекций было недостаточным для установления причинно-следственной связи.
Нейтрофилы
В клинических исследованиях, контролируемых активным препаратом, у пациентов с рецидивирующими формами РС, получавших окрелизумаб, уменьшение числа нейтрофилов <НГН наблюдалось реже (14.7%), по сравнению с пациентами, получавшими интерферон бета-1а (40.9%). В плацебо-контролируемом клиническом исследовании у пациентов с ППРС, получавших лечение окрелизумабом, уменьшение числа нейтрофилов наблюдалось несколько чаще (12.9%), по сравнению с пациентами, получавшими плацебо (10.0%); у большего количества пациентов (4.3%), получавших окрелизумаб, нейтропения была ≥2 степени тяжести по сравнению с 1.3% пациентов, получавших плацебо. Примерно у 1% пациентов, получавших окрелизумаб, была нейтропения 4-й степени тяжести по сравнению с 0% в группе, получавшей плацебо.
В большинстве случаев уменьшение числа нейтрофилов на фоне терапии окрелизумабом было транзиторным, отмечалось однократно в ходе терапии и имело 1-ую (<НГН – 1500 клеток/мм³) или 2-ую степень тяжести (1000-1500 клеток/мм³). Нейтропения 3-ей или 4-ой степени тяжести наблюдалась приблизительно у 1% пациентов. Одному пациенту с нейтропенией 3-й степени тяжести (500-1000 клеток/мм³) и одному пациенту с нейтропенией 4-й степени тяжести (<500 клеток/мм³) потребовалась специфическая терапия гранулоцитарным колониестимулирующим фактором; после данного эпизода пациенты продолжили получать окрелизумаб. Нейтропения может развиваться спустя несколько месяцев после завершения терапии (см. раздел «Особые указания»).
Прочее
Сообщалось об одном летальном исходе вследствие развития синдрома системного воспалительного ответа (SIRS) неизвестной этиологии у пациента, получившего окрелизумаб в дозе 2000 мг. SIRS развился через 12 недель после последней инфузии окрелизумаба, после проведения МРТ с использованием гадолиний-содержащего контрастного вещества, анафилактоидная реакция на которое могла способствовать развитию SIRS.
Передозировка
Опыт превышения рекомендованной дозы окрелизумаба в клинических исследованиях ограничен. Максимальная изученная доза на данный момент составляет 2000 мг в виде двух в/в инфузий по 1000 мг с интервалом в 2 недели (исследование II фазы по подбору доз при рецидивирующих формах РС), при этом наблюдавшиеся нежелательные реакции соответствовали установленному профилю безопасности окрелизумаба в опорных клинических исследованиях.
Специфического антидота в случае передозировки не существует; необходимо немедленно прекратить инфузию и наблюдать за пациентом на предмет развития инфузионных реакций (см. раздел «Особые указания»).
Взаимодействие с другими лекарственными средствами
Исследований взаимодействия с другими лекарственными средствами не проводилось, поскольку взаимодействий, связанных с активностью изоферментов цитохрома Р450 и других метаболизирующих ферментов или транспортеров, не ожидается.
Вакцинация
Безопасность иммунизации живыми или живыми ослабленными вирусными вакцинами после терапии окрелизумабом не изучали.
Имеются данные об эффектах столбнячного анатоксина, 23-валентного пневмококкового полисахарида, KLH-неоантигену (keyhole limpet hemocyanin, KLH) и сезонных вакцин против гриппа у пациентов, получающих окрелизумаб (см. разделы «Особые указания» и «Фармакологические свойства»).
После терапии окрелизумабом в течение 2 лет доля пациентов с положительными титрами антител к S. pneumoniae, возбудителям эпидемического паротита, краснухи и ветряной оспы была в целом сходна с таковой на исходном уровне.
Иммунодепрессанты
Не рекомендуется одновременное применение других иммунодепрессантов, за исключением глюкокортикостероидов для симптоматического лечения рецидивов РС (см. раздел «Особые указания»).
Особые указания
Прослеживаемость
Для улучшения прослеживаемости биологических лекарственных препаратов следует фиксировать наименование препарата и номер серии.
Инфузионные реакции
Развитие инфузионных реакций у пациентов, получающих окрелизумаб, может быть связано с высвобождением цитокинов и/или других химических медиаторов.
Симптомы инфузионных реакций могут развиться во время любой инфузии, но наиболее часто они отмечались во время первого введения окрелизумаба.
Инфузионные реакции также могут развиться в течение 24 часов после инфузии (см. раздел «Побочное действие»).
Симптомами инфузионных реакций могут быть зуд, сыпь, крапивница, эритема, раздражение горла, боль в ротоглотке, одышка, отек глотки или гортани, приливы, понижение артериального давления, пирексия, повышенная утомляемость, головная боль, головокружение, тошнота, тахикардия и анафилаксия.
Перед инфузией
Контроль тяжелых реакций
Введение препарата проводится при наличии доступа к средствам для оказания экстренной помощи в случае возникновения тяжелых реакций, таких как серьезные инфузионные реакции, реакции гиперчувствительности и/или анафилактические реакции.
Понижение артериального давления
Во время инфузий окрелизумаба возможно понижение артериального давления как симптома инфузионных реакций. В связи с этим следует рассмотреть возможность приостановки лечения антигипертензивными препаратами в течение 12 часов до начала и на протяжении каждой инфузии. У пациентов с застойной сердечной недостаточностью (класс III и IV по классификации Нью-Йоркской Ассоциации по изучению заболеваний сердца) в анамнезе применение окрелизумаба не изучалось.
Премедикация
Рекомендации по премедикации для снижения частоты и тяжести инфузионных реакций приведены в разделе «Способ применения и дозы». Во время инфузии
При развитии тяжелых симптомов со стороны дыхательной системы (таких как бронхоспазм или эпизод обострения бронхиальной астмы):
- инфузия должна быть немедленно прекращена; продолжать терапию в дальнейшем нельзя;
- необходимо провести симптоматическое лечение;
- пациент должен находиться под наблюдением до полного разрешения симптомов со стороны дыхательной системы, поскольку за первоначальным улучшением клинических симптомов может последовать их ухудшение.
Реакции гиперчувствительности может быть сложно отличить от инфузионных реакций с точки зрения симптомов. При подозрении на развитие реакции гиперчувствительности во время инфузии необходимо немедленно прекратить инфузию и не возобновлять в дальнейшем (см. подраздел «Реакции гиперчувствительности» ниже).
После инфузии
За пациентами необходимо тщательно наблюдать на предмет возникновения симптомов инфузионных реакций, как минимум, в течение одного часа после завершения инфузии. Врач должен предупредить пациента о том, что развитие инфузионных реакций возможно в течение 24 часов после инфузии.
Рекомендации по коррекции инфузии препарата пациентам, у которых развились инфузионные реакции, приведены в разделе «Способ применения и дозы».
Реакции гиперчувствительности
Также возможно развитие реакции гиперчувствительности (острая аллергическая реакция на препарат). Реакции острой гиперчувствительности 1-го типа (опосредованных IgE) могут быть клинически неотличимы от симптомов инфузионных реакций.
Реакции гиперчувствительности могут возникнуть во время любой инфузии, однако, как правило, они отсутствуют во время первой инфузии. Если в ходе последующих инфузий усугубляются ранее наблюдавшиеся симптомы или возникают новые тяжелые симптомы, необходимо немедленно рассмотреть вероятность развития реакции гиперчувствительности. Пациентам с установленной IgE-опосредованной гиперчувствительностью к окрелизумабу противопоказана терапия данным препаратом (см. раздел «Противопоказания»).
Инфекции
У пациентов с активной инфекцией применение окрелизумаба следует отложить до купирования инфекции.
Перед применением препарата рекомендуется проверить иммунный статус пациента, так как препарат не следует применять у пациентов с тяжелым иммунодефицитом (например, при лимфопении, нейтропении, гипогаммаглобулинемии) (см. разделы «Противопоказания» и «Побочное действие»).
Общая доля пациентов, перенесших серьезную инфекцию, была сопоставима с таковой в группе сравнения (см. раздел «Побочное действие»). Частота инфекций 4-й (жизнеугрожающей) степени тяжести и 5-й (летальной) степени тяжести была низкой во всех группах лечения, но у пациентов с ППРС она была выше при применении окрелизумаба по сравнению с плацебо: жизнеугрожающие инфекции (1.6% в сравнении с 0.4%) и летальные инфекции (0.6% в сравнении с 0%). Все жизнеугрожающие инфекции разрешились без прекращения применения окрелизумаба.
Пациенты с ППРС, имеющие трудности с глотанием, подвержены повышенному риску развития аспирационной пневмонии. Лечение окрелизумабом может увеличить риск развития тяжелой пневмонии у таких пациентов. Врачи должны предпринимать незамедлительные меры для пациентов с пневмонией.
Прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ)
JC-ассоциированная ПМЛ очень редко наблюдалась у пациентов, получавших терапию антителами к CD20, включая окрелизумаб. Развитие JC-ассоциированной ПМЛ в большинстве случаев было связано с различными факторами риска (популяция пациентов, например, наличие лимфопении, пожилой возраст, терапия несколькими иммунодепрессантами).
Необходимо наблюдать за пациентами на предмет развития ранних признаков и симптомов ПМЛ, которые могут быть сходны с проявлениями РС и могут включать в себя появление любых новых или ухудшение уже имеющихся неврологических признаков и симптомов.
При подозрении на ПМЛ следует приостановить терапию окрелизумабом. Необходимо рассмотреть вопрос о проведении диагностики ПМЛ, в том числе МРТ, предпочтительно с использованием контрастного вещества (сравнить с результатом МРТ, выполненной до лечения), определение ДНК вируса JC в спинномозговой жидкости и повторные осмотры невролога.
При подтверждении диагноза ПМЛ следует полностью прекратить лечение.
Реактивация гепатита B
У пациентов, получавших лечение антителами к CD20, сообщалось о реактивации вируса гепатита В, в некоторых случаях приводившей к развитию фульминантного гепатита, печеночной недостаточности, летальному исходу.
Перед назначением окрелизумаба всем пациентам следует пройти скрининг на вирус гепатита B в соответствии с локальными руководствами. Окрелизумаб не следует применять пациентам с активным вирусом гепатита B (активная инфекция должна быть подтверждена положительными результатами определения поверхностного антигена (HBsAg) и антител к антигенам вируса гепатита B (HBcAb)) (см. раздел «Противопоказания»).
Пациентам с положительными серологическими маркерами гепатита B (отрицательный результат анализа на HBsAg и положительный результат на HBcAb), а также носителям вируса гепатита B (положительный результат на HBsAg), следует проконсультироваться с гепатологом перед назначением окрелизумаба.
В отношении таких пациентов необходимо проводить соответствующий мониторинг и принимать меры по профилактике реактивации вируса гепатита B в соответствии с локальными стандартами.
Отсроченная нейтропения
Сообщалось о случаях отсроченной нейтропении, как минимум, через 4 недели после последней инфузии окрелизумаба (см. раздел «Побочное действие»). Хотя в некоторых случаях развивалась нейтропения 3-ей или 4-й степени тяжести, в большинстве случаев наблюдалась 1-ая или 2-ая степень тяжести. У пациентов с признаками и симптомами инфекции рекомендуется провести анализ числа нейтрофилов в крови (см. раздел «Побочное действие»).
Малигнизация
В клинических исследованиях наблюдалось увеличение числа злокачественных новообразований (включая рак молочной железы) у пациентов, получавших окрелизумаб, по сравнению с контрольными группами. Заболеваемость была в пределах фонового уровня, ожидаемого для популяции пациентов с РС. Пациентам с установленным активным злокачественным образованием не следует проводить лечение окрелизумабом (см. раздел «Противопоказания»). У пациентов с известными факторами риска злокачественных новообразований и у пациентов, которые находятся под активным контролем на предмет рецидивов злокачественных новообразований, следует проводить индивидуальную оценку соотношения пользы и риска. Пациенты должны следовать стандартным рекомендациям по скринингу рака молочной железы.
В контролируемом периоде клинических исследований частота немеланомного рака кожи была низкой, и между группами лечения не было дисбаланса по этому показателю. Увеличение заболеваемости наблюдалось между 3 и 4 годами лечения за счет базальноклеточного рака, без дисбаланса между группами в последующие годы. Частота новых случаев была в пределах фонового уровня, ожидаемого в популяции пациентов с РС.
Лечение пациентов с тяжелым иммунодефицитом
Пациенты с тяжелым иммунодефицитом не должны получать терапию до тех пор, пока их состояние не разрешится (см. раздел «Противопоказания»).
При других аутоиммунных состояниях применение окрелизумаба одновременно с иммунодепрессантами (например, глюкокортикостероидами в течение длительного периода, болезнь-модифицирующими антиревматическими препаратами небиологического и биологического происхождения, микофенолата мофетилом, циклофосфамидом, азатиоприном) приводило к увеличению числа серьезных инфекций, включая оппортунистические. Инфекции включали, помимо прочих, атипичную и пневмоцистную пневмонию, ветряночную пневмонию, туберкулез и гистоплазмоз. В редких случаях некоторые из этих инфекций приводили к летальному исходу. Поисковый анализ выявил следующие факторы, связанные с риском серьезных инфекций: более высокие дозы окрелизумаба, чем рекомендовано для РС, другие сопутствующие заболевания и длительное применение иммунодепрессантов/глюкокортикостероидов.
Не рекомендуется применять другие иммунодепрессанты одновременно с окрелизумабом, за исключением глюкокортикостероидов для симптоматического лечения рецидивов РС. Данные о связи одновременного применения стероидов для симптоматического лечения рецидивов с повышенным риском инфекций в клинической практике ограничены. В опорных исследованиях окрелизумаба при РС назначение глюкокортикостероидов для лечения рецидивов не было связано с повышением риска серьезной инфекции.
Назначать терапию окрелизумабом после иммунодепрессивной терапии или иммунодепрессивную терапию после терапии окрелизумабом следует с учетом того, что возможно перекрывание их фармакодинамических эффектов (см. раздел «Фармакологические свойства»).
При назначении окрелизумаба следует соблюдать осторожность, принимая во внимание фармакодинамику других БМП для лечения РС.
Вакцинация
Безопасность иммунизации живыми или живыми ослабленными вакцинами после терапии окрелизумабом не изучалась.
Во время терапии окрелизумабом, а также до восстановления пула В-клеток проводить вакцинацию живыми или живыми ослабленными вакцинами не рекомендуется. В клинических исследованиях медиана времени восстановления В-клеток в клинических исследованиях составила 72 недели (см. раздел «Фармакологические свойства»).
В ходе рандомизированного открытого исследования у пациентов с рецидивирующими формами РС, получающих окрелизумаб, отмечался пониженный гуморальный иммунный ответ к столбнячному анатоксину, 23-валентному пневмококковому полисахариду с бустерной вакциной или без таковой, KLH-неоантигену и сезонной вакцине против гриппа (см. разделы ««Фармакологические свойства» и «Взаимодействие с другими лекарственными средствами»). Тем не менее, пациентам, получающим окрелизумаб, рекомендуется проводить сезонную вакцинацию против гриппа инактивированной вакциной.
Перед назначением окрелизумаба врач должен изучить статус иммунизации пациента. В случае проведения вакцинации ее необходимо завершить, по меньшей мере, за 6 недель до начала лечения окрелизумабом.
Внутриутробная экспозиция окрелизумаба и вакцинация новорожденных и детей живыми и живыми ослабленными вакцинами
Из-за потенциального истощения пула В-клеток у новорожденных и детей, матери которых получали окрелизумаб во время беременности, рекомендуется рассмотреть возможность отсрочки вакцинации живыми или живыми ослабленными вакцинами до восстановления пула В-клеток; перед проведением вакцинации новорожденных и детей рекомендуется измерять уровень CD19+ В-клеток.
Все вакцинации, за исключением вакцинации живыми и живыми ослабленными вакцинами, рекомендуется проводить согласно национальному графику иммунизации. Измерение титра антител после вакцинации позволяет проверить способность пациента развить защитный иммунный ответ, так как эффективность вакцинации может быть снижена.
Безопасность и сроки проведения вакцинации следует обсудить с педиатром (см. раздел «Применение во время беременности и в период грудного вскармливания»).
Натрий
Данный препарат содержит менее 1 ммоль (или 23 мг) натрия на дозу препарата, то есть по сути не содержит натрия.
Влияние на способность управлять транспортными средствами и механизмами
Препарат Окревус® не оказывает или оказывает несущественное влияние на способность управлять автомобилем и работать с механизмами.
Форма выпуска
Концентрат для приготовления раствора для инфузий 30 мг/мл
По 10 мл (300 мг/10 мл) препарата во флакон бесцветного стекла (гидролитический класс 1 ЕФ), укупоренный пробкой из бутилкаучука, ламинированного фторполимером, обжатый алюминиевым колпачком и закрытый пластмассовой крышкой.
1 флакон с препаратом вместе с инструкцией по применению помещают в картонную пачку. С целью контроля первого вскрытия на пачку наносится защитная голографическая наклейка.
В случае упаковки на АО «ОРТАТ»: с целью контроля первого вскрытия на пачку наклеивают самоклеящиеся стикеры с логотипом АО «ОРТАТ».
Срок годности
2 года.
Не применять по истечении срока годности.
Условия хранения
Хранить при температуре 2-8 °С в картонной пачке для защиты от света.
Хранить в недоступном для детей месте.
Условия отпуска
По рецепту.
Владелец Регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland
Производитель
Рош Диагностикс ГмбХ, Германия
Roche Diagnostics GmbH, Sandhofer Strasse 116, 68305 Mannheim, Germany
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Wurmisweg, 4303 Kaiseraugst, Switzerland
Фасовщик (первичная упаковка)
Рош Диагностикс ГмбХ, Германия
Roche Diagnostics GmbH, Sandhofer Strasse 116, 68305 Mannheim, Germany
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Wurmisweg, 4303 Kaiseraugst, Switzerland
Упаковщик (вторичная/потребительская упаковка)
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Wurmisweg, 4303 Kaiseraugst, Switzerland
АО «ОРТАТ», Россия
157092, Россия, Костромская обл., Сусанинский район, с. Северное, мкр. Харитоново
Выпускающий контроль качества
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Wurmisweg, 4303 Kaiseraugst, Switzerland
АО «ОРТАТ», Россия
157092, Россия, Костромская обл., Сусанинский район, с. Северное, мкр. Харитоново
Организация, уполномоченная на принятие претензий от потребителя
Претензии потребителей направлять в компанию АО «Рош-Москва» по адресу:
107031, Россия, г. Москва, Трубная площадь, д. 2, помещение 1, этаж 1, комната 42 или через форму обратной связи на сайте: www.roche.ru
В случае упаковки на АО «ОРТАТ» претензии потребителей направлять по адресу:
157092, Россия, Костромская обл., Сусанинский район, с. Северное, мкр. Харитоново
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Препарат Окревус показан для лечения взрослых пациентов с рецидивирующими формами рассеянного склероза (РРРС).
Препарат Окревус показан для лечения взрослых пациентов с первично-прогрессирующим рассеянным склерозом (ППРС) для замедления прогрессирования заболевания и снижения ухудшения показателей скорости ходьбы.
Режим дозирования и способ применения
Лечение пациента с рассеянным склерозом препаратом Окревус должно быть начато и проводиться под наблюдением опытного невролога.
Инфузию препарата Окревус следует производить под непосредственным и тщательным контролем опытного медицинского персонала.
Соответствующее медицинское оборудование, включая доступ к оборудованию для оказания экстренной помощи, а также лекарственные средства, такие как эпинефрин (адреналин), антигистаминные препараты и глюкокортикоиды, должны иметься в распоряжении для немедленного использования при возникновении тяжелых нежелательных явлений, например, тяжелых инфузионных или аллергических реакций.
У пациентов, у которых развиваются тяжелые симптомы со стороны дыхательной системы, такие как бронхоспазм или обострение астмы, инфузию следует немедленно прекратить. Продолжать терапию окрелизумабом в дальнейшем нельзя. После проведения симптоматического лечения пациент должен находиться под наблюдением до полного исчезновения симптомов co стороны дыхательной системы, т. к. после первоначального улучшения клинических симптомов может наступить ухудшение.
Во время инфузии препарата Окревус может возникнуть артериальная гипотензия как симптом инфузионной реакции. Поэтому следует рассмотреть прерывание антигипертензивного лечения в течение 12 часов до начала и на протяжении каждой инфузии препарата Окревус. Окревус вводится внутривенно капельно через отдельный внутривенный катетер. Окревус нельзя вводить внутривенно струйно или болюсно, а также в неразведенном состоянии.
В качестве инфузионной среды используется изотонический (0.9%-ный) раствор натрия хлорида. Если внутривенная инфузия не может быть завершена в тот же день, оставшаяся жидкость в инфузионном флаконе должна быть утилизирована (см. «Условия хранения» и «Указания при работе или уничтожении препарата»).
Все пациенты должны находиться под наблюдением в течение минимум одного часа после окончания инфузии (см. разделы «Особые указания и меры предосторожности при применении» и «Инфузионные реакции»).
Для обеспечения прослеживаемости биологических лекарственных средств следует точно записывать (или указывать) в медицинской карте пациента торговое наименование и номер серии препарата Окревус для каждого введения.
Премедикация для снижения возможных инфузионных реакций
Перед каждой инфузией препарата Окревус необходимо вводить следующие два препарата, чтобы снизить частоту и тяжесть инфузионных реакций (см. раздел «Особые указания и меры предосторожности при применении»):
100 мг метилпреднизолона внутривенно (или эквивалент) примерно за 30 минут перед каждой инфузией препарата Окревус;
Антигистаминное средство за 30-60 минут перед каждой инфузией препарата Окревус.
Можно также рассмотреть вопрос о назначении дополнительно жаропонижающих средств (например, парацетамол), примерно за 30-60 минут перед каждой инфузией препарата Окревус.
Введение препарата Окревус
Начальная доза
Начальная доза (доза 1) 600 мг вводится в виде двух отдельных внутривенных инфузий по 300 мг с интервалом в две недели.
Последующие дозы
Последующие дозы препарата Окревус вводятся каждые 6 месяцев в виде однократной дозы 600 мг посредством внутривенной инфузии (см. Таблицу 1).
Между отдельными полными дозами препарата Окревус следует соблюдать минимальный перерыв 5 месяцев.
Таблица 1. Схема дозирования препарата Окревус
| Вводимая доза препарата Окревус | Инструкции по проведению инфузии | ||
| Начальная доза (600 мг), разделенная на 2 инфузии | Инфузия 1 | 300 мг в 250 мл | Начинать инфузию со скоростью 30 мл/ч.Затем скорость можно увеличивать каждые 30 минут на 30 мл/ч до максимальной скорости 180 мл/ч.Каждую инфузию следует проводить приблизительно в течение 2.5 ч. |
| Инфузия 2 (спустя 2 недели после первой) | 300 мг в 250 мл | ||
| Последующие дозы** (600 мг) однократно каждые 6 месяцев | Однократная инфузия | 600 мг в 500 мл | Начинать инфузию со скоростью 40 мл/ч.Затем скорость можно увеличивать каждые 30 минут на 40 мл/ч до максимальной скорости 200 мл/ч.Каждую инфузию следует проводить приблизительно в течение 3.5 ч. |
*Растворы для внутривенной инфузии готовят посредством разведения концентрата препарата Окревус в инфузионном флаконе с 0.9% натрия хлорида до концентрации готового раствора примерно 1.2 мг/мл.
** Первую последующую однократную инфузию следует вводить спустя 6 месяцев после инфузии 1 начальной дозы.
Дозы, принятые с опозданием или пропущенные дозы
При пропуске в плановом введении препарата Окревус необходимо в кратчайшие сроки ввести препарат в рекомендуемой дозе, не дожидаясь следующего запланированного введения. Следует соблюдать интервал между однократными дозами при лечении препаратом Окревус.
Коррекция дозы в процессе лечения
Коррекция дозы препарата Окревус не исследовалась и не рекомендована при нормальной переносимости.
Инфузионные реакции
Лечение препаратом Окревус ассоциировано с инфузионными реакциями, которые могут быть обусловлены высвобождением цитокинов и/или других медиаторов. В случае возникновения инфузионных реакций, необходимо следовать указаниям, приведенным ниже. С более подробной информацией об инфузионных реакциях, можно ознакомиться в разделе «Предупредительные указания и меры предосторожности, подраздел «Инфузионные реакции».
Угрожающие жизни инфузионные реакции
При наличии признаков жизнеугрожающих или инвалидизирующих инфузионных реакций, таких как острая реакция гиперчувствительности или респираторный дистресс- синдром, следует немедленно прекратить инфузию препарата Окревус. Пациент должен получить соответствующее лечение. У таких пациентов лечение препаратом Окревус следует отменить и не возобновлять в дальнейшем.
Тяжёлые инфузионные реакции
При возникновении тяжелой инфузионной реакции или комплекса таких симптомов, как покраснение кожи, лихорадка, боль в горле, инфузию следует немедленно прекратить и пациенту необходимо провести симптоматическое лечение. Инфузию можно возобновить после исчезновения всех симптомов. Начальная скорость при возобновлении инфузии должна быть в два раза ниже, чем скорость инфузии на момент начала развития реакции.
Инфузионные реакции легкой и средней степени тяжести
В случае возникновения инфузионных реакций легкой и средней степени тяжести (например, головная боль) скорость инфузии следует снизить до половины скорости на момент начала реакции. Следует продолжать введение с данной сниженной скоростью в течение минимум 30 минут. В случае хорошей переносимости инфузии, скорость введения можно увеличить в соответствии с изначальным графиком.
Нарушение функции почек
Безопасность и эффективность препарата Окревус у пациентов с нарушением функции почек отдельно не изучались. Пациенты с легкой почечной недостаточностью были включены в клинические испытания. Опыт применения препарата Окревус у пациентов с умеренной и тяжелой почечной недостаточностью отсутствует. Окревус представляет собой моноклональное антитело и выводится посредством катаболизма (а не с мочой). Поэтому предполагается, что у пациентов с нарушением функции почек коррекция дозы не требуется (см. разделы «Фармакокинетика», «Кинетика специальных групп пациентов» и «Пациенты с почечной недостаточностью»).
Нарушение функции печени
Безопасность и эффективность препарата Окревус у пациентов с нарушением функции печени отдельно не изучались. Пациенты с легкой печеночной недостаточностью были включены в клинические испытания. Опыт применения препарата Окревус у пациентов с умеренной и тяжелой печеночной недостаточностью отсутствует. Окревус представляет собой моноклональное антитело и выводится посредством катаболизма (а не печеночного метаболизма). Поэтому предполагается, что у пациентов с нарушением функции печени коррекция дозы не требуется (см. «Фармакокинетика», «Кинетика специальных групп пациентов» и «Пациенты с почечной недостаточностью»).
Пациенты пожилого возраста
Безопасность и эффективность препарата Окревус у пациентов старше 55 лет не установлена.
Дети и подростки
Безопасность и эффективность препарата Окревус у детей и подростков (младше 18 лет) не исследовалась.
Противопоказания
Повышенная чувствительность к окрелизумабу или вспомогательным веществам.
Пациенты с тяжелой сердечной недостаточностью (класс IV согласно классификации Нью-Йоркской Ассоциации по изучению заболеваний сердца).
Пациенты с тяжелой иммуносупрессией, включая пациентов, которые получают иммуносупрессивное лечение в настоящее время (исключением является симптоматическое лечение кортикостероидами обострений рассеянного склероза) или их иммунная система ослаблена предшествующей терапией (см. разделы «Особые указания и меры предосторожности при применении» и «Лечение иммуносупрессивными препаратами перед, во время и после лечения препаратом Окревус»).
Наличие активной инфекции (см. раздел «Особые указания и меры предосторожности при применении»).
Существующие активные злокачественные заболевания, за исключением пациентов с базальноклеточным раком кожи.
Беременность и период грудного вскармливания.
Детский возраст до 18 лет (безопасность и эффективность препарата Окревус у детей и подростков <18 лет не исследовались).
Особые указания и меры предосторожности при применении
Перед каждой инфузией медицинский персонал должен гарантировать, что пациент прочитал и понял информацию о безопасности.
Инфузионные реакции
Окревус может вызвать инфузионные реакции, которые могут быть связаны с высвобождением цитокинов и/или других медиаторов.
Симптомы инфузионных реакций, могут возникнуть во время каждой инфузии, чаще всего во время первой инфузии. Инфузионные реакции, могут возникнуть в течение 24 часов после инфузии. Эти реакции могут проявляться в виде зуда, сыпи, крапивницы, эритемы, приливов жара, понижения артериального давления, повышения температуры тела, повышенной утомляемости, головной боли, головокружения, раздражения горла, боли в ротоглотке, одышки, отека глотки или гортани, тошноты и тахикардии (см. раздел «Нежелательные реакции»).
Пациенты, получающие лечение препаратом Окревус, должны находиться под наблюдением в течение минимум одного часа после окончания инфузии в отношении симптомов инфузионных реакций. Врач должен предупредить пациента о возможном возникновении инфузионной реакции в течение 24 часов после инфузии.
Может возникнуть также реакция гиперчувствительности (острая аллергическая реакция на лекарственной средство). Инфузионные реакции клинически не отличаются от острых реакций гиперчувствительности тип 1 (Ig-E-опосредованных) («Особые указания и меры предосторожности при применении», «Реакции повышенной чувствительности»).
Для премедикации с целью снижения частоты и тяжести инфузионных реакций, см. раздел «Режим дозирования и способ применения».
Контроль инфузионных реакций
Коррекционные меры при жизнеугрожающих и тяжелых инфузионных реакциях, инфузионных реакциях легкой и средней степени тяжести, см. разделы «Режим дозирования и способ применения», «Коррекция дозы в процессе лечения».
При развитии тяжелых симптомов со стороны дыхательной системы, таких как бронхоспазм или обострение астмы, инфузию следует прекратить немедленно. Продолжать терапию окрелизумабом в дальнейшем нельзя. После проведения симптоматического лечения пациент должен находиться под наблюдением до полного исчезновения симптомов со стороны дыхательной системы, т.к. после первоначального улучшения может последовать ухудшение.
Во время инфузии препарата Окревус возможно понижение артериального давления как симптом инфузионной реакции. Поэтому следует рассмотреть возможность приостановки лечения антигипертензивными препаратами в течение 12 часов до начала и на протяжении каждой инфузии препарата Окревус. У пациентов с застойной сердечной недостаточностью в анамнезе (класс III и IV по классификации Нью-Йоркской Ассоциации по изучению заболеваний сердца) применение Окревус не изучалось (см. раздел «Противопоказания»).
Реакции гиперчувствительности
Могут возникнуть реакции гиперчувствительности (острая IgE-опосредованная аллергическая реакция на лекарственное средство). Возможны затруднения при дифференциальной диагностике реакции гиперчувствительности и инфузионной реакции. Реакции гиперчувствительности могут возникнуть во время любой инфузии, но, как правило, они отсутствуют во время первой инфузии. Если в ходе последующих инфузий усугубляются ранее наблюдавшиеся симптомы, необходимо немедленно рассмотреть вероятность развития реакции гиперчувствительности. При подозрении на развитие реакции гиперчувствительности во время инфузии необходимо немедленно прекратить инфузию и не возобновлять в дальнейшем. Пациентам с установленной IgE- опосредованной гиперчувствительностью на окрелизумаб противопоказана терапия данным препаратом (см. «Противопоказания»).
Инфекции
Окревус не должен применяться у пациентов с активными, серьезными инфекциями (например, туберкулез, сепсис и оппортунистические инфекции) или с тяжелой иммуносупрессией (например, значительно сниженное количество клеток CD4 или CD8). У пациентов с активной инфекцией применение препарата Окревус следует отложить до купирования инфекции (см. «Противопоказания»).
С более подробной информацией о факторах риска развития серьезных инфекций, которые связаны с другими заболеваниями, а не рассеянным склерозом, можно ознакомиться в разделе «Побочные действия» (тяжелые инфекции из клинических исследований по другим аутоиммунным заболеваниям).
Во время лечения препаратом Окревус могут возникнуть серьезные инфекции, включая смертельные случаи (прежде всего речь идет о пневмонии) (см. «Нежелательные реакции»). Частота фатальных инфекций, о которых сообщалось во время лечения препаратом Окревус, сопоставима с частотой фатальных инфекций в группе плацебо в других исследованиях у пациентов с рассеянным склерозом.
Пациенты, сообщающие о признаках или симптомах инфекции после лечения Окревус, должны быть незамедлительно обследованы. Пациенты должны получить соответствующее лечение. Перед последующим лечением потенциальный риск инфекции должен быть подвергнут повторной оценке.
Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ)
В ходе клинических исследований препарата Окревус случаев ПМЛ выявлено не было.
Риск возникновения ПМЛ при лечении препаратом Окревус не может быть исключен, так
как JC-ассоциированная ПМЛ наблюдалась у пациентов, получавших терапию другими
антителами к CD20, а также другими препаратами для лечения PC.
Развитие JC-ассоциированной ПМЛ было связано с такими факторами риска, как иммунодефицит и множественная терапия иммуносупрессорами.
ПМЛ — это оппортунистическая вирусная инфекция головного мозга, вызванная вирусом Джона Каннингема (JCV), которая обычно приводит к смерти или тяжелой инвалидизации. ПМЛ может проявиться только в случае имеющейся инфекции JCV. Следует обратить внимание на то, что отрицательный тест на анти-JCV антитела не исключает возможности инфекции JCV в дальнейшем. Врачи должны быть насторожены в отношении ранних признаков и симптомов ПМЛ, которые могут включать любые внезапно появляющиеся или ухудшающиеся неврологические признаки или симптомы. Данные признаки и симптомы могут быть сходны с проявлениями рецидива PC. МПЛ протекает часто с летальным исходом и резистентна по отношению ко всем видам терапии. Характерные симптомы ПМЛ многообразны, могут ухудшаться на протяжении от нескольких дней до нескольких недель, и включают в себя прогрессирующую слабость с одной стороны тела или «неуклюжесть» конечностей, нарушение зрения, перемены в мышлении, памяти и ориентации, приводящие к спутанности сознания и изменению личности. При подозрении на ПМЛ следует приостановить терапию препаратом Окревус и провести необходимую диагностическую оценку. При подозрении на ПМЛ следует оценить МРТ (предпочтительно с контрастированием) в динамике (предпочтительно не старше 3 месяцев) и провести тест исследования ликвора для определением вирусной ДНК JCV, а также повторные неврологические исследования.
При подтверждении диагноза ПМЛ необходимо полностью прекратить лечение окрелизумабом.
Реактивация вируса гепатита В (HBV).
У пациентов с PC, получавших терапию препаратом Окревус, не сообщалось о случаях реактивации гепатита В. У пациентов, получавших лечение антителами к CD20, сообщалось о реактивации вируса гепатита В (ВГВ), в некоторых случаях приводившей к развитию фульминантного гепатита, печеночной недостаточности, летальному исходу.
Перед назначением препарата Окревус всем пациентам следует пройти скрининг на ВГВ в соответствии с местными руководствами.
Пациентам с активной инфекцией HBV (т.е. активная инфекция подтверждена положительными результатами определения поверхностного антигена (HBsAg) и антител к антигенам вируса гепатита В (НВсАb) не следует принимать Окревус (см. «Противопоказания»). Пациентам с положительными серологическими маркерами гепатита В (отрицательный результат анализа на HBsAg и положительный результат на НВсАb), а также носителям ВГВ (положительный результат на HBsAg), следует проконсультироваться с врачом гепатологом перед назначением препарата Окревус. В отношении таких пациентов необходимо проводить соответствующий мониторинг и принимать меры по профилактике реактивации вируса гепатита В в соответствии с местными стандартами.
Лечение иммуносупрессивными препаратами до, во время и после терапии препаратом Окревус
В случае с другими аутоиммунными заболеваниями одновременное применение препарата Окревус и иммуносупрессивных лекарственных средств (например, кортикостероиды, болезнь-модифицирующие антиревматические средства биологического и небиологического происхождения, микофенолат мофетил, циклофосфамид, азатиоприн) приводило к увеличению тяжелых инфекций, включая оппортунистические инфекции. Инфекции включали (но не ограничивались) атипичные пневмонии и пневмонии, вызванные Pneumocystis jiroveci, varicella пневмонию, туберкулез и гистоплазмоз. Некоторые из этих инфекций в редких случаях имели летальный исход. Предварительный анализ выявил следующие факторы, сопровождающиеся риском тяжелых инфекций: более высокие, чем рекомендовано, дозы препарата Окревус при рассеянном склерозе, другие сопутствующие заболевания, длительное применение иммуносупрессивных препаратов или кортикостероидов, а также принадлежность пациента к Азиатскому региону. Не рекомендован одновременный прием других иммуносупрессивных препаратов и препарата Окревус, за исключением кортикостероидов, для симптоматического лечения обострений PC.
Назначать терапию препаратом Окревус после иммуносупрессивной терапии или иммуносупрессивную терапии после терапии препаратом Окревус следует с учетом того, что возможно перекрывание их фармакодинамических эффектов (см. раздел «Фармакологические свойства», подраздел «Механизм действия»).
При назначении препарата Окревус следует соблюдать осторожность, принимая во внимание фармакодинамику других синтетических и биологических модифицирующих болезнь антиревматических препаратов (БМАРП) для лечения PC, так как нет данных исследований препарата Окревус в комбинации с другими БМАРП для лечения PC.
Вакцинация
Данные об эффектах вакцинации у пациентов, получающих терапию препаратом Окревус, отсутствуют. Перед назначением препарата Окревус врач должен изучить статус иммунизации пациента.
В случае проведения вакцинации ее необходимо завершить, по меньшей мере, за б недель до начала лечения препаратом Окревус. Безопасность иммунизации живыми или живыми ослабленными вирусными вакцинами после терапии препаратом Окревус не изучалась. Во время терапии препаратом Окревус, а также до восстановления пула В-клеток проводить вакцинацию живыми или живыми ослабленными вакцинами не рекомендуется (см. раздел «Фармакологические свойства», подраздел «Механизм действия»).
Количество пациентов с положительными титрами антител к S. pneumoniae, возбудителям эпидемического паротита, краснухи и ветряной оспы после терапии препаратом Окревус в течение 2 лет было в целом сходно с таковым на исходном уровне.
Малигнизация
В клинических исследованиях сообщалось о случаях злокачественных заболеваний (в т. ч. 6 случаев рака молочной железы при лечении препаратом Окревус, отсутствие случаев в контрольных группах (Ребиф или плацебо) контролируемых исследований). Заболеваемость находилась в рамках ожидаемых результатов для пациенток с рассеянным склерозом.
За исключением пациентов с базальноклеточным раком кожи, лечение препаратом Окревус не должно быть рекомендовано пациентам с существующими активными злокачественными новообразованиями (включая пациентов, которые находятся под активным наблюдением) (см. «Противопоказания»). У пациентов с известными факторами риска возникновения злокачественных новообразований следует тщательно взвесить пользу и риск, а также провести соответствующее обследование перед и во время лечения.
Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Отдельных исследований по взаимодействию с другими лекарственными средствами не проводилось. Риск взаимодействий с одновременно принимаемыми лекарственными средствами не исключен.
Беременность и лактация
Беременность
Окревус — гуманизированное моноклональное антитело, подтип иммуноглобулина G1; известно, что иммуноглобулины проникают через плацентарный барьер. Экспериментальные исследования на животных не показали тератогенного действия, но была выявлена репродуктивная токсичность (см. «Данные доклинической безопасности»). Достаточных и хорошо контролируемых данных из исследований у беременных женщин не имеется. Однако известно о временном периферическом снижении количества В-клеток и лимфопении у новорожденных, чьи матери получали лечение другими анти-СD20-антителами во время беременности. Количество В-клеток у новорожденных детей, чьи матери получали лечение препаратом Окревус, не исследовалось.
У новорожденных, получивших препарат внутриутробно, количество В-клеток у которых выходит за рамки нормы, следует взвесить отсрочку иммунизации живой или аттенуированной живой вакциной.
Не рекомендовано начинать терапию во время беременности (см. «Противопоказания»), Женщины детородного возраста должны использовать надежные методы контрацепции во время лечения препаратом Окревус и в течение 6 месяцев после последней инфузии препарата Окревус (см. «Фармакокинетика», «Выведение»).
Окревус не следует применять во время беременности, за исключением случаев, когда возможная польза для матери превышает возможный риск для плода.
Кормление грудью
Неизвестно, выводится ли окрелизумаб с грудным молоком и оказывает ли влияние на его выработку. Потенциальный вред для ребенка, находящегося на грудном вскармливании, не установлен.
Окрелизумаб проникает в молоко животных.
He рекомендуется грудное вскармливание во время терапии препаратом Окревус, поскольку человеческий IgG проникает в грудное молоко, а- возможность всасывания окрелизумаба и последующего истощения пула В-клеток неизвестна.
Влияние на способность управлять транспортными средствами и работать с механизмами
Соответствующие исследования не проводились. В связи с сообщенными ранее фармакологическими действиями и нежелательными явлениями не следует ожидать подобных влияний. Однако следует принимать во внимание влияние премедикации антигистаминными средствами. После реакций инфузии следует дождаться стабилизации состояния пациента, прежде чем он приступит к вождению автотранспорта и работе с механизмами.
Нежелательные реакции
Клинические исследования
Безопасность препарата Окревус оценивалась в клинических исследованиях по рассеянному склерозу на 1311 пациентах, из них 825 пациентов с рецидивирующим рассеянным склерозом (РРРС) в двух идентичных активно-контролируемых клинических исследованиях и 486 пациентов в плацебо-контролируемом исследовании у пациентов с первично-прогрессирующим рассеянным склерозом (ППРС) (см. «Клиническая эффективность»). Среди наиболее частых нежелательных реакций лекарственного препарата были инфузионные реакции, и инфекции дыхательных путей.
Частота возникновения нежелательных реакций классифицирована следующим образом: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1 ООО, но <1/100), редко (≥1/10 000, но <1/1 000), очень редко (<1/10 000).
Нежелательные реакции расположены в порядке уменьшения степени их серьезности.
Резюме нежелательных реакций в группах с РРРС и с ППРС, получавших лечение препаратом Окревус
Инфекции и инвазии
Очень часто: инфекции верхних дыхательных путей (РРРС: 15.2%; ППРС: 12.1%), назофарингит (ППРС: 24.1%; РРРС: 14.9%), грипп (ППРС: 11.7%; РРРС: 4.6%).
Часто: бронхит, синусит, гастроэнтерит, вирусная инфекция, оральный герпес, инфекция дыхательных путей, целлюлит, опоясывающий герпес, конъюнктивит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения Часто: кашель, катар.
Общие нарушения и реакции в месте введения
Очень часто: инфузионные реакции (ППРС: 40.1%; РРРС: 34.3%) (симптомы, о которых сообщалось в течение 24 часов после инфузии как о реакции, обусловленной инфузией, описаны как инфузионные реакции).
Лабораторные и инструментальные данные
Очень часто: пониженный уровень IgM в сыворотке
Часто: пониженный уровень IgG в сыворотке
Описание отдельных нежелательных реакций.
Инфузионные реакции
Симптомы, связанные с инфузионными реакциями и выявленные во время исследований в группах с РРРС и с ППРС, включали зуд, сыпь, крапивницу, эритему, приливы жара, понижение артериального давления, повышение температуры тела, повышенная утомляемость, головную боль, головокружение, раздражение горла, боль в ротоглотке, одышку, отек глотки или гортани, тошноту и тахикардию. В контролируемых клинических исследованиях не было инфузионных реакций с летальным исходом.
В активно-контролируемых (РРРС) клинических исследованиях инфузионные реакции, были самым частым нежелательным явлением у пациентов, получавших лечение препаратом Окревус 600 мг. Общая частота составила 34.3% по сравнению с частотой 9.9% в лечебной группе интерферон-бета-1а (инфузия плацебо). Самая большая частота инфузионных реакций, во время начальной дозы/дозы 1 инфузия 1 была 27.5% и снизилась в течение времени до <10% на дозе 4. Большинство инфузионных реакций, были легкой или средней степени тяжести; в 2.4% случаев инфузионные реакции, в обеих лечебных группах были тяжелыми и 0.1% инфузионные реакции были жизнеугрожающими (см. «Особые указания и меры предосторожности при применении», «Инфузионные реакции»).
В плацебо-контролируемых (ППРС) клинических исследованиях частота инфузионных реакций была максимальной во время 1-ой инфузии 1-ой дозы препарата Окревус (27.4%) и снижалась при введении последующих доз до <10% во время введения 4-ой дозы. У большинства пациентов инфузионные реакции чаще развивались во время первой инфузии каждой дозы по сравнению со второй инфузией этой дозы.
Большинство инфузионных реакций на Окревус были легкой (26.7%) или средней степени тяжести (11.9%); в 1.4% случаев инфузионные реакции были тяжелыми ни у кого не было жизнеугрожающих инфузионных реакций (см. «Особые указания и меры предосторожности при применении», «Инфузионные реакции»).
Инфекции
Лечение препаратом Окревус не ассоциировалось с увеличением серьезных инфекций (у пациентов с РРРС частота серьезных инфекций была меньше [Окревус 1.3%], чем у пациентов, получавших интерферон бета-1а [2.9%]. У пациентов с ППРС частота была сходной с таковой в группе плацебо [6.2% по сравнению с 6.7%].
В активно-контролируемых (РРРС) клинических исследованиях и в плацебо- контролируемых (ППРС) клинических исследованиях инфекции дыхательных путей и герпетическая инфекция (оба вида инфекций преимущественно легкой и средней степени тяжести) наблюдались чаще в группе, получающей лечение препаратом Окревус.
Основная часть пациентов с тяжелыми инфекциями (препарат Окревус) была сопоставима с соответствующей частотой в контрольных группах (плацебо и интерферон). Было отмечено незначительное количество жизнеугрожающих (степень 4) инфекций при лечении препаратом Окревус, но чаще чем в контрольных группах (0.2% OCR по сравнению с 0% интерферон у пациентов с РРРС или 1.6% OCR по сравнению с 0.4% плацебо у пациентов с ППРС). Эти инфекции не приводили к ограничению лечения. У пациентов с ППРС с затруднениями при глотании существует повышенный риск возникновения аспирационной пневмонии. Лечение препаратом Окревус у таких пациентов может повысить риск тяжелой пневмонии. Врачам следует немедленно принять соответствующие меры у пациентов, у которых обнаружена пневмония.
Инфекции дыхательных путей
Доля инфекций дыхательных путей у пациентов, получавших лечение препаратом Окревус, была больше, чем у пациентов, получавших лечение интерфероном бета-1а или плацебо. Преимущественно, инфекции были легкой и средней степени тяжести. В основном это были инфекции верхних дыхательных путей (включая назофарингит) и бронхов (см. «Нежелательные реакции», «Инфекции дыхательных путей»). Были случаи летального исхода вследствие пневмонии (Окревус). Частота реакций с летальным исходом вследствие пневмоний, о которых сообщалось во время лечения препаратом Окревус, находится в рамках частоты реакций с летальным исходом вследствие пневмоний, о которых сообщалось у пациентов, получавших лечение плацебо, в других исследованиях с рассеянным склерозом.
Герпес
В активно-контролируемых (пациенты с РРРС) клинических исследованиях герпетическая инфекция обнаруживались чаще у пациентов, получавших лечение препаратом Окревус, чем у получавших лечение препаратом интерферон бета-1а. Данные инфекции охватывают опоясывающий герпес (3.0% по сравнению с 2.2%), простой герпес (0.7% по сравнению с 0.1%) и оральный герпес (3.0% по сравнению с 2.2%), генитальный герпес и генерализованную герпетическую инфекцию (0.1% по сравнению с 0%). Большинство инфекций были легкой или средней степени тяжести. Пациенты выздоравливали от стандартного лечения. Сообщения о генерализованном герпесе отсутствуют.
В плацебо-контролируемых (ППРС) клинических исследованиях наблюдалось наибольшее число пациентов, получавших лечение препаратом Окревус, с простым герпесом (2.7% по сравнению с 0.8%).
Тяжелые инфекции из клинических исследований по другим аутоиммунным заболеваниям, отличным от рассеянного склероза
Окревус исследовался в комбинации с иммуносупрессивными медикаментами (например, стероиды, небиологические и биологические болезнь-модифицирующие антиревматические средства, микофенолат мофетил, циклофосфамид, азатиоприн) в случае с другими аутоиммунными заболеваниями.
Большинство имеющихся в распоряжении данных из исследований у пациентов с ревматоидным артритом (РА), где наблюдался дисбаланс тяжелых инфекций, включая, но, не ограничиваясь, атипичные пневмонии и пневмонии, вызванные Pneumocystis jiroveci, вирусом ветряной оспы, туберкулез и гистоплазмоз в группе с иммуносупрессивным препаратом Окревус. В редких случаях некоторые из этих инфекций заканчивались летальным исходом. Серьезные инфекции наблюдались чаще в группе с дозой 1000 мг, чем в группе с дозой 400 мг или в группе с иммуносупрессивными препаратами и плацебо.
К факторам риска развития серьезных инфекций относились наличие сопутствующих заболеваний, длительная терапия иммуносупрессантами/глюкокортикостероидами, а также принадлежность пациента к Азиатскому региону.
Отклонение лабораторных показателей
Иммуноглобулины
Лечение препаратом Окревус за контролируемый период исследования привело к снижению общей концентрации иммуноглобулинов, в основном за счет снижения уровня иммуноглобулина М (IgM). Возможно, существует связь между продолжительным снижением уровня IgG, IgM или IgA и серьезными инфекциями. Однако на основании ограниченного числа случаев окончательные выводы не могут быть сделаны.
До начала лечения препаратом Окревус в рамках клинического исследования, исходные концентрации IgG, IgA и IgM были меньше нижней границы нормы (НГН) у 0.5%, 1.5% и 0.1% пациентов с рецидивирующими формами рассеянного склероза, соответственно. Через 96 недель после начала лечения концентрации IgG, IgA и IgM были ниже НГН у 1.5%, 2.4% и 16.5% пациентов, соответственно.
В плацебо-контролируемом исследовании (при ППРС) доли пациентов в группе терапии препаратом Окревус, у которых исходные уровни IgG, IgA и IgM были меньше НГН, составляли 0%, 0.2% и 0.2%, соответственно. После терапии доли получавших препарат Окревус пациентов, у которых на 120-ой неделе уровни IgG, IgA и IgM были меньше НГН, составляли 1.1%, 0.5% и 15.5%, соответственно.
Нейтрофилы
В большинстве случаев уменьшение числа нейтрофилов было временным, (отмечалось однажды в ходе терапии препаратом Окревус) и имело 1-ую или 2-ую степень тяжести.
В активно-контролируемом (среди пациентов с РРРС) периоде лечения число нейтрофилов уменьшилось у 14.7% пациентов, получавших лечение препаратом Окревус, по сравнению с 40.9% пациентов, получавших лечение препаратом интерферон бета-1а. В плацебо-контролируемых (среди пациентов с ППРС) клинических исследованиях уменьшение числа нейтрофилов наблюдалось несколько чаще (12.9%), по сравнению с пациентами, получавшими плацебо (10.0%), из них, примерно у 1% пациентов в группе препарата Окревус, наблюдалась нейтропения 4-й степени, по сравнению с 0% в плацебо- группе.
Передозировка
Имеется только ограниченный опыт из клинических исследований с более высокими дозами, чем допустимые дозы препарата Окревус внутривенно. До сих пор самой высокой исследованной дозой у пациентов с рассеянным склерозом было 2000 мг, две инфузии каждая по 1000 мг внутривенно на протяжении 2 месяцев (фаза-П-исследование дозы в РРРС). Побочные действия соответствовали профилю безопасности препарата Окревус в решающих клинических исследованиях.
Специфического антидота в случае передозировки не существует. Инфузия должна быть прекращена немедленно и пациент должен находиться под наблюдением в отношении инфузионных реакций («Предупредительные указания и меры предосторожности, инфузионные реакции»).
Фармакотерапевтическая группа
Селективные иммунодепрессанты.
Код АТС: L04AA36.
Фармакологические свойства
Механизм действия/ фармакодинамика
Окрелизумаб — это рекомбинантное гуманизированное моноклональное антитело, предназначенное для селективного воздействия на СD20-позитивные В-клетки.
CD20 — это поверхностный антиген, который экспрессируется на пре-В-клетках, зрелых В- клетках и В-клетках памяти. CD20 не экспрессируется на стволовых лимфоидных и плазматических клетках.
Точный механизм, посредством которого достигается терапевтический клинический эффект Окрелизумаба при рассеянном склерозе, не установлен. Предполагается, что данный механизм включает процесс иммуномодуляции посредством снижения числа и подавления функции CD20 экспрессирующих В-клеток. После связывания на поверхности В-клеток, экспрессирующих CD20, Окрелизумаб селективно уменьшает их количество посредством антитело-зависимого клеточного фагоцитоза (ADCP), антитело-зависимой клеточной цитотоксичности (ADCC), комплемент-зависимой цитотоксичности (CDC) и апоптоза. Способность В-клеток к восстановлению и предшествующий гуморальный иммунитет сохраняются. Кроме того, Окрелизумаб не влияет на врождённый иммунитет и общее количество Т-клеток.
К 14 дню терапии препаратом Окревус наблюдалось быстрое истощение пула CD 19+ В- клеток в крови, которое сохранялось в течение всего периода лечения и являлось ожидаемым фармакологическим эффектом. Для подсчета количества В-клеток используется именно CD 19, так как окрелизумаб препятствует распознаванию CD20 при проведении анализа (см. подраздел «Механизм действия» выше).
В периодах между введениями препарата Окревус наблюдалось восстановление пула В- клеток (до исходного значения или выше нижней границы нормы (НГН)), как минимум, однажды приблизительно у 5% пациентов.
Степень и длительность истощения пула В-клеток в исследованиях при первично-прогрессирующем рассеянном склерозе (ППРС) и рецидивирующих формах рассеянного склероза были сходными.
По результатам наиболее длительного периода наблюдения с момента последней инфузии препарата Окревус (исследование II фазы, n=51) медиана периода восстановления пула В- клеток (возвращения к нижней границе нормы (НГН) или к исходному значению, если оно меньше НГН) составила 72 недели (27-175 недель). У 90% пациентов пул В-клеток восстановился до значений НГН или исходного значения приблизительно через два с половиной года после последней инфузии препарата.
Клиническая эффективность
Рецидивирующий рассеянный склероз
Эффективность и безопасность препарата Окревус оценивали у пациентов с рецидивирующими формами рассеянного склероза (согласно диагностическим критериям 9276 -2018 МакДональда 2010) в двух рандомизированных, двойных слепых клинических исследованиях с идентичным дизайном, с двойной имитацией и с использованием активного препарата сравнения (интерферон бета-1а).
Дизайн исследований и исходные характеристики исследуемой популяции представлены в таблице 2.
Демографические и исходные характеристики были сбалансированы в обеих группах. Пациенты группы А получали Окревус 600 мг каждые 6 месяцев (доза 1 как 2 внутривенные инфузии по 300 мг с интервалом в 2 недели), последующие дозы вводились в виде однократной внутривенной инфузии 600 мг. Пациенты группы В получали интерферон бета-1а (Ребиф®) 44 мкг 3 раза в неделю в виде подкожной инъекции.
Результаты данного исследования показали, что Окревус по сравнению с интерфероном бета-1а значительно снижал частоту обострений, субклиническую активность заболевания, установленную посредством МРТ, а также прогрессирование болезни.
Клинические и MPT-данные конечных точек приведены в таблице 3 и на рисунке 1.
Таблица 2: Дизайн исследований и демографическая характеристика
| Исследование 1 | Исследование 2 | |||
| Название исследования | WA21092 (OPERA I) (n=821) | WA21093 (OPERA II) (n=835) | ||
| Дизайн исследования | ||||
| Популяция исследования | Пациенты с рецидивирующим рассеянным склерозом | |||
| Анамнез при скрининге | Минимум два обострения в течение предыдущих 2 лет или 1 обострение в прошлом году; EDSS между 0 и 5.5. включительно | |||
| Длительность исследования | 2 года (96 недель) | |||
| Группы лечения | Группа А: Окревус 600 мг каждые 24 недели внутривенно Группа В: Интерферон бета-1а (Ребиф®). 44 мкг 3 раза в неделю подкожно (ИФН) | |||
| Исходные характеристики | Окревус 600 мг (n=410) | ИФН 44 мкг (n=411) | Окревус 600 мг (n=417) | ИФН 44 мкг (n=418) |
| Средний возраст (годы) | 37.1 | 36.9 | 37.2 | 37.4 |
| Возрастной диапазон (годы) при включении в исследование | 18-56 | 18-55 | 18-55 | 18-55 |
| Распределение по полу (% мужчины/ % женщины) | 34.1/65.9 | 33.8/66.2 | 35.0/65.0 | 33.0/67.0 |
| Усредненная/ средняя длительность заболевания от начала первых симптомов PC (годы) | 6.74/4.88 | 6.25/4.62 | 6.72/5.16 | 6.68/5.07 |
| Усредненная/средняя длительность с момента установления диагноза PC | 3.82/1.53 | 3.71/1.57 | 4.15/2.10 | 4.13/1.84 |
| Среднее количество обострений в прошедшем году | 1.31 | 1.33 | 1.32 | 1.34 |
| Среднее значение EDSS * | 2.82 | 2.71 | 2.73 | 2.79 |
| Наивные пациенты (пациенты, которые прежде не получали препараты, изменяющие течение рассеянного склероза (ПИТРС)) (%)** | 73.4 | 71.0 | 72.7 | 74.9 |
| Среднее количество Т-1 очагов с накоплением контраста (гадолинийусиленные очаги) | 1.69 | 1.87 | 1.82 | 1.95 |
| Среднее количество гиперинтенсивных T2 очагов | 51.04 | 51.06 | 49.26 | 51.01 |
* Expanded Disability Status Scale (расширенная шкала оценки степени инвалидизации).
** Пациенты, которые за 2 года до рандомизации не принимали специфических медикаментов от рассеянного склероза
Таблица 3: Клинические и MPT-данные конечных точек в исследованиях WA21092 и WA21093.
| Конечные точки | Исследование 1: WA21092 (OPERA I) | Исследование 2: WA21093 (OPERA II) | ||
| Окревус 600 мг (n=410) | ИФН 44 мкг (n=411) | Окревус 600 мг (n=417) | ИФН 44 мкг (n=418) | |
| Клинические конечные точки | ||||
| Количество обострений за год (первичная конечная точка) | 0.156 | 0.292 | 0.155 | 0.290 |
| Относительное снижение | 46%(р<0.0001) | 47%(p<0.0001) | ||
| Соотношение пациентов с 12- недельным прогрессированиеминвалидизации3Снижение риска (объединенный анализ1)Снижение риска (индивидуальный анализ2) | 9.8% Окревус по сравнению с 15.2% ИФН40%(р=0.0006) | |||
| 43%(р=0.0139) | 37%(р=0.0169) | |||
| Соотношение пациентов с 24- недельным прогрессированиеминвалидизации3Снижение риска (объединенный анализ1) Снижение риска (индивидуальный анализ2) | 7.6% Окревус по сравнению с 12.0% ИФН40%(р=0.0025) | |||
| 43%(р=0.0278) | 37%(р=0.0370) | |||
| Соотношение пациентов с мин. 12-недельным подтвержденным улучшением (4) (объединенный анализ) | 20.7% Окревус по сравнению с 15.6 ИФН | |||
| Относительное улучшение (объединенный анализ1) | 33% (р=0.0194) | |||
| Относительное улучшение (индивидуальный анализ2) | 61%(р=0.0106) | 14%(р=0.4019) | ||
| Среднее изменение от исходного значения по композитной функциональной шкале рассеянного склероза (MSFC) | 0.213 | 0.174 | 0.276 | 0.169 |
| Разница | 0.039(р=0.3261) | 0.107(р=0.0040) | ||
| Соотношение пациентов без признаков активности заболевания (NEDA)5 | 48% | 29% | 48% | 25% |
| Относительное улучшение2 | 64% | 89%(р<0.0001) | ||
| МРТ конечные точки | ||||
| Среднее число Т-1 очагов, накапливающих контраст, при контрастировании гадолинием на MPT | 0.016 | 0.286 | 0.021 | 0.416 |
| Относительное снижение | 94%(р<0.0001) | 95%(р<0.0001) | ||
| Среднее число новых и/или увеличенных гиперинтенсивных Т2 очагов на МРТ | 0.323 | 1.413 | 0.325 | 1.904 |
| Относительное снижение | 77%(р<0.0001) | 83%(р<0.0001) | ||
| Среднее число новых гипоинтенсивных Т1 очагов на МРТ | 0.420 | 0.982 | 0.449 | 1.255 |
| Относительное снижение | 57%(р<0.0001) | 64%(р<0.0001) | ||
| Процентное изменение объема мозга между неделями 24-96 | -0.572 | -0.741 | -0.638 | -0.750 |
| Относительное снижение потери объема мозга | 22.8%(р=0.0042)2 | 14.9%(р=0.0900) | ||
| Качество жизни | ||||
| Среднее изменение по отношению к исходному значению SF-36 (опросник качества жизни) по шкале физического здоровья | 0.036 | -0.657 | 0.326 | -0.833 |
| Разница | 0.693(р=0.2193) | 1.159(р=0.0404)6 |
Данные проспективно объединены из исследований 1 и 2
P-критерий не достиг статистической значимости;
Определено как увеличение на >1.0 пункт по шкале EDSS для пациентов с исходным уровнем 5.5 или меньше, или увеличение на >0.5,если исходный уровень шкалы >5.5; по Каплан-Майер через 96 недель.
Определено как уменьшение на 1.0 пункт по шкале EDSS для пациентов с исходным уровнем шкалы EDSS ≥ 2 и ≤ 5.5 или на 0.5. если исходный уровень шкалы EDSS был >5.5. Пациенты с исходным уровнем шкалы <2 в анализ не включались.
NEDA (No Evidence of Disease Activity — отсутствие признаков активности заболевания) определено как отсутствие определенных в протоколе обострений, отсутствие подтвержденного прогрессирования инвалидизации (CDP) и отсутствие активности на МРТ (отсутствие Т1-очагов, накапливающих контраст при проведении МРТ с контрастированием гадолинием, отсутствие новых или увеличившихся Т2-очагов) за период 96-недельного лечения.
Результаты по всей популяции «назначенного лечения».
Рисунок 1: Кривая Каплан-Майер времени до начала подтвержденного прогрессирования сохраняющегося, по крайней мере, 24 недели от эпизода неврологического ухудшения, случившегося в период двойной слепой фазы исследования (объединенная популяция «назначенного лечения») *
* Заранее определенный объединенный анализ OPERA I & II.
Результаты анализа времени до начала подтвержденного прогрессирования заболевания сохраняющегося, по крайней мере, 24 недели, показали, что терапия Окрелизумабом обеспечила снижение риска стойкого прогрессирования заболевания на 40% по сравнению с интерфероном бета1-а (р=0.0025).
Первично-прогрессирующая форма рассеянного склероза
Эффективность и безопасность препарата Окревус оценивались также в одном рандомизированном, двойном слепом плацебо-контролируемом клиническом исследовании у пациентов с первично-прогрессирующей формой рассеянного склероза (WA25046). Дизайн исследований и исходные характеристики исследуемой популяции представлены в таблице 4. Демографические признаки и исходные характеристики были сбалансированы в обеих лечебных группах.
Пациенты (группа А) получали каждые 6 месяцев Окревус 600 мг (2 внутривенные инфузии, каждая по 300 мг с интервалом в 2 недели). Пациенты группы В получали плацебо. Внутривенная инфузия 600 мг среди популяции пациентов с РРРС и 2 внутривенные инфузии по 300 мг каждая у пациентов с ППРС показали сходный фармакокинетический и фармакодинамический профиль. Профиль инфузионных реакций был сопоставим независимо от того был ли введен Окрелизумаб в виде однократной внутривенной инфузии в дозе 600 мг или в виде двух отдельных инфузий по 300 мг каждая с интервалом 2 недели (см. «Нежелательные реакции», «Инфузионные реакции» и «Фармакокинетика»). Поскольку, в целом, количество внутривенных инфузий было больше при введении в дозе по 300 мг с интервалом 2 недели, то в этой группе общее число инфузионных реакций было выше. Рекомендуется после введения первой дозы 600 мг в виде двух внутривенных инфузий по 300 мг с интервалом 2 недели в последующем вводить Окревус 600 мг в виде однократной инфузии (см. Таблицу 1), чтобы снизить общее число инфузионных реакций и общую частоту премедикации метилпреднизолоном.
Таблица 4: Дизайн исследования и исходные характеристики исследования WA25046
| Название исследования | Исследование WA25046 ORATORIO (n=732) | |
| Дизайн исследования | ||
| Популяция исследования | Пациенты с первично-прогрессирующей формой рассеянного склероза | |
| Длительность исследования | Событийно-ориентированное (минимум 120 недель и 253 подтвержденных случая прогрессирования инвалидизации) Среднее время последующего наблюдения: Окревус 3.0 года, плацебо 2.8 года | |
| Анамнез при скрининге | Возраст 18-55 летEDSS 3.0-6.5.включая значение ≥ 2.0 в оценке пирамидной функции | |
| Группы лечения | Группа А: Окревус 600 мгГруппа В: плацебо. 2:1 рандомизированное | |
| Исходные характеристики | Окревус 600 мг (n=488) | Плацебо 600 мг (n=244) |
| Средний возраст (годы) | 44.7 | 44.4 |
| Возрастной диапазон (годы) при включении в исследование | 20-56 | 18-56 |
| Распределение по полу (% мужчины/ % женщины) | 51.4/48.6 | 49.2/50.8 |
| Усредненная/ средняя длительность от начала первых симптомов рассеянного склероза (в годах) | 6.7/6.0 | 6.1/5.5 |
| Усредненная/ средняя длительность болезни с момента постановки диагноза ППРС (в годах) | 2.9/1.6 | 2.8/1.3 |
| Среднее значение EDSS (среднее значение) | 4.7 | 4.7 |
Клинические и МРТ — конечные точки и приведены в таблице 5 и на рисунке 2.
Таблица 5: Клинические и МРТ — конечные точки в исследовании WA25046 (ППРС)
| Исследование 3 | ||
| Конечные точки | WA25046 (ORATORIO) | |
| Окревус 600 мг (n=488) | Плацебо (n=244) | |
| Клинические конечные точки | ||
| Первичная конечная точка эффективности | 30.2% | 34.0% |
| Доля пациентов с 12-недельным подтвержденным прогрессированием инвалидизации1 (первичная конечная точка)Снижение риска | 24% (р=0.0321) | |
| Доля пациентов с 24-недельным подтвержденным прогрессированием инвалидизации1 | 28.3% | 32.7% |
| Снижение риска | 25% (р=0.0365) | |
| Процентное изменение измеренного времени ходьбы на расстояние 25 футов с момента начала исследования до 120 недели | 38.9 | 55.1 |
| Относительное снижение скорости увеличения времени ходьбы | 29.4% | |
| (р=0.0404) | ||
| Конечные точки на MPT | ||
| Процентное изменение объема гиперинтенсивных Т2-очагов с момента начала исследования до 120 недели | -3.4 | 7.4 |
| (р<0.0001) | ||
| Процентное изменение объема мозга с 24-й по 120-ю неделю | -0.902 | -1.093 |
| Темп относительного снижения потери объема мозга | 17.5% (р=0.0206) | |
| Качество жизни | ||
| Среднее изменение по отношению к исходному значению в SF-36 (опросник качества жизни) по шкале физического здоровья | -0.731 | -1.108 |
| Разница | 0.377(р=0.6034) |
1Определено как увеличение на ≥1.0 пункт по шкале EDSS для пациентов с исходным уровнем 5.5 или меньше, или увеличение на ≥0.5, если исходный уровень шкалы ≥5.5.
Рисунок 2: Кривая Каплан-Майер времени до начала подтвержденного прогрессирования сохраняющегося, по крайней мере, 12 недель от эпизода неврологического ухудшения, который возник в период двойной слепой фазы исследования (объединенная популяция «назначенного лечения» *).
* Все пациенты в этом анализе подвергались последующему наблюдению в течение минимум 120 недель. Первичный анализ основан на всех возникших случаях.
Иммуногенность
У пациентов, участвующих в исследованиях рассеянного склероза, проводили тестирование на наличие антитерапевтических антител (АТТ) в нескольких временных точках (перед первым введением и каждые 6 месяцев в течение всего исследования). Из 1311 пациентов, получавших лечение окрелизумабом, у 12 человек (~1%) тест на АТТ, возникшие во время лечения, был положительный, из них у 2 пациентов положительный результат анализа отмечался на нейтрализующие антитела. Оценить влияние, возникшее во время лечения АТТ, на профиль безопасности и эффективности терапии не представляется возможным из-за низкой частоты встречаемости АТТ к окрелизумабу. Данные по иммуногенности в значительной степени зависят от чувствительности и специфичности использованных методов анализа. Кроме того, на фактическую частоту встречаемости положительных результатов при использованном методе анализа могут влиять несколько факторов, включая обращение с образцом, время забора образцов, лекарственное взаимодействие, прием сопутствующих препаратов и основное заболевание. Таким образом, сравнение частоты встречаемости антител к Окрелизумабу и частоты встречаемости антител к другим препаратам может быть некорректным.
Фармакокинетика
В исследованиях среди пациентов с рассеянным склерозом фармакокинетика окрелизумаба исследована при помощи популяционного фармакокинетического анализа. При низких дозах клиренс препарата Окревус зависит от концентрации. В терапевтическом диапазоне доз Окревус имеет линейную фармакокинетику.
Суммарные значения площади под кривой «концентрация-время» (AUC) в течение 24- недельных интервалов дозирования были идентичными при двукратном введении (300 мг, затем через 2 недели еще 300 мг) и при однократном введении (600 мг) препарата. Значение площади под кривой «концентрация-время» за период дозирования (AUCτ) после 4-го введения окрелизумаба в дозе 600 мг составило 3510 мкг/мл*сут. Средняя максимальная концентрация (Сmах) составляла 212 мкг/мл при рецидивирующих формах рассеянного склероза (инфузия 600 мг) и 141 мкг/мл при ППРС (две отдельные внутривенные инфузии по 300 мг с 2-х недельным интервалом).
Всасывание
Окревус вводится посредством внутривенной инфузии. Другие способы введения препарата не изучались.
Распределение
Рассчитанное значение центрального объема распределения составило 2.78 л. Рассчитанные значения периферического объема распределения и межкамерного клиренса составили 2.68 л и 0.294 л/сут, соответственно.
Метаболизм
Отдельных исследований метаболизма окрелизумаба не проводилось. Как и другие антитела, окрелизумаб преимущественно подвергается катаболизму.
Выведение
Рассчитанный показатель постоянного клиренса составил 0.17 л/сут. Терминальный период полувыведения составил 26 дней.
Фармакокинетика у особых групп пациентов
Пациенты пожилого возраста
Исследований фармакокинетики окрелизумаба у пациентов в возрасте ≥58 лет не проводилось.
Дети и подростки
Исследования фармакокинетики окрелизумаба у детей и подростков в возрасте (<18 лет) не проводились.
Пациенты с нарушением функции почек
Отдельных исследований фармакокинетики не проводилось. Пациенты с нарушением функции почек легкой степени тяжести были включены в программу клинических исследований. Изменений фармакокинетических параметров окрелизумаба у таких пациентов не наблюдалось.
Пациенты с нарушением функции печени
Отдельных исследований фармакокинетики не проводилось. Пациенты с нарушением функции печени легкой степени тяжести были включены в клинические исследования. Изменений фармакокинетических параметров окрелизумаба у таких пациентов не наблюдалось.
Данные доклинической безопасности
Данные доклинических исследований не выявили особых рисков для человека острой дозозависимой токсичности при повторных введениях.
Мутагенность и канцерогенность
Исследования по выявлению мутагенности или канцерогенности не проводились.
Репродуктивная токсичность
Доклинические данные, основанные на исследованиях мужской и женской фертильности у обезьян, не выявили признаков репродуктивной токсичности.
В исследовании на обезьянах после введения 75/100 мг/кг (ударная доза/ исследовательская доза) препарата Окревус признаков материнской токсичности, тератогенности или эмбриотоксичности не обнаружено. Т.к. молекулы IgG проникают через плацентарный барьер, Окревус вызывает снижение числа В-клеток плодов обезьян, получавших лечение.
В исследовании пре- и постнатального развития у обезьян дозы препарата Окревус (15/20 и 75/100 мг/кг ударная доза/ исследовательская доза, соответствующая эквиваленту дозы у человека 3000 мг (приблизительно 5 клинических доз) или 15000 мг (приблизительно 25 клинических доз)) ассоциировались с гломерулопатией (7/24 животных), образованием лимфоидных фолликулов в костном мозге (9/24 животных) и лимфоплазматическим воспалением в почках (2/24 животных). Масса яичек новорожденных в группе с 75/100 мг/кг значительно снижена по сравнению с контрольной группой. В исследовании отмечено два летальных исхода (2/24 животных). Один случай объяснялся слабостью родовой деятельности во время преждевременных родов с сопутствующей оппортунистической инфекцией. Второй случай связан с инфекционным менингоэнцефалитом новорожденного с вовлечением мозжечка из-за активной инфекции (мастита) самки. На течение обеих инфекций у новорождённых, возможно, повлиял истощение пула В-клеток. У новорожденных потомков самок, которые получали Окревус. в постнатальной фазе обнаружено истощение популяции В-клеток.
Поддающееся измерению количество (приблизительно 0.2% постоянного уровня в сыворотке) окрелизумаба было обнаружено в материнском молоке во время кормления.
Несовместимость
Несовместимости между препаратом Окревус и поливинилхлоридом, полиолефином или набором для внутривенного введения не наблюдалось.
Не следует использовать другие средства для разведения для препарата Окревус, кроме упомянутых в указаниях, т. к. их использование не исследовалось.
Фармакологическое действие
Средство для лечения рассеянного склероза. Окрелизумаб — рекомбинантное гуманизированное моноклональное антитело, селективно воздействующее на В-клетки, экспрессирующие CD20.
CD20 представляет собой поверхностный антиген, расположенный на пре-B-клетках, зрелых В-клетках и В-клетках памяти. CD20 не экспрессируется на стволовых лимфоидных клетках и плазматических клетках.
Точный механизм, посредством которого достигается терапевтический клинический эффект окрелизумаба при рассеянном склерозе, точно не установлен. Предполагается, что данный механизм включает процесс иммуномодуляции путем уменьшения количества и подавления функции В-клеток, экспрессирующих CD20. После связывания на поверхности В-клеток, экспрессирующих CD20, окрелизумаб селективно уменьшает их количество посредством антитело-зависимого клеточного фагоцитоза, антитело-зависимой клеточной цитотоксичности, комплемент-зависимой цитотоксичности и апоптоза. Способность к восстановлению В-клеток и существующий гуморальный иммунитет сохраняются. Кроме того, окрелизумаб не влияет на врожденный иммунитет и общее количество Т-клеток.
В результате клинических исследований было установлено, что окрелизумаб снижает среднегодовую частоту рецидивов, а также долю пациентов с прогрессированием инвалидизации через 12 недель после начала терапии, замедляет прогрессирование заболевания и снижает ухудшение показателей скорости ходьбы по сравнению с плацебо.
При анализе на иммуногенность антитерапевтические антитела определялись приблизительно у 1% пациентов, из них нейтрализующие антитела определялись в единичных случаях. Оценить влияние возникших во время лечения антитерапевтических антител на профиль безопасности и эффективности терапии не представлялось возможным из-за низкой частоты встречаемости указанных антител к окрелизумабу.
Фармакокинетика
Фармакокинетические свойства окрелизумаба в исследованиях при рассеянном склерозе описаны с помощью двухкамерной модели с зависимым от времени клиренсом и с использованием фармакокинетических параметров, характерных для моноклонального антитела класса IgG1. Суммарные значения AUC в течение 24-недельных интервалов дозирования были идентичными при двукратном введении (300 мг, затем через 2 недели еще 300 мг) и при однократном введении (600 мг) окрелизумаба. Значение площади AUC после 4 введения окрелизумаба в дозе 600 мг составило 3510 мкг/мл×сут. Средняя Cmax составляла 212 мкг/мл при рецидивирующих формах рассеянного склероза (инфузия 600 мг) и 141 мкг/мл при первично-прогрессирующем рассеянном склерозе (две отдельные в/в инфузии по 300 мг с 2-недельным интервалом).
Рассчитанное значение центрального Vd составило 2.78 л. Рассчитанные значения периферического Vd и межкамерного клиренса составили 2.68 л и 0.294 л/сут соответственно.
Отдельных исследований метаболизма окрелизумаба не проводилось. Как и другие антитела, окрелизумаб преимущественно подвергается катаболизму.
Рассчитанный показатель постоянного клиренса составил 0.17 л/сут. Первоначальный зависимый от времени клиренс составил 0.0489 л/сут с дальнейшим уменьшением при T1/2 33 недели. Терминальный T1/2 составил 26 дней.
Показания активного вещества
ОКРЕЛИЗУМАБ
Рецидивирующие формы рассеянного склероза или первично-прогрессирующего рассеянного склероза.
Режим дозирования
Вводят в/в в виде инфузии.
Для профилактики инфузионных реакций проводится премедикация.
Начальную дозу вводят в виде двух отдельных в/в инфузий: при первой инфузии вводят 300 мг, затем через 2 недели вводят еще 300 мг. Все последующие дозы вводят в виде однократной в/в инфузии в дозе 600 мг каждые 6 месяцев. Первую из последующих доз следует вводить через 6 месяцев после первой инфузии начальной дозы.
Снижение дозы окрелизумаба не рекомендуется.
При возникновении инфузионной реакции во время любой инфузии окрелизумаба необходимо следовать специальным рекомендациям по коррекции инфузии.
Побочное действие
Инфекционные и паразитарные заболевания: очень часто — инфекции верхних дыхательных путей, назофарингит, грипп; часто — синусит, бронхит, герпес слизистой оболочки полости рта, инфекции дыхательных путей, вирусная инфекция, опоясывающий лишай.
Со стороны органа зрения: часто — конъюнктивит.
Со стороны дыхательной системы: часто — кашель, катаральные явления.
Со стороны кожи и подкожных тканей: часто — воспаление подкожно-жировой клетчатки.
Общие реакции: очень часто — инфузионные реакции
Со стороны лабораторных показателей: снижение общей концентрации иммуноглобулинов, в основном за счет снижения уровня IgM (при этом корреляции с развитием серьезных инфекций не отмечалось); в большинстве случаев уменьшение числа нейтрофилов на фоне терапии было транзиторным, отмечалось однократно в ходе терапии, более не повторялось и характеризовалось 1-й или 2-й степени тяжести. Нейтропения 3-й или 4-й степени тяжести наблюдалась приблизительно у 1% пациентов, при этом корреляция с развитием инфекции отсутствовала.
Противопоказания к применению
Активный гепатит В, беременность, период грудного вскармливания, возраст до 18 лет, жизнеугрожающие инфузионные реакции при применении окрелизумаба в анамнезе, повышенная чувствительность к окрелизумабу.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Особые указания
С осторожностью применять у пациентов с застойной сердечной недостаточностью (III и IV ФК по классификации NYHA), на фоне иммунизации живыми и живыми ослабленными вирусными вакцинами, у пациентов в возрасте старше 65 лет, при нарушении функции почек средней и тяжелой степени тяжести.
При применении окрелизумаба может быть повышен риск малигнизации, включая риск развития рака молочной железы.
Развитие инфузионных реакций у пациентов, получающих окрелизумаб, может быть связано с высвобождением цитокинов и/или химических медиаторов. Симптомы могут развиться во время любой инфузии, но наиболее часто — во время первого введения окрелизумаба. Инфузионные реакции могут развиться в течение 24 ч после инфузии.
Симптомами инфузионных реакций могут быть зуд, сыпь, крапивница, эритема, раздражение горла, боль в ротоглотке, одышка, отек глотки или гортани, приливы, понижение АД, повышение температуры тела, повышенная утомляемость, головная боль, головокружение, тошнота и тахикардия. В связи с возможным снижением АД следует рассмотреть возможность приостановки лечения антигипертензивными препаратами в течение 12 ч до начала и на протяжении каждой инфузии.
Необходимо тщательно наблюдать за состоянием пациента на предмет возникновения симптомов инфузионных реакций, как минимум, в течение 1 ч после завершения инфузии. Врач должен предупредить пациента о том, что развитие инфузионных реакций возможно в течение 24 ч после инфузии.
При развитии тяжелых симптомов со стороны дыхательной системы (таких как бронхоспазм или эпизод обострения бронхиальной астмы) инфузию следует немедленно прекратить. Продолжать терапию в дальнейшем нельзя.
После проведения симптоматического лечения пациент должен находиться под наблюдением до полного разрешения симптомов со стороны дыхательной системы, поскольку за первоначальным улучшением симптомов может последовать их ухудшение.
У пациентов с активной инфекцией применение окрелизумаба следует отложить до купирования инфекции.
Лекарственное взаимодействие
При одновременном применении окрелизумаба и иммуносупрессирующей и иммуномодулирующей терапии, включая ГКС в иммуносупрессирующих дозах, ожидается увеличение риска иммуносупрессии. Таким образом, необходимо учитывать риск развития аддитивного эффекта на иммунную систему.
При переводе пациента с терапии препаратами, обладающими пролонгированным действием на иммунную систему (даклизумаб, финголимод, натализумаб, терифлуномид или митоксантрон), на терапию окрелизумабом необходимо учитывать длительность и механизм действия данных препаратов из-за возможности аддитивного эффекта на иммунную систему.
Товары из категории — Препараты для лечения онкологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 229 700
Лекарственная форма
Фармсредство Окревус выпущено в форме концентрированного вещества для приготовления инфузионного раствора, вводимого в сосудистое русло напрямую.
Состав
Главный компонент средства – окрелизумаб, антогонист лимфоцитарного белкового корецептора CD20, моноклональное антитело, действенный вещество для лечения начальной и прогрессирующей стадии РС.
Дополнительные элементы состава – этановая кислота, ацетат натрия (CH3COONa), инъекционная вода, ПАВ (оксиэтилированный сорбитан – полисорбат), микоза (дисахарид).
Средняя цена флакона Окревус 30 мг/1 мл – 256 000 руб.
Описание
Концентрат представляет жидкость, обесцвеченную, иногда с оттенками перламутра и гаммы коричневых тонов.
Производителем лекарства считается фармацевтическая корпорация Хоффманн Ла Рош (Канада), но в продаже встречаются медикаменты американского производства (Genentech). По сути, это один изготовитель, поскольку эти компании объединились 20 лет назад в одно предприятие. В настоящий момент стоимость препарата слишком дорогая, поэтому есть смысл покупать его в интернете на сайтах, привозящих Окревус из Германии по доступной цене – в этом случае оно, гораздо, дешевле.
Фармакотерапевтическая группа
Препарат относится к группе иммунодепрессантов избирательного действия (моноклональных антител), отличающихся иммуносупрессивным, подавляющим воздействием на иммунную систему. Применяется для терапии хронического рассеянного склероза.
Из-за стоимости препарата, пациенты с РС стремятся найти аналоги Окревуса по сходной цене. Равнозначным заменителем считается пероральное средство Гилениа в виде капсул с рабочим веществом финголимод. Однако у препарата ряд противопоказаний и побочных эффектов, кроме того, его нельзя употреблять при больной печени.
Фармакологические свойства
Вещество окрелизумаб разработано с использованием новейших технологий генной инженерии. Иммуноглобулин проявляет воздействие на В-лимфоциты, преобразующие антиген CD20.
Фармакологическая динамика моноклонального соединения:
- регуляция пептидных информационных молекул;
- стимуляция выработки аутоагрессивных антител;
- участие в формировании фолликулоподобных и лимфоидных эктопий в оболочках мозга с целью истощения корецептора CD20.
Окрелизумаб отличается селективным действием и избирательно осуществляет связывание с поверхностями клеток.
Модель гуманизированного иммуноглобулина имеет две камеры всасывания и обратимое выведение. При дозировке средства 0,6 г каждые шесть месяцев, наибольшая концентрация вещества в крови больного – 212 мгк/мл.
При первичном рецидивирующем РС максимальный уровень – 140 мкг/мл, если препарат вводится внутривенно дважды по 0,3 г в течение 14 дней каждые полгода. Метаболизм окрелизумаба до конца не определен, поскольку очищение происходит, вследствие диссимиляции. На выведение влияет клиренс креатинина (49,0 мл в 24 часа).
При начальной фазе функциональной недостаточности почек и печени, изменений в фармакокинетике не наблюдалось. Нет данных о воздействии компонента при тяжелых почечных и печеночных заболеваниях.
Известно, что нет разницы в абсорбции, расщеплении и экскреции вещества у пациентов с отличной гендерной принадлежностью.
Показания к применению
Рассеянный склероз – хроническая патология, при которой поражение захватывает электроизолирующую (миелиновую) оболочку спинного и головного мозга. Опасность заболевания при отсутствии адекватной терапии заключается в значимом ограничении физических возможностей больного, множественных нарушений работы различных органов, неудовлетворительной интеллектуальной деятельности.
Лекарство Окревус признано результативным средством в борьбе с этой патологией и рекомендовано для терапии хронических и начальных прогрессирующих форм заболевания.
Концентрированное инфузионное средство Окревус можно купить, заказав через интернет с доставкой по всей территории РФ, также оно находится в продаже в аптечных сетях.
Мониторинг средств от рассеянного склероза помог обнаружить еще один сравнительно недорогой аналог препарата Окревус – Бетаферон (стоит 35000 руб.), выпускаемый в форме лиофилизата для приготовления раствора для подкожных инъекций. В данном случае уколы пациент может делать себе самостоятельно.
Противопоказания
Лекарство имеет несколько ограничений. Окревус нельзя использовать при следующих патологиях и состояниях:
- высокая биологическая сенсибилизация к действующему компоненту и прочим соединениям в составе концентрата;
- внутриутробное развитие ребенка;
- естественное вскармливание;
- хроническое вирусное поражение печени гепатитом в активной стадии.
Не разрешается применять препарат для пациентов, не достигших 18 лет, так как безвредность и польза такого вмешательства остается под вопросом. Дополнительным ограничением считается предрасположенность к негативным реакциям организма во время инфузионного ввода раствора Окревус.
Особых мер предосторожности требует назначение препарата пациентам с нарушениями работы почечного аппарата средней и тяжелой стадии. Использование опасно при необходимости проведения вакцинации живыми и аттенуированными возбудителями.
Применение инфузий Окревус связано с повышенной угрозой перерождения здоровых клеток в доброкачественные и злокачественные, в частности возникновения опухолей молочных желез. Перед использованием средства важно полноценное обследование больных с функциональной недостаточностью сердечной мышцы.
Среди прочих средств для лечения РС выделяются такие аналоги Окревуса, как капсулы Несклер, инъекционный раствор Плегриди, лиофилизат для подкожного введения Инфибета. Эти препараты имеют хорошие отзывы, а стоят значительно дешевле Окревуса. Но существуют и более дорогостоящие медикаменты, к примеру, Лемтрада (концентрат для инфузий).
Применение во время беременности и в период грудного вскармливания
Есть данные о том, что окрелизумаб способен проникать через планцентарный барьер, из-за чего эмбриональное развитие плода нарушается, и в будущем в организме новорожденного наблюдается дефицит В-лимфоцитов. Особенно повышен риск при введении вакцин, и понадобится время для восстановления нормального уровня В-клеток. Во избежание лимфоцитопении у младенца во время лечения использование инфузий Окревуса противопоказано, если имеет место вынашивание ребенка. Пациенткам в период терапии рекомендуется применение надежных контрацептивов для предупреждения зачатия. Способ или противозачаточный препарат выбирается врачом.
Из-за отсутствия достоверной информации о проникновении компонента в материнское молоко и его безопасном влиянии на состоянии женщины и ребенка, в период грудного вскармливания внутривенное введение вещества нежелательно.
В аптеки и интернет-магазины Москвы и северной столицы Окревус доставляется немецкой службой доставки из Германии, разумеется, при наличии сертификатов и документации, подтверждающей подлинность концентрата. Оплата же производится лишь после получения лекарства.
Способ применения и дозы
Противосклеротическое средство Окревус должно применяться точно в соответствии с рекомендациями врача, при этом требуется соблюдение установленных правил:
- инфузии проводятся под контролем доктора, когда в его арсенале есть необходимые инструменты и препараты для оказания срочной помощи в экстренных случаях;
- особенно важно присутствие невролога, если обнаружены побочные действия инфузионной терапии;
- требования предусматривают наблюдение за состоянием пациента на протяжении часа после процедуры и дальнейший периодический мониторинг самочувствия пациента;
- недопустимо струйное вливание в кровеносное русло и быстрые болюсные внутривенные инъекции, повышающие уровень медикамента в кровотоке – разрешается лишь медленное капельное введение внутрь вены с использованием стерильного катетера.
Перед инфузией в обязательном порядке осуществляется медикаментозная подготовка больного к процедуре – для этого за полчаса до мероприятия вводится глюкокортикостероидный препарат Метилпреднизолон в объеме 0,1 г внутривенно. Это необходимо для предотвращения или, по крайней мере, уменьшения нежелательных эффектов.
Дополнительно рекомендуется вводить антигистамины за полчаса либо за час до каждой капельницы – такие действия снижают выраженность негативных реакций и частоту их проявлений. Некоторые патологические симптомы также требуют премедикацию жаропонижающими средствами, и чаще иных используется Парацетамол и Ацетаминофен, к тому же, отличающийся анестезирующим, болеутоляющим действием. Применять их надо за 30-40 минут до инфузии.
Схема лечения Окревусом и рекомендуемые дозировки:
- Для результативного лечения достаточно капельное введение 0,6 г препарата по прошествии каждого полугодия. При этом предусмотрено первоначально разделять это количество на две инфузии по 0,3 г, и проводить процедуру дважды с разрывом в 14 дней.
- В дальнейшем разрешено однократное вливание дозы 0,6 г с непременной, предварительной подготовкой требуемыми средствами. Недопустимо использовать лекарство раньше 5 месяцев после проведенной ранее инфузии.
Процесс первичного введения (300 мг в 250 мл) должен начинаться на скорости не более 30 мл в час с последующим увеличением до 180 мл в час, увеличивая шаг (30 мл) каждые полчаса. Каждое вливание занимает приблизительно 2,5 часа. Второе введение начальной дозы (300 мг в 250 мл) осуществляется строго через две недели.
Спустя полгода и в будущем понадобятся однократные инфузии (600 мг в 500 мл), которые начинаются на скорости 40 мл в час, и при увеличении каждые полчаса на 40 мл достигают скорости 200 мл в час. Время процедуры примерно 3,5 часа.
Нельзя допускать пропусков в лечении, поскольку это ведет к снижению его эффективности. Если по независящим от больного причинам это произошло, использовать Окревус нужно как можно скорее.
Корректировка дозировок в сторону снижения нежелательна, но отдельные ситуации требуют принятия экстренных решений. Это положение относится к различных степеням тяжести протекающих негативных реакций – на фоне инъекций во время введения и после них:
- Если побочные эффекты инфузии слабо выражены, то процедуру разрешается продолжать на минимальной скорости 30 мл в час, не превышая ее. Бывает, что симптомы сохраняются недолгое время и исчезают сами собой, иногда в течение часа. При таких условиях и удовлетворительном самочувствии больного допускается медленное увеличение скорости вливания.
- Когда выявлены серьезные нарушения в состоянии пациента, вливания прерывают и назначают терапию по существующим симптомам. Это касается таких проявлений, как озноб, выраженная гиперемия лица и шеи, отеки и болезненность гортани, озноб, повышение температуры. Реновация возможна лишь после устранения отрицательных признаков, а скорость инфузии уменьшается вдвое, по сравнению с процессом, приостановленным при возникновении патологий.
- Что касается состояний, представляющих риск для здоровья и жизни больного, при обнаружении тяжелых аномалий, понадобится отменить инъекции лекарства, без возобновления его применения в будущем. Поводом к отмене служит синдром респираторного расстройства (острое воспаление легких с отеком органа) и острые реакции повышенной чувствительности, угрожающие инвалидностью и даже летальным итогом.
Дозирование для отдельных категорий больных:
- У пациентов с почечной дисфункцией в коррекции дозы нет необходимости, поскольку главный компонент выводится путем диссимиляции, в котором почки не участвуют.
- Для больных с нарушениями работы печени не требуется изменение доз препарата – выведение действующего вещества также происходит в процессе энергетического обмена.
- Из-за отсутствия клинических исследований нет достоверных данных о пользе и безопасности использования инфузий окрелизумаба у пациентов младше 18 и старше 65 лет.
Процедуру капельного введения проводит только врач, он же обязан выполнять требования по правильному приготовлению инфузионного раствора. Важно знать, что разведенное лекарство используется однократно. При разбавлении концентрата в жидкости допускается наличие микроскопических прозрачных частиц, придающих ей перламутровый оттенок. Нельзя применять средство, если оно изменило цвет и содержат посторонние инородные тела.
Для процедуры используется специализированная капельная система, фильтр которой составляет 0,22 микрон. Концентрат разводится, непосредственно, в пакете для инфузий с раствором хлорида натрия (300мг/250 мл). Нельзя применять холодный раствор, он должен иметь комнатную температуру. Готовое лекарство подлежит хранению лишь в течение суток.
Для приготовления препарата важны стерильные условия. Для растворения концентрата подходит лишь физиологический раствор натрия хлорида 0,9%, применять другие растворители нежелательно. Перед разведением нужно удостовериться в сроках годности, убедиться в допустимости внешнего вида раствора. Применяется антисклеротическое средство в комбинации с совместимыми пакетами для инфузий из полиолефина, поливинилхлорида.
По отзывам, инфузионный концентрат Окревус быстро помогает при начальных стадиях заболевания:
- отмечено, что у пациентов с ухудшением зрения одного глаза быстро восстанавливается состояние органа и его функциональность;
- исчезает болезненное ощущение постороннего предмета в глазу, пелена и расплывчатое восприятие;
- устраняются головные боли в области затылка и темени, периодические головокружения;
- перестают беспокоить причинявшие столько неприятных ощущений неожиданные нарушения координации и равновесия;
- приходит в норму почерк, который успел измениться при развитии заболевания;
- также пациенты делятся, что отступают такие симптомы, как онемение, покалывания, стягивание кожи и прочие нарушения чувствительности.
Больные с диагнозом рецидивирующий РС, оставляют такие отзывы об Окревусе:
- даже после одной инфузии наблюдаются улучшения памяти, концентрации внимания;
- облегчается депрессивное состояние;
- выравнивается походка, нормализуется ориентация и координация движений;
- у многих после года лечения проходят мышечные спазмы конечностей, восстанавливается артикуляция речи;
- пациенты снова начинают воспринимать различные оттенки цветов, проходит боль в ногах и руках, не беспокоит недержание мочи.
Читая многочисленные отзывы о действии Окревуса, приходится признать эффективность данного средства, врачи же подчеркивают, что положительный результат, более всего, достижим при его использовании на самых ранних сроках проявления болезни.
Побочное действие
Многие негативные симптомы развиваются уже во время инъекций Окревуса, способны возникать на протяжении суток после процедуры, сохраняться не менее часа и гораздо дольше.
Распространенные нарушения на фоне капельных вливаний препарата:
- повышенная работа потовых желез;
- головные боли, мигренеподобные приступы;
- осложненное дыхание;
- отекание гортани и горла;
- тяжесть, ощущаемая в грудной клетке;
- приступы тошноты;
- высыпания на коже, имеющие красный цвет;
- сонливое состояние;
- озноб, лихорадка;
- тахикардия (учащенный ритм сердца);
- потеря ориентации, координации, головокружение;
- жжение и зуд кожи;
- анафилактические реакции, включающие ангионевротический отек лицевых подкожных тканей, языка, губ, шеи.
Прочие признаки нарушений, ухудшающие самочувствие больного, инфекционные проявления:
- вирусные поражения дыхательных органов;
- оральный герпес с появлением на деснах, оболочках полости, языке и небе пузырчатых сыпей, которые способны распространяться на глоточные и небные миндалины и стенки глотки, также, отечность слизистой, боль при приеме пищи, сухость, формирование язв с кровоточивыми корками;
- герпес опоясывающий (лишай), сопровождаемый кожными высыпаниями, субфебрильной температурой, расстройством работы желудка и кишечника, болезненным зудом и жжением;
- нарушение мочеиспускания, при оставлении состояния без внимания – с образованием сливающихся красных папул, превращающихся в пузырьки, и последующими проявлениями невралгии;
- риновирусная инфекция (эпифарингит) – простудное воспаление носоглотки с сопутствующими эффектами: гипертрофией лимфоузлов, жжением и зудом в носу, головными болями, непродуктивным, ночным кашлем, одышкой, нарушением сна, повышенной температурой, артралгией и миалгией;
- острый бронхит с приступами кашля, хрипами, небольшим либо существенным подъемом температуры, болью в гортани, спазмами в горле, приводящими к гипоксии;
- воспаление околоносовых полостей с поражением верхней челюсти при синусите с нарушением обонятельных рецепторов, ухудшением носового дыхания, гнойными выделениями;
- грипп с резким подъемом температуры (до 39 градусов), насморком, обильной секрецией из носовых ходов, покраснением глаз и слезотечением, схожим с аллергической реакцией;
- со стороны зрения симптомы конъюнктивита – отек век и слизистой глаза, боль, воспаление конъюнктивы, слизистые или гнойные выделения, в зависимости от этиологии.
Большинство случаев возникновения инфекционных поражений связано с предшествующим приемом глюкокортикостероидов, иммуносупрессивных средств.
Негативное воздействие препарата во время инфузий нашло свое отражение и в результатах лабораторной диагностики пациентов – было выявлено снижение уровня иммуноглобулинов, уменьшение количества нейтрофилов, в основном, при рецидивирующей стадии рассеянного склероза.
Лечения РС Окревусом необходимо прекратить, если наблюдаются такие патологии:
- выраженное изменение психического самочувствия;
- ощущение слабости в одной стороне тела;
- колющие боли в груди;
- признаки удушья и нехватки воздуха;
- гиперемия кожи;
- маленькие открытые язвочки на губах, около носа и на подбородке;
- кашель с мокротой зеленого или синего цвета;
- неврологические боли;
- ухудшение координации, зрения и речевой функции.
К несчастью, это только часть побочных действий, проявляющихся при использовании Окревус, и, чаще всего, причина этого – хронические нарушения, присутствующие в организме больного. С целью предотвращения подобных неприятностей перед началом терапии требуется тщательная диагностика.
Диапазон цен на лекарство Окревус может меняться, в зависимости от количества купленных ампул, и составлять 220-440 000 руб. (30 мг/мл)
Передозировка
Исследования показывают, что дозировки в объеме 2000 мг, разделенные на два введения в течение двух недель, способны вызывать негативные реакции со стороны организма, но они допустимы в соответствии с нормами по безопасности.
Если произошло случайное превышение рекомендуемой порции лекарства, нужно прекратить капельное вливание и выяснить степень развития нежелательных проявлений. Специального метода по купированию подобных состояний при использовании Окревуса не разработано, и вопрос дальнейшей терапевтической тактики решает невролог.
Взаимодействие с другими лекарственными средствами
В комбинации с фармакологическими препаратами, угнетающими иммунные реакции организма, и средствами, увеличивающими повышение естественного защитного механизма, предусматривая и параллельное применение глюкокортикостероидов во время лечения рассеянного склероза Окревусом, важно учитывать угрозу, связанную с взаимным усилением разных компонентов и чрезмерно мощном воздействии на иммунитет.
Если ранее использовались такие лекарства длительного действия, как противоопухолевый препарат Митоксантрон, иммуномодулятор Терифлуномид, Финголимод, Натализумаб, Даклизумаб (лекарства для терапии РС), также необходимо понимать, что вероятен нежелательный аддитивный эффект, способный ухудшить состояние больного.
Поскольку не предполагается динамики взаимных реакций с ферментативными веществами и копереносчиками, включая цитохромы системы Р450, клинических испытаний взаимодействий окрелизумаба с прочими фармсредствами проведено не было.
Пациенту при визите к неврологу нужно сообщить обо всех прописанных ранее и принимаемых в настоящее время лекарствах, чтобы избежать опасных сочетаний и ухудшения самочувствия.
Особые указания
Реакции на инфузию – наиболее частое проявление во время лечения РС Окревус, и способны возникать уже при дозировке в 600 мг. Но предельная интенсивность сопровождает только первое вливание, после чего значимо уменьшается. Данные нарушения относятся, скорее к средней и даже легкой степени тяжести.
В медицинской практике зарегистрированы отрицательные проявления, такие как:
- подъем температуры;
- быстрая утомляемость, слабость;
- снижение давления;
- отекание тканей горла;
- затруднение дыхательной функции, одышка;
- учащенное сердцебиение;
- головокружение;
- аллергические высыпания;
- выраженная гиперемия из-за расширения сосудов;
- внезапно наступающее ощущение жара в голове, резкое повышение температуры;
- болезненность тканей ротовой полости.
Первые вливания раствора окрелизумаба способны провоцировать признаки невосприимчивости к инсулину в течение суток после введения препарата, выражающиеся:
- в перепадах давления;
- рассеянности, ослаблении концентрации внимания;
- угнетенном настроении;
- усилении голода.
Эти симптомы легко перепутать с аллергическими реакциями первого типа – реагиновой и анафилактической, но они иногда выглядят, как бронхоспазм, аллергический ринит, обильное слезотечение, кожный зуд, дерматические сыпи. При подобной клинической картине инфузию прекращают без последующего возобновления.
Понижение кровяного давления, зачастую, косвенно, относится к признакам инсулинорезистентности – в таких ситуациях больному не следует на протяжении пол суток до вливания и во время него принимать лекарства, понижающие показатели давления.
При дыхательной дисфункции и спазмах бронхов, особенно, если они развились на фоне бронхиальной астмы, процедуру завершают сразу.
Во время прогрессирующего инфекционного заболевания введение Окревуса не назначается до выздоровления пациента. Развитие недуга, в частности, субкортикальной энцефалопатии, большей частью, становится результатом патологий иммунологической реактивности. Такого рода состояния крайне опасны для жизни больного и нередко влекут за собой инвалидизацию. Если существует подозрение на такой диагноз, терапия должна быть остановлена, и понадобится диагностика с использованием магнитно-резонанской томографии, которая выявляет нарушение до проявления первых выраженных симптомов.
К последним относится:
- расстройство ориентации в пространстве;
- помраченность сознания;
- изменение восприятия и личностный дефект, характеризующийся трансформацией мышления;
- ухудшение зрения;
- снижение моторной координации, отражающееся на походке пациента.
Одним из нежелательных проявлений считается возобновление активности возбудителя гепатита В, вследствие чего вероятно развитие недостаточности печени и злокачественного фульминантного гепатита, опасного некротическим поражением паренхимы органа и фатальными последствиями, поэтому до начала лечения РС разумно пройти тестирование на ВГВ. В отношении носителей вируса, больных с отрицательным и положительным серологическим маркером, необходимо принятие мер, предотвращающих реактивацию возбудителя.
После капельных инъекций Окревус до полноценной регенерации и восстановления оптимальной концентрации В-лимфоцитов врачи не советуют проводить вакцинацию на базе любого бактериального материала. Введение живых вакцин способно провоцировать прогрессирование опасных инфекционных болезней, среди которых:
- тиф брюшной – кишечная инфекция, вызванная сальмонеллой;
- варицелла (ветряная оспа);
- ротавирусная инфекция;
- геморрагическое, вирусное заболевание – амариллез (лихорадка желтая);
- поражение ЦНС и спинного мозга вирусом полиомиелита;
- корь;
- свинка или эпидемический паротит с воспалением желез слюнной секреции;
- краснуха (Rubeola);
- герпес Зостер (опоясывающий лишай).
Предварительно врачу понадобится выяснить функциональное состояние иммунитета пациента, что обеспечит безопасность использования инъекций Окревуса.
В связи с отдельными случаями малигнизации, каждый больной обязан пройти процедуру тестирования на склонность к развитию опухолевых новообразований. Вероятность таких перерождений клеток весьма велика.
Установленные меры по безопасности применения Окревуса включают такие пункты:
- не допускается выбрасывать израсходованное средство совместно с прочими бытовыми отходами;
- нельзя проводить утилизацию ампул при помощи канализации;
- по правилам септики запрещается повторное употребление подручных средств для проведения инфузий.
Использованные компоненты нужно сложить в одноразовую плотную, герметичную упаковку, предназначенную для содержания острых предметов.
Влияние на способность управлять транспортными средствами и механизмами
Результаты специальных медицинских исследований на скорость двигательной и психомоторной функции не представлены, но, исходя из того, что среди множества побочных действий выявлены случаи головокружения, рассеянности, головных болей и прочих опасных состояний, на время терапии пациентам разумнее отказаться от управления сложным оборудованием и каким угодно транспортом.
Форма выпуска
Выпускается в одном закупоренном стеклянном пузырьке с колпачком из алюминия 0,3 мл/10 мл вместе с инструкцией в картонной коробке. Купить иммуносупрессор Окревус в России можно по цене не ниже 214 000 руб. за пузырек в аптеках и медицинских учреждениях.
Срок годности
Годность средства – два года. Условия продажи препарата Окревус неизменны – купить его можно лишь по рецепту невролога.
Условия хранения Окревус
Для хранения лекарства подходит прохладное и темное место с температурой от 2 до 8 градусов.
В России, по сведеньям медицинской статистики, насчитывается до 150 000 пациентов с рассеянным склерозом. Причем это не сплошь пожилые граждане, как принято считать, множество молодых людей страдает нарушениями памяти и прочими симптомами опасного заболевания, способного приводить к инвалидности.
До некоторого времени не существовало препарата для оказания помощи больным с первичными формами недуга, теперь необходимое средство найдено, и это окрелизумаб – вещество, разработанное фармацевтами компании Genetech. Вероятно, этим объясняется, что цена на Окревус столь высока, ведь стоимость полного курса составляет свыше миллиона руб. Невзирая на то, что рассчитывать на автоматическую доступность медикамента наивно, общественные организации российских инвалидов делают все, чтобы обеспечить надлежащим лечением всех нуждающихся.
Цены на Окревус в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 229 700 руб.
Сертификаты и лицензии
Московский городской центр рассеянного склероза на базе Городской клинической больницы №11
Хорошилова И.И.
ООО «Нейроклиника», Москва, Россия
Петров С.В.
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова», Санкт-Петербург, Россия, ГБУЗ «Елизаветинская больница», Санкт-Петербург, Россия.
Мельников М.В.
Кафедра общей хирургии Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова
- SPIN РИНЦ: 3735-4266
Бойко А.Н.
КГБУЗ «Красноярский краевой Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями»
- Scopus AuthorID:
57224826008 - ORCID:
0000-0001-6476-6417
Изменения качества жизни пациентов с рассеянным склерозом на фоне курса лечения окрелизумабом
Авторы:
Бойко О.В., Хорошилова И.И., Петров С.В., Мельников М.В., Бойко А.Н.
Как цитировать:
Бойко О.В., Хорошилова И.И., Петров С.В., Мельников М.В., Бойко А.Н. Изменения качества жизни пациентов с рассеянным склерозом на фоне курса лечения окрелизумабом. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски.
2019;119(10‑2):120‑127.
Boĭko OV, Khoroshylova II, Petrov SV, Mel’nikov MV, Boĭko AN. Changes in the quality of life in patients with multiple sclerosis treated with ocrelizumab. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2019;119(10‑2):120‑127. (In Russ.)
https://doi.org/10.17116/jnevro201911910120
Рассеянный склероз (РС) остается актуальной проблемой современной неврологии, несмотря на существенное повышение возможностей патогенетической терапии этого заболевания. В настоящее время зарегистрировано 15 препаратов для лечения ремиттирующего течения РС (РРС), однако возможности лечения прогрессирующих форм РС (первично- и вторично-прогрессирующего РС — ППРС и ВПРС соответственно) пока не столько широки [1]. Окрелизумаб является одним из препаратов широко спектра, эффективность которого показана в клинических исследованиях и при течении РС с обострениями, и при ППРС [2, 3], что явилось основанием для включения препарата в соответствующие Европейские клинические рекомендации [4].
Окрелизумаб — моноклональное антитело (МАТ) против CD-20 поверхностного маркера В-клеток (торговое название — Окревус, производство «Ф. Хоффманн-Ля Рош», Швейцария). В марте 2017 г. окрелизумаб был зарегистрирован в Северной Америке, в конце 2017 г. — в странах Европейского Союза и многих других. В октябре 2017 г. окрелизумаб был одобрен к применению в Российской Федерации для лечения взрослых пациентов с различными формами РС и активно используется как один из наиболее эффективных среди препаратов, изменяющих течение РС (ПИТРС).
Одним из необходимых методов анализа эффективности лечения РС являются результаты, сообщаемые пациентами (РСП)1. РСП определяются как «любые сообщения о состоянии здоровья пациентов, которые получены непосредственно от пациентов, без интерпретации ответа пациентов клиницистами или другими лицами» [5]. РСП включают исследования качества жизни (КЖ) пациентов, связанного со здоровьем, а также оценку выраженности различных симптомов, удовлетворенности лечением, работоспособности, самочувствия, приверженности к лечению, а также в существенной степени — оценку уровня депрессии, хронической усталости и когнитивных функций и т. д. [6, 7]. Изучение РСП считается абсолютно необходимым для оценки результатов лечения любого неврологического заболевания, включая РС, что определяет перспективы его внедрения [7, 8]. С другой стороны, при оценке РСП должны учитываться многие неспецифические и коморбидные состояния, которые влияют на психометрическую оценку результатов опроса [9].
Исследования КЖ как наиболее информативного варианта РСП у пациентов с РС проводятся уже десятки лет. РС влияет и на трудовую деятельность, и на социальную активность пациентов и затрагивает членов их семей, что обусловливает комплекс проблем, связанных с КЖ при РС [10]. Для изучения КЖ при РС используют неспецифические и специфические опросники. Неспецифические (общие) опросники позволяют оценить, как заболевание в целом влияет на здоровье больного, независимо от специфики нарушений или типа получаемого лечения. Наиболее распространенным и информативным неспецифическим опросником для оценки КЖ является опросник Short Form-36 (SF-36). Была создана и валидизирована форма этого опросника и на русском языке [11, 12]. В 2008 г. международной группой исследователей при участии кафедры неврологии, нейрохирургии и медицинской генетики РНИМУ им. Н.И. Пирогова был создан и валидизирован на многих языках, включая русский, специфический опросник MusiQoL [13, 14]. Для сбора наиболее полной информации возможно использование одновременно и неспецифического, и специфического опросников (SF-36 и MusiQoL).
Цель исследования — изучение КЖ и уровня депрессии у пациентов с РС, получающих окрелизумаб на протяжении не менее чем 12 мес.
Материал и методы
Обследовали 38 больных РС (диагноз был установлен согласно критериям МакДональда в модификации 2017 г. [15]), которые наблюдались в 2017—2019 гг. в нескольких московских неврологических клиниках, являющихся клиническими базами кафедры неврологии, нейрохирургии и медицинской генетики лечебного факультета РНИМУ им. Н.И. Пирогова. Клинико-демографические характеристики пациентов представлены в табл. 1.
Всем пациентам был назначен прием окрелизумаба (курс не менее 1 года).
Окрелизумаб (Окревус, «Рош», Швейцария) вводили внутривенно капельно по схеме: 2 ведения по 300 мг 1 раз в 14 сут, далее — по 600 мг 1 раз в 6 мес. Оценку К.Ж. проводили с помощью опросников SF-36 и MusiQoL.
Одновременно определяли выраженность депрессии по шкале Бека (ШБ) и выраженность синдрома хронической усталости по ранее валидизированной модифицированной шкале утомляемости (Modified Fatigue Impact Scale — MFIS) [17]. ШБ является одним из наиболее распространенных нейропсихологических тестов для выявления и оценки тяжести депрессии, в том числе у больных с РС. ШБ охватывает 21 симптом депрессии: пониженное настроение, пессимизм, чувство недовольства собой, неудовлетворенности, вины, самообвинение, влечение к смерти, раздражительность, неспособность к работе, нарушение сна и т. д. Применительно к каждому вопросу возможны четыре утверждения, отражающие различные степени самооценки. Опросник выдавался пациентам без названия подшкал. Набранные баллы суммировались: 0—9 баллов — отсутствие депрессивных симптомов, 10—15 — легкая депрессия (субдепрессия), 16—19 — умеренная депрессия, 20—29 — выраженная депрессия (средней тяжести), 30—63 — тяжелая депрессия.
MFIS основана на вопросах, которые наиболее часто возникают при разговоре с пациентами о влиянии хронической усталости (утомляемости) на их жизнь. MFIS оценивает влияние утомляемости с точки зрения физического, когнитивного и психосоциального функционирования пациента. Шкала содержит 21 вопрос, ответы на которые подразумевают выбор: никогда, редко, иногда, часто, почти всегда. За каждый ответ начисляется 0, 1, 2, 3 или 4 балла соответственно. Баллы, начисленные за каждый вопрос, суммировались. Вопросник заполнялся пациентами полностью под контролем врача, который объяснял неясные моменты. Результат от 0 до 12 оценивался как минимальная утомляемость, от 13 до 36 — как умеренная утомляемость, от 37 до 84 — как выраженная утомляемость.
Статистическое сравнение результатов проводили с использованием непараметрического U-критерия Манна—Уитни, который применяется для оценки различий между двумя малыми выборками по уровню количественно измеряемого признака.
Результаты и обсуждение
Данные первичного исследования КЖ у больных с разными типами течения РС
В исследование включены данные наблюдения за больными РС на протяжении не менее чем 12 мес с тремя типами течения заболевания. Пациенты с ППРС имели изменения КЖ, которые были близки к ранее полученным в результате мультицентрового исследования ППРС (437 пациентов) в России с использованием опросника MusiQoL [18] (табл. 2).
Кроме того, базовые характеристики КЖ больных с ВПРС настоящего исследования сравнивали в результатами исследований [19, 20], проведенных Москве и Новосибирске c участием 95 пациентов с ВПРС, в которых использовали неспецифический опросник SF-36 (табл. 3).
Наиболее информативно сравнение базовых показателей КЖ у пациентов с ВАРС с базовыми данными 39 пациентов с активным РРС из московских клиник, опрошенных с использованием SF-36 и MusiQoL [22]. Критерии назначения и клинические характеристики этих пациентов, которые затем получали лечение натализумабом, близки к критериям ВАРС настоящего исследования. Характерно снижение многих показателей, характеризующих не только физическое и психическое состояние пациентов, но и их отношение к социуму и системе здравоохранения, которое связано с активным течением РС с частыми обострениями, несмотря на проводимое лечение (табл. 4).
Таким образом, исследование базовых показателей КЖ больных РС до лечения не выявили существенных отличий от ранее полученных результатов.
При базовом исследовании средний показатель по шкале Бека (ШБ) составил 9,6 балла: у большинства больных — у 20 (86,8%) — меньше 9 баллов, только у 5 (13,2%) больных этот показатель был выше 19 баллов, что указывает на наличие депрессии. Средний показатель по MFIS был 14,5 балла, отчетливая хроническая усталость с показателем больше 36 была выявлена у 16 (42,1%) больных.
Динамика показателей КЖ у больных РС на фоне терапии окрелизумабом
На фоне терапии окрелизумабом у 38 пациентов с РС за 12 мес не было отмечено нарастания показателя по шкале EDSS ни в одном случаев. Средний показатель по EDSS несколько снизился (с 3,8 до 2,5 балла), в первую очередь за счет пациентов с ВАРС. У больных с ППРС снижение по EDSS на 0,5 балла наблюдалось в 6 (46,2%) случаях из 13, а при ВПРС — в 6 (60%) случаях из 10, что является очень позитивным изменением для такого типа течения Р.С. Только у 1 пациента между первым и вторым введением окрелизумаба было зарегистрировано обострение при ВАРС, в дальнейшем за 12 мес наблюдения ни у пациентов с ВАРС, ни при ВПРС обострений не было.
На фоне курса окрелизумаба через 12 мес выявлялось достоверное повышение показателей КЖ по многим доменам как SF-36 (ФФ, РФФ, ОБ, ФЗН, РЭФ, ПЗ), так и MusiQoL (ДА, ПС, Коп, ЩС, ОС, ОИ) (табл. 5),
Однако при применении натализумаба не наблюдалось достоверного изменения показателей по доменам ПЗ и РЭФ (шкала SF-36) и по некоторым социальным шкалам опросника MusiQoL, что указывает на сохраняющееся напряжение в психическом плане. Это может быть связано с нерешенными вопросами длительности курса у пациентов с повышенным риском развития нежелательных явлений, в первую очередь — прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ). При высоком титре антител к JC-вирусу не рекомендуется использовать натализумаб длительное время (более 2 лет) из-за резкого повышения риска развития ПМЛ, в связи с чем пациенты, как правило, высказывают беспокойство по поводу более продолжительного лечения. При применении окрелизумаба таких нежелательных явлений не возникало.
Позитивная динамика показателей, характеризующих психическое состояние пациентов и ролевые функции, ОБ и ЖЗН, при терапии окрелизумабом наблюдается уже через 6 мес, т. е. на ранних сроках терапии, тогда как повышение показателей клинического состояния и физического функционирования — только к 12-му месяцу (см. табл. 5). Так, достоверное уменьшение показателей депрессии по ШБ было отмечено через 6 мес, т. е. после введения первой дозы препарата (300 и 300 мг с интервалом в 14 сут) (см. рисунок).
Таким образом, на фоне курса окрелизумаба через 12 мес наблюдалось улучшение показателей клинического состояния пациентов с ВАРС, ППРС и ВПРС и обострениями и, как следствие, повышение КЖ пациентов. Это может быть связано как с высокой эффективностью, так и с хорошей переносимостью и удобным применением препарата (введение препарата 1 раз в 6 мес). Кроме того, было выявлено достоверное повышение показателей КЖ, ФФ и ПЗ, существенное и быстрое уменьшение выраженности депрессии. Это привело к улучшению показателей жизнедеятельности, общего благополучия, отношений с социумом и общего индекса КЖ.
Существенное улучшение показателей КЖ больных РС было выявлено ранее на фоне лечения высокоэффективными ПИТРС независимо от активности РС, длительности заболевания или возраста пациентов [23, 24]. Исследование в российской популяции подтвердило позитивные изменения КЖ на фоне курса натализумаба [22, 26].
В настоящем исследовании было выявлено быстрое улучшение показателей КЖ, оцененных как по специфическому для РС, так и по неспецифическому опроснику, что на ранних сроках, по крайней мере частично, совпадало с уменьшением выраженности депрессии.
РСП, в том числе оценка КЖ, в настоящее время являются важным компонентом оценки эффективности и переносимости терапии хронических заболеваний. Они позволяют определить, являются ли лечебные воздействия эффективными с точки зрения пациента, выбрать наиболее адекватные методы терапии [8]. Именно изменения в КЖ отражают отношение самого пациента к своему состоянию. Окрелизумаб сейчас является одним из наиболее перспективных препаратов, активно используемых при различных формах РС [27]. Результаты настоящего исследования показали улучшение показателей КЖ у больных РС на фоне 12-месячного курса окрелизумаба, причем улучшение показателей психического состояния пациентов опережало динамику показателей физического функционирования. Обращает на себя внимание быстрая положительная динамика показателей по ШБ, что сложно связать только с иммуномодуляцией. Особенности действия препарата будут уточняться в следующих исследованиях.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Бойко О.В. — https://orcid.org/0000-0001-715305617
Хорошилова И.И. — https://orcid.org/0000-0001-6006-4952
Петров С.В. — https://orcid.org/0000-0002-3114-749X
Мельников М.В. — https://orcid.org/0000-0001-6880-3668
Бойко А.Н. — https://orcid.org/0000-0002-2975-4151
Как цитировать:
Бойко О.В., Хорошилова И.И., Петров С.В., Мельников М.В., Бойко А.Н. Изменения качества жизни пациентов с рассеянным склерозом на фоне курса лечения окрелизумабом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019;119(10, вып. 2):120-127. https://doi.org/10.17116/jnevro2019119102120
Автор, ответственный за переписку: Бойко Алексей Николаевич — e-mail: boykoan13@gmail.com
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями
использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании
файлов cookie, нажмите здесь.
DOI: https://doi.org/10.21518/2079-701X-2019-9-64-71
Долгосрочные результаты терапии рассеянного склероза окрелизумабом:
КЛИНИЧЕСКАЯ И МРТ-ЭФФЕКТИВНОСТЬ И ПРОФИЛЬ БЕЗОПАСНОСТИ
Д.Л. КЛАБУКОВА1, М.В. ДАВЫДОВСКАЯ12
1 Государственное бюджетное учреждение города Москвы «Научно-практический центр клинических исследований и оценки медицинских технологий Департамента здравоохранения города Москвы»: 121096, Россия, г. Москва, ул. Минская, д. 12, корп. 2
2 Федеральное государственное бюджетное образовательное учреждение высшего образования «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации: 117997, Россия, г. Москва, ул. Островитянова, д. 1
Информация об авторах: Клабукова Дарья Леонидовна — к.б.н., ведущий научный сотрудник отдела лекарственного обеспечения и фарма-коэкономического анализа Государственного бюджетного учреждения города Москвы «Научно-практический центр клинических исследований и оценки медицинских технологий Департамента здравоохранения города Москвы»; тел.: +7(916)
916-54-34; e-mail: daria.klabukova@ gmail.com
Давыдовская Мария Вафаевна — заместитель директора по научной работе Государственного бюджетного учреждения города Москвы «Научно-практический центр клинических исследований и оценки медицинских технологий Департамента здравоохранения города Москвы»; д.м.н., профессор кафедры
неврологии, нейрохирургии и медицинской генетики Федерального государственного бюджетного образовательного учреждения высшего образования «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Министерства здравоохранения Российской Федерации; тел.: +7(915) 362-78-33; e-mail: mdavydovskaya@gmail.com
РЕЗЮМЕ
Окрелизумаб (Окревус®) представляет собой гуманизированное моноклональное антитело против CD20, одобренное для лечения взрослых с рецидивирующим рассеянным склерозом (РРС) и первично-прогрессирующим рассеянным склерозом (ППРС). В статье представлены данные о клинической и МРТ-эффективности и профиле безопасности препарата окрелизумаб при долгосрочном применении у пациентов с РС различных форм течения. Проведен поиск, систематизация и анализ накопленных данных клинических исследований и реальной клинической практики. По результатам пятилетнего наблюдения при терапии окрелизумабом продемонстрировано значительное и клинически значимое преимущество в снижении прогрессиро-вания заболевания у пациентов с ППРС. У пациентов с РРС после 5 лет лечения окрелизумабом отмечено снижение доли больных с прогрессированием заболевания и степени атрофии головного мозга, а также более частое достижение статуса отсутствия активности заболевания (NEDA) по сравнению с пациентами с отсроченным на 2 года началом лечения окрелизумабом. Профиль безопасности препарата соответствует результатам, полученным в контролируемых периодах клинических исследований.
Ключевые слова: окрелизумаб, рассеянный склероз, эффективность, безопасность, долгосрочные результаты
Для цитирования: Клабукова Д.Л., Давыдовская М.В. Долгосрочные результаты терапии рассеянного склероза окрелизумабом: клиническая и МРТ-эффективность и профиль безопасности. Медицинский совет. 2019; 9: 64-71. DOI: https://doi.org/10.21518/2079-701X^019-9-64-71.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Ocrelizumab therapy and long-term outcomes
in multiple sclerosis:
CLINICAL AND MRI-EFFICACY AND SAFETY PROFILE
Daria L. KLABUKOVA1, Maria B. DAVYDOVSKAYA12
1 State Budgetary Institution of the city of Moscow «Scientific and Practical Center for Clinical Research and Medical Technology Assessment of Moscow Healthcare Department»: 121096, Russia, Moscow, Minskaya St., 12, Bldg. 2
2 Federal State Budgetary Educational Institution of Higher Education Russian National Research Medical University named after N.I. Pirogov of the Ministry of Health of the Russian Federation: 117997, Russia, Moscow, Ostrovityanova St., 1
Author credentials:
Klabukova Daria Leonidovna — Cand. of Sci. (Med.), Leading Researcher, Department of Drug Provision and Pharmacoeconomic Analysis, State Budgetary Institution of the city of Moscow «Scientific and Practical Center for Clinical Research and Medical
Technology Assessment of Moscow Healthcare Department»; tel.: +7(916) 916-54-34; e-mail: daria.klabukova@ gmail.com
Davydovskaya Maria Vafaevna — Deputy Director for Research, State Budgetary Institution of the city of Moscow
«Scientific and Practical Center for Clinical Research and Medical Technology Assessment of Moscow Healthcare Department»; Dr. of Sci. (Med.), Professor of the Chair for Neurology, Neurosurgery and Medical Genetics, Federal State Budgetary
Educational Institution of Higher Education «Pirogov Russian National
Research Medical University» of the Ministry of Health of the Russian
Federation; tel.: +7(915) 362-78-33; e-mail: mdavydovskaya@gmail.com
Ocrelizumab (Ocrevus®) is a humanized anti-CD20 monoclonal antibody approved for the treatment of adults with relapsing multiple sclerosis (RMS) and primary progressive multiple sclerosis (PPMS). The article presents data on the clinical and MRI efficacy and safety profile of ocrelizumab for the long-term use in patients with MS of various forms of the course. The authors performed the search, systematization and analysis of the pooled data of clinical studies and real clinical practice. Five-year follow-up of ocrelizumab therapy showed a compelling and clinically significant advantage in reducing the disease progression in patients with PPMS. After five-year ocrelizumab therapy in patients with PPMS, the study showed a reduction of the proportion of patients with disease progression and degree of brain atrophy, and more frequent achievement of the disease inactivity status (NEDA) as compared to patients with two- year delayed initiation of ocrelizumab therapy. The safety profile of the drug corresponds to the results obtained in the controlled periods of clinical trials.
Keywords ocrelizumab, multiple sclerosis, efficacy, safety, long-term outcomes
For citing: Klabukova D.L., Davydovskaya M.B. Ocrelizumab therapy and long-term outcomes in multiple sclerosis: clinical and MRI-efficacy and safety profile. Meditsinsky Sovet. 2019; 9: 64-71. DOI: https://doi.org/10.21518/2079-701X-2019-9-64-71.
Conflict of interest: The authors declare no conflict of interest.
ВВЕДЕНИЕ
Рассеянный склероз (РС) является иммуноопосредо-ванным заболеванием центральной нервной системы (ЦНС), которое характеризуется воспалением, демиели-низацией и повреждением аксонов [1]. Данное заболевание может дебютировать с фазы с чередующимися обострениями и ремиссиями, называемой «ремитирующий РС», которая у более 50% пациентов спустя 10-15 лет переходит в фазу с непрерывным прогрессировани-ем инвалидности (отражает прогрессирование заболевания — ПЗ), называемую вторично-прогрессирующей (ВПРС). Их принято объединять единым понятием «рецидивирующий РС» (РРС), или РС с обострениями. В 10-15% случаев заболевание может начинаться и непосредственно с фазы без рецидивов, с постоянным и, как правило, стремительным нарастанием инвалидности, называемой «первичный прогрессирующий РС» (ППРС) [2].
По современным оценкам, в мире около 2,3 млн человек страдают от РС, из них около 200 тыс. — в России [3, 4]. При этом РС является наиболее распространенным воспалительным заболеванием ЦНС, поражающим молодых трудоспособных людей, а его хроническое прогрессирование связано со значительными экономическими нагрузками на пациента, семью, систему здравоохранения и общество. Учитывая затраты, связанные с возникновением обострений и увеличением тяжести заболевания, вмешательства (фармакологические или немедикаментозные), направленные на задержку ПЗ, могут помочь уменьшить бремя болезни [5].
Первым лекарственным препаратом, доказавшим свою эффективность в отношении замедления прогрес-сирования разных форм течения РС, стал Окревус® (МНН окрелизумаб, F. Hoffmann-La Roche Ltd, Швейцария). Окрелизумаб представляет собой рекомбинант-
ное гуманизированное моноклональное антитело — гли-козилированный иммуноглобулин (Ig) G1, которое селективно воздействует на Сй20-положительные B-клетки посредством механизмов комплемент-зависимой цитотоксичности и антитело-зависимой цитотоксич-ности, не оказывая влияния на плазматические и стволовые лимфоидные клетки, в которых CD20 не экспрес-сируется [6, 7]. На основании результатов клинических исследований III фазы препарат был одобрен Управлением по надзору за пищевыми продуктами и лекарствами США (FDA) в марте 2017 г. для применения у пациентов с рецидивирующими формами РС и ППРС [8-10]. В январе 2018 г. окрелизумаб был одобрен Европейским медицинским агентством (EMA) для лечения РС у взрослых пациентов [11]. В РФ препарат был зарегистрирован в октябре 2017 г. для лечения взрослых пациентов с теми же показаниями (дата регистрации -20.10.2017, номер регистрационного удостоверения -ЛП-004503) [6]. Согласно распоряжению Правительства Российской Федерации от 10 декабря 2018 г. № 2738-р препарат включен в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) на 2019 г. [12].
За последние несколько лет после выхода окрелизу-маба на рынки стран Северной Америки, ЕС, России накоплены новые данные открытых расширенных фаз клинических исследований и реальной клинической практики применения препарата у пациентов с РС. По состоянию на декабрь 2018 г. по всему миру уже более 80 тыс. человек прошли курс лечения окрелизумабом, из которых более 78 тыс. — в постмаркетинговом периоде [13]. Рассмотрение и систематизация этих долгосрочных результатов по эффективности и безопасности препарата окрелизумаб (Окревус®) при терапии различных типов течения РС являлись основной целью данной статьи.
ЭФФЕКТИВНОСТЬ В ТЕРАПИИ ПЕРВИЧНО-ПРОГРЕССИРУЮЩЕГО РС
Эффективность и безопасность окрелизумаба при ППРС изучали в ходе двойного слепого плацебо-контро-лируемого рандомизированного клинического исследования ORATORIO. Данное РКИ, в котором участвовало 732 пациента с ППРС, на сегодняшний момент является единственным исследованием III фазы, доказавшим возможность замедлить прогрессирование этой формы течения РС. Исследование состояло из периода скрининга, слепого периода лечения (ДСП, минимум 120 недель лечения и 253 случая ППЗ-12), за которым следовал расширенный контролируемый период (РКП, ~3 дополнительных месяца слепых контролируемых данных и 3 месяца контролируемого наблюдения) и открытый расширенный период (ОРП, ~2 года наблюдения) [8, 14-16]. Пациенты, не вошедшие в ОРП, вступали в 48-недельную фазу наблюдения за безопасностью (которая начиналась с последнего посещения пациента). Критериями включения являлись возраст 18-55 лет, диагноз «ППРС», оценка по расширенной шкале инвалидности (EDSS) 3,0-6,5 балла, оценка функции пирамидной системы по шкале функциональных систем минимум 2 балла; продолжительность симптомов РС < 15 лет у пациентов с EDSS > 5,0 балла или < 10 лет у пациентов с EDSS ^ 5,0 балла; повышение уровня IgG или обнаружение по меньшей мере одной олигоклональной полосы в спинномозговой жидкости.
В ДСП было показано, что в группе пациентов, получавших окрелизумаб в дозе 600 мг каждые 24 недели (n = 488), ПЗ значимо замедлилось по сравнению с группой плацебо (n = 244) [8]. Так, доля пациентов с ПЗ, подтвержденным в течение 12 недель (ППЗ-12, первичная конечная точка), в группе окрелизумаба оказалась равной 32,9%, тогда как в группе плацебо этот показатель был равен 39,3% (отношение шансов 0,76, 95% ДИ 0,59-0,98, p = 0,03). Доли пациентов с ПЗ, подтвержденным в течение 24 недель (ППЗ-24), в группе окрелизумаба и в группе плацебо были равны 29,6 и 35,7% соответственно (отношение шансов 0,75, 95% ДИ 0,58-0,98, р = 0,04). К 120-й неделе время прохождения теста ходьбы на 25 фт (T25FW) ухудшилось на 38,9% в группе окрелизумаба и на 55,1% в группе плацебо (p = 0,04); общий объем очагов поражения головного мозга на Т2-взвешенных МРТ-изображениях уменьшился на 3,4% в группе окрелизума-ба и увеличился на 7,4% в группе плацебо (p < 0,001); процент потери объема головного мозга составил 0,90% в группе окрелизумаба и 1,09% в группе плацебо (p = 0,02). При оценке изменения показателей физического здоровья с помощью сокращенного опросника SF-36 значимых различий между группами не было выявлено.
В РКП по сравнению с ДСП отмечено снижение относительных рисков в группе окрелизумаба в сравнении с плацебо для ППЗ-12 и ППЗ-24 и показателя составного ППЗ-12/24 (определяется как время первого появления либо ППЗ, либо £ 20%-ного увеличения в тесте T25FW или в 9-луночном тесте (9HPT)), в то время как показатели снижения относительного риска для £ 20%-ного ухудше-
ния в тесте T25FW с 12- или 24-недельным подтверждением оставались в целом неизменными и в ДСП, и в РКП [14].
В ОРП вошли 72% (527/732) пациентов, последний — к 240-й неделе [16]. Во время ОРП все участники исследования получали окрелизумаб в дозе 600 мг внутривенно каждые 6 месяцев. Вплоть до 264-й недели было проанализировано время до наступления ППЗ-12 (первичной конечной точки) и ППЗ-24 (увеличение по сравнению с базовым показателем EDSS £ 1 балла, если базовый показатель ^ 5,5, или £ 0,5 балла, если он > 5,5) и время до ППЗ-24 в 9HPT (увеличение £ 20% от базового показателя 9HPT). После 5,5 лет наблюдения показано, что пациенты, начавшие терапию окрелизумабом 3-5 годами ранее, накапливали значительное и устойчивое снижение ПЗ по сравнению с пациентами, получавшими плацебо. На 168-й неделе (через 12 недель после того, как первые пациенты вошли в ОРП) доля пациентов с ППЗ-24 по EDSS в группах, ранее получавших плацебо или окрелизумаб, составила 44,7% против 33,3% (Д = 11,4%; p = 0,005) соответственно. В недели 192 и 264 соответствующие доли составляли 49,3% против 37,8% (Д = 11,5%; р = 0,006) и 57,7% против 48,1% (Д = 9,6%; р = 0,023). На 168-й неделе доля пациентов с ППЗ-24 по 9HPT в группах, ранее получавших плацебо или окрелизумаб, составила 29,7% против 17,9% соответственно (Д = 11,8%; p = 0,001). В недели 192 и 264 соответствующие доли составляли 32,5% против 21,6% (Д = 10,9; p = 0,005) и 39,5% против 26,1% (Д = 13,4%; p = 0,001).
В подгрупповом анализе ORATORIO было продемонстрировано отсутствие различий в эффективности между подгруппами в зависимости от наличия или отсутствия очагов, усиленных гадолинием на изображениях МРТ (Gd+), в начале исследования: по сравнению с плацебо окрелизумаб снижал активность заболевания по различным показателям независимо от исходного Gd+^РТ-паттерна [17].
Кроме того, из недавно проведенной оценки изменений гипоинтенсивных Т1-взвешенных МРТ-изображений медленно прогрессирующих поражений (SEL) следует, что окрелизумаб по сравнению с плацебо ассоциировался с уменьшением повреждения тканей в хронически активных очагах [18]. У пациентов в ORATORIO, получавших окрелизумаб, наблюдались меньшие медианные показатели относительного увеличения Т1-гипоинтенсивного объема и снижения интенсивности ^-сигнала в SEL по сравнению с группой, получавшей плацебо. Это свидетельствует о том, что у пациентов с ППРС лечение окрелизумабом может изменить течение имеющегося повреждения тканей мозга, связанного с хроническим воспалением и/или вторичной нейродегенерацией в очагах поражения.
ЭФФЕКТИВНОСТЬ В ТЕРАПИИ РЕЦИДИВИРУЮЩИХ ФОРМ РС
С участием 1 656 пациентов с РРС (пациенты с ремитирующим течением РС и пациенты с ВПРС с обострениями)
было проведено два крупных исследования III фазы с идентичным дизайном — OPERA I и OPERA II — многоцентровые рандомизированные двойные слепые, контролируемые с помощью двойного плацебо и активного препарата сравнения [9]. Всего 821 (OPERA I) и 835 (OPERA II) пациентов были рандомизированы для получения окре-лизумаба (внутривенно) в дозе 600 мг каждые 24 недели или интерферона р-1а (подкожно) в дозе 44 мкг три раза в неделю в течение 96 недель. Критериями включения являлись возраст 18-55 лет; оценка по EDSS от 0 до 5,5 балла при скрининге; результаты МРТ головного мозга, указывающие на РС; минимум два задокументированных клинических обострения в течение предыдущих 2 лет или одно клиническое обострение в течение года перед скринингом. Пациенты с диагнозом «ППРС»; предшествующей анти-В-клеточной или иммуносупрессивной терапией; продолжительностью заболевания более 10 лет и показателем EDSS ^ 2,0 балла исключались.
В объединенном анализе, который включал 827 пациентов, получавших окрелизумаб, и 829 пациентов, получавших ИФН р-1а, по всем первичным и вторичным конечным точкам отмечено значительное превосходство группы окрелизумаба над группой ИФН р-1а (данные дополнительных приложений и подгруппового анализа; табл. 1) [9, 19]. Так, по первичной конечной точке — средней частоте обострений (СЧО) через 96 недель терапии -наблюдалось значительное снижение (47%; p<0,001) при терапии окрелизумабом в сравнении с терапией ИФН Р-1а, которое сохранялось в большинстве подгрупп, включая исследование, регион, возраст, пол, исходный индекс массы тела (ИМТ), предшествующую терапию другими ПИТРС и предшествующее обострение, базовый уровень EDSS, нормализованный объем мозга и наличие Gd+-Т1-очагов; численная тенденция в пользу окрелизумаба наблюдалась и для отдельных подгрупп пациентов в возрасте более 40 лет [19].
По окончании 96-недельного ДСП пациенты проходили скрининг в ОРП до 4 недель [15]. Пациенты, не вошедшие в ОРП, могли перейти в период последующего наблюдения за безопасностью в течение 48 недель с последнего визита пациента. Пациенты из группы ИФН Р-1а (п = 623) и группы окрелизумаба (п = 702) в ОРП получали окрелизумаб 600 мг в/в каждые 24 недели. В целом 88,6% пациентов, которые вошли в ОРП, завершили в нем третий год [20].
СЧО среди пациентов, получавших ранее ИФН р-1а, снизилась с 0,203 в год до перехода на окрелизумаб до 0,098, 0,082 и 0,072 в годы 1, 2 и 3 после перехода (р<0,001, сравнение года 1 ОРП и последнего года ДСП; р = 0,31, год 1 и год 2; р = 0,56, год 2 и год 3). У пациентов, сразу получавших окрелизумаб, сохранялась низкая СЧО до ОРП и в течение 3 лет ОРП (0,126, 0,105, 0,082 и 0,065).
По показателю ППЗ-24 доля пациентов с наступившим событием была меньше у пациентов, сразу получавших окрелизумаб, по сравнению с теми, кто перешел с ИФН р-1а, на неделе 96 (7,7% против 12,0%; р = 0,005), в конце 1 года ОРП (10,1% против 15,6; р = 0,002), в конце
2 года ОРП (13,8% против 18,1%; р = 0,03) и в конце 3 года ОРП (16,1% против 21,3%; р = 0,014) [20]. В течение
3 лет наблюдения в ОРП в сравнении с результатами ДСП вероятность наступления ППЗ-24 существенно не отличалась у пациентов, которые оставались на терапии окрелизумабом, по сравнению с теми, кто ранее получал ИФН Р-1а (отношение рисков составило 1,06, 95% ДИ 0,8-1,41; р = 0,7).
Пятилетнее наблюдение за пациентами также показало, что к 3-му году ОРП преимущества, наблюдаемые в отношении общей потери объема мозга, серого вещества и белого вещества, сохранялись у тех, кто начал терапию с окрелизумабом и продолжал в течение ОРП [21]. Среди пациентов, получавших ИФН р-1а в ДСП, скорректированное по исследованию количество
• Таблица 1. Объединенные результаты по клиническим конечным точкам и показателям МРТ в течение 96-недельных исследований OPERA I и OPERA II
• Table 1. Pooled results on clinical endpoints and MRI findings during 96-week studies OPERA I and OPERA II
Показатель клинической или МРТ-эффективности Результат в группе ИФН Р-1а (n = 829) Результат в группе окрелизумаба (n = 827) Соотношение показателей (95% ДИ; p-значение)
Скорректированная СЧО (число обострений) 0,29 (334) 0,16 (194) 0,54 (95°% ДИ: 0,44-0,66; p<0,001) в пользу окрелизумаба
ППЗ-12 (число событий) 13,6 (113) 9,1 (75) 0,60 (95% ДИ: 0,45-0,81; p<0,001) в пользу окрелизумаба
Количество СС+-очагов на Т1-ВИ МРТ (число МРТ) 802 (2081) 42 (2235) 0,06 (95% ДИ: 0,04-0,08; p<0,001) в пользу окрелизумаба
Количество новых или увеличившихся гиперинтенсивных очагов на Т2-ВИ МРТ (число МРТ) 4019 (2091) 810 (2246) 0,20 (95% ДИ: 0,16-0,24; p<0,001) в пользу окрелизумаба
Изменение от исходного объема мозга,% (число пациентов в группе ) -1,29 (707) -0,99 (827) 0,31 (95% ДИ: 0,20-0,42; p<0,001) в пользу ИФН р-1а
Пациенты со статусом NEDA — отсутствием признаков активности заболевания, число и доля (число пациентов в группе) 206 (27,1%) (759) 363 (47,7%) (761) 1,75 (95% ДИ: 1,53-2,01; p<0,001) в пользу ИФН р-1а
T1-Gd+-04ar0B составило 0,476 очага / сканирование на неделе 96 и снизилось до нескорректированного уровня 0,007, 0,004 и 0,004 на неделе 144 (год 3 / 1-й год терапии Окревусом®), неделе 192 (год 4 / 2-й год терапии Окревуса®) и неделе 240 (год 5 / 3-й год терапии Окревусом®) соответственно. Аналогично количество новых или увеличение гиперинтенсивных очагов T2 уменьшилось со скорректированного показателя 2,159 поражений / сканирование на неделе 96 с предварительным переключением до 0,333 в год 3 (1-й год терапии Окревусом®) и далее уменьшилось до нескорректированных показателей 0,063 и 0,038 в годы 4 и 5 (2-й и 3-й годы терапии Окревусом®). У пациентов, ранее получавших окрелизумаб, сохранялось низкое количество T1-Gd+ и гиперинтенсивных Т2-очагов в 3, 4 и 5-й годы терапии окрелизумабом.
Таким образом, пациенты с РРС, которые начали терапию окрелизумабом на 2 года раньше, накопили значительное и устойчивое снижение ПЗ, а также имели
• Таблица 2. Профиль безопасности окрелизумаба (по состоянию на февраль 2018 г.)
• Table 2. Ocrelizumab Safety Profile (as of February 2018)
Нежелательные явления Частота на 100 пациенто-лет и 95% ДИ
Любые НЯ 242 (239-245)
НЯ, повлекшие прекращение лечения 1,06 (0,88-1,27)
Инфекции и инвазии, в т. ч. • инфекция мочевыводящих путей • назофарингит • инфекция верхних дыхательных путей • бронхит • грипп 74,5 (72,9-76,1) 12.6 (12-13,3) 12.7 (12-13,4) 9,8 (9,2-10,4) 3 ,1 (2,8-3,5) 3,4 (3-3,7)
Травмы, отравления и процедурные осложнения, в т. ч. • инфузионные реакции 37 (35,9-38,2) 26,5 (25,6-27,5)
Заболевания нервной системы, в т. ч. • головная боль 24 (23,1-25) 7 (6,5-7,6)
Нарушения костно-мышечной и соединительной ткани, в т. ч. • боль в спине • артралгия • боль в конечности 20,4 (19,6-21,3) 3,6 (3,3-4) 2,9 (2,6-3,2) 2,5 (2,2-2,8)
Общие расстройства и состояния в месте введения, в т. ч. • утомляемость 13 (12,3-13,7) 3,8 (3,5-4,2)
Психиатрические расстройства, в т. ч. • депрессия 8.5 (7,9-9) 2.6 (2,3-3)
Новообразования 0,45 (0,33-0,6)
Серьезные НЯ, в т. ч. • серьезные инфекции • число подтвержденных оппортунистических инфекций (кожные инфекции вируса Herpes zoster не включены) 7,23 (6,73-7,75) 2 (1,74-2,28) 2
Летальный исход 0,16 (0,09-0,25)
устойчивое подавление активности болезни по MPT-показателям от исходного уровня общего объема мозга, белого вещества и серого вещества коры головного мозга со 2-й по 5-й год терапии по сравнению с пациентами, перешедшими с терапии ИФН ß-^.
Оценка взаимосвязи потери объема головного мозга и комплексного показателя NEDA, который характеризует отсутствие как клинической активности, так и активности MPT, была проведена и описана TrabouLsee A. с соавт. по результатам 96-недельного ДСП исследований OPERA I и II [22]. В анализ были включены 1520 пациентов (окрелизумаб, n = 761; ИФН ß-1a, n = 759), из которых 569 (37%) пациентов имели статус NEDA. По сравнению с пациентами с признаками активности заболевания (EDA), у них отмечена значительно меньшая общая потеря объема мозга по сравнению с исходным уровнем (снижение на 30%; p<0,001). В группе NEDA у пациентов, получавших окрелизумаб, наблюдалась значительно меньшая общая потеря объема мозга (снижение на 32%; p<0,001), потеря объема белого (снижение на 34%; p = 0,044) и серого вещества (снижение на 30%; p<0,001) от базовых значений, чем у пациентов, получавших ИФН ß-1a. В группе EDA у пациентов, получавших окрелизумаб, наблюдалась значительно меньшая потеря общего объема мозга (снижение на 11%; p = 0,047) и потеря объема серого вещества мозга (снижение на 21%; p<0,001), но не белого вещества (увеличение на 1,03%; p = 0,90) от базовой линии, чем у пациентов, получавших ИФН ß-1a. Эти результаты подчеркивают, что применение окрелизумаба может дать дополнительные преимущества пациентам в достижении статуса NEDA как цели лечения с точки зрения сохранения ткани мозга.
ПРОФИЛЬ БЕЗОПАСНОСТИ
К февралю 2018 г. терапию окрелизумабом прошли 3811 пациентов с PQ получивших £1 дозы этого препарата в течение контролируемых или открытых периодов II фазы (пациенты с PPQ и III фазы (OPERA I и OPERA II и ORATORIO), а также исследований VELOCE, CHORDS, CASTING и OBOE, что составило 10919 пациенто-лет воздействия. Среднее число полученных доз составило 6,5 (стандартное отклонение 4,2), а медианное — 5. Общая кумулятивная доза составила, мг: 3822 (стандартное отклонение 2470), а медианная — 2400 при общем диапазоне 9-11800. Pезультаты объединенного анализа безопасности для этой расширенной популяции пациентов по состоянию на февраль 2018 г. были представлены Hauser S. и соавт. (табл. 2) [23].
Наиболее распространенными НЯ были инфузионные реакции ^P), инфекции мочевыводящих путей и инфекции верхних дыхательных путей. Серьезные НЯ произошли с частотой 7,23 (95% ДИ: 6,73-7,75) на 100 пациенто-лет. Частота отмены терапии из-за НЯ составила 1,06 на 100 пациенто-лет (ДИ 95%: 0,88-1,27).
Общая частота возникновения инфекций и частота серьезных инфекций соответствует показателям первичных анализов отдельных исследований (II фаза — январь
2015 г.; OPERA I — апрель 2015 г.; OPERA II — май 2015 г.; ORATORIO — июль 2015 г.). Не отмечено изменений в типе или характере серьезных инфекций с течением времени: наиболее распространенными серьезными инфекциями были инфекции мочеполовых путей и пневмония. В объединенной популяции пациентов с РРС частота серьезных инфекций на 100 пациенто-лет увеличивалась до 3-го года без дальнейшего устойчивого увеличения, а среди пациентов с ППРС — увеличивалась с 3-го до 5-го года.
Поскольку при одновременном истощении В- и Т-клеток существует вероятность увеличения риска серьезной инфекции, дополнительно по результатам контрольных периодов исследований окрелизумаба III фазы была проведена оценка корреляции изменений уровней Т-клеток, экспрессиру-ющих CD3, CD4 и CD8, и возникновения серьезных инфекций [24]. Окрелизумаб оказывал меньшее влияние на популяции Т-клеток как в целом,так и в отношении падения ниже нижнего уровня нормы (<НУН) по сравнению с ИФН ß-^ у пациентов с РРС в исследованиях OPERA, но несколько сильнее, чем плацебо, у больных ППРС в ORATORIO. В течение периодов подтвержденного снижения CD8+ <НУН показатели частоты серьезных инфекций (95% ДИ) для групп окрелизумаба и ИФН ß-^ составили 3,44 (1,12-8,02) против 1,29 (0,27-3,76), а для окрелизумаба и плацебо — 5,08 (2,84-8,37) против 3,66 (0,75-10,69). Частота событий во время периодов CD3+ и CD4+ <НУН была слишком низкой, чтобы сделать значимый вывод. Поэтому предполагается, что периоды снижения популяций Т-клеток <НУН не считаются отдельным фактором риска для безопасности терапии окрелизумабом, однако анализ данных за 5 лет применения препарата на данный момент не представлен.
После периодов контролируемого наблюдения (в открытых и постмаркетинговых фазах) было зарегистрировано несколько случаев серьезных оппортунистических инфекций, связанных с вирусом герпеса, а также не имевших паттерна по типуинфекции.Сообщается, что пациенты выздоравливали с помощью стандартной терапии, однако не все случаи постмаркетингового периода достоверно документированы.
По состоянию на февраль 2019 г. не было зарегистрировано ни одного смертельного случая в результате серьезных оппортунистических инфекций и ни одного случая прогрессирующей мультифокальной лейкоэнце-фалопатии (ПМЛ), связанной с терапией окрелизумабом. Всего сообщается о семи подтвержденных случаях перенесенной ПМЛ, обошедшихся без смертельных исходов и связанных с предыдущим лечением другими ПИТРС: натализумабом (шесть случаев) или финголимодом (один случай) [25].
Для снижения риска возникновения реакций на введение препарата во всех периодах исследований окре-лизумаба всем пациентам предварительно вводили метилпреднизолон, а также рекомендовали применение
Какой препарат доказал эффективность
в терапии ППРС?*
дин
только
ОКРЕВУС
ОКРЕВУС
первый и единственный
препарат, доказавший ЭФФЕКТИВНОСТЬ ПРИ ППРС
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
В плацебо-контролируемом исследовании ORATORIO ОКРЕВУС* при ППРС продемонстрировал:1’2
42,7%
ПАЦИЕНТОВ ДОСТИГЛИ NEP»
24% СНИЖЕНИЕ ОТНОСИТЕЛЬНОГО РИСКА ПРОГРЕССИРОВАНИЯ ИНВАЛИДИЗАЦИИ
29% ЗАМЕДЛЕНИЕ УХУДШЕНИЯ СПОСОБНОСТИ К ХОДЬБЕ
17,5%
ЗАМЕДЛЕНИЕ ПОТЕРИ ОБЪЕМА ГОЛОВНОГО МОЗГА
®
БЛАГОПРИЯТНЫМ
ПРОФИЛЬ ПЕРЕНОСИМОСТИ
® УДОБНЫЙ
РЕЖИМ
ВВЕДЕНИЯ»
им форма; концентрат для приготовления раствора для инфузий, 30 мг/мл. Ф
нальное антитело, селективно воздействующее на В-клетки, экспрессирующие Сй20. Показания: для лечения взрослых пациентов с | ного склероза или с первично-прогрессирующим рассеянным склерозом, Противопоказания: гиперчувствительность к окрелизумабу в анамнезе, активный гепатит В, беременность, период грудного вскармливания, детский возраст до 18 лет, жизнеугрожающие иг п репа рата Окреаус* в в нам незе. Способ применения и дозы: Рекомендуемая доза п репэрэта Окревус® составляет 600 мг каждые 61
5у следует в ‘ ‘ » ~~~
■и инфузий I
действ*40
слизистой оболочки 1
дозу следует вводить в виде двух отдельны* в/в инфузий: с первой инфузией вводят 300 мг препарата, затем через 2 недели вводят еще 300 м |репарата Окревус* вводятся з виде однократной в/в инфузии в дозе 600 мг каждые 6 месяцев. Первую из последующих доз следует прс J » » » » «дозы. Минимальный интервал между каждым введением препарата Окревус* должен составлять S месяцев. Препар ьный катетер. Вводить препарат струйно или балюсно нельзя, Перед каждым введем {21/10} — инфекции верхних дыхательных путей, назофарингит, грипп, инфузионные . . . рта, инфекции дыхательных путей, вирусная инфекция, опоясывагащии лишай {Herpes zoster),
————-«—————————— ——-тературе 2-8″С в картонной пач————-
———— препарат» ОКРЕВУС*.
Нет необходи моста рутин ного мониторинга уровня лимфоцитов, Ht 1. Инструкция по меди ци некому п рименвн ию препарата ОКРЕВУС®, Л N Engl J Med. 2017;376(3):209-220.
для защиты от света. Хранит
EDSS,отсутствие прегрессирования 3.2. Montai ban X et al. Ocrelizumab versus placebo in primary progressive multiple sderosis.
ОКРЕВУС
окрелизумаб
О
ЗАО «Рош-Москва» Официальный дистрибьютор «Ф.Хоффманн-Ля Рош Лтд.» (Швейцария) Россия, 107031 г. Москва, Трубная площадь, дом 2 МФК «Галерея Неглинная» Тел.: +7(495)229-29-99 Факс: +7(495)229-79-99 www.roche.ru
анальгетиков, жаропонижающих и антигистаминных препаратов. В анализе результатов исследований III фазы показано, что наиболее легкоуправляемыми (включая инфузионные корректировки) и менее частыми ИР были премедикации с метилпреднизолоном и антигистамин-ными препаратами перед каждой инфузией по сравнению с другими вариантами премедикации. Никакого эффекта подгруппы (например, по полу или возрасту) на частоту НЯ не наблюдалось [26]. Однако в ретроспективном анализе данных 207 пациентов с РРС из группы окрелизумаба исследований OPERA продемонстрировано, что общая частота ИР у пациентов, получавших стандартный протокол премедикации, составила 21,6%, а у получавших модифицированную схему премедикации -10% [27]. Также у пациентов, получавших измененную схему, отмечено снижение вероятности ИР на 60% (отношение шансов 0,4 (95% ДИ: 0,18, 0,88); p = 0,024). Стандартную схему премедикации (дифенгидрамин 50 мг в/в, метилпреднизолон 125 мг в/в и ацетаминофен 650 мг перорально) все пациенты получали непосредственно перед инфузией, а модифицированный протокол включал инструкции по приему 10 мг цетиризина, 75 мг рани-тидина и поддержанию адекватной гидратации ночью и утром до инфузии (стандартная премедикация: n = 97; измененная схема: n = 110). Кроме того, обнаружено, что возраст и мужской пол уменьшали шансы (0,94; p = 0,001 и 0,34; р = 0,034 соответственно), а ИМТ увеличивал шансы ИР (1,07; р = 0,029). Раса и статус курения не имели статистической значимости.
Отдельный анализ случаев ИР у пациентов, которые перешли в ОРП исследований OPERA и получили до двух доз препарата, показал, что частота ИР в ОРП была самой высокой при первом введении окрелизумаба и снижалась при второй инфузии, что согласуется с контролируемыми исследованиями [28]. 19,3 и 3,9% пациентов, ранее получавших ИФН ß-^, сообщили об ИР после первой и второй инфузии первого двойного цикла. Это значение меньше, чем доля пациентов, которые сообщили об ИР после первой дозы окрелизумаба в ДСП (27,5 и 4,7%). Среди пациентов, непрерывно получавших Окревус®, 9,4 и 2,3% сообщили об ИР после первого и второго введения в ОРП против 7,8% после последней дозы в ДСП. Большинство ИР при введении первой дозы в ОРП были от легкой до умеренной степени тяжести, наиболее рас-
пространенными симптомами значились зуд, сыпь, приливы, раздражение горла и головная боль. Не было пациентов, которые отказались от лечения из-за ИР после введения первой дозы окрелизумаба в ОРП.
В открытом лонгитюдном когортном исследовании с участием 281 пациента с РС, получивших £ 1 инфузии Окревуса®, отмечено 39 (6%) ИР, наблюдаемых после 651 инфузии, и один случай отказа от терапии из-за ИР [29]. Все реакции были легкой и средней степени тяжести, симптомы включали зуд в горле, ушах и коже головы. Отмечено также 3 слабые астматические реакции во время первого введения; все случаи отвечали на 0,3 мг адреналина внутривенно, и при последующих инфузиях астматических реакций не было.
Общие и стандартизированные показатели заболеваемости злокачественными новообразованиями и раком молочной железы у женщин в продолжение 5 лет исследований оставались стабильными или колебались в пределах диапазона эпидемиологических показателей для пациентов с РС [23].
ЗАКЛЮЧЕНИЕ
В статье представлены долгосрочные результаты клинических исследований и реальной клинической практики, описывающие эффективность и безопасность применения окрелизумаба (Окревус®) у взрослых пациентов с РС.
Продемонстрирована долгосрочная эффективность препарата. Значительное и клинически значимое преимущество в снижении ПЗ при терапии окрелизумабом у пациентов с ППРС, показанное в исследовании ORATORIO, продолжает накапливаться и является устойчивым при продолжающемся лечении. У пациентов с РРС после 5 лет наблюдения отмечено, что при более раннем начале лечения окрелизумабом доля больных с ПЗ и степень атрофии головного мозга значительно ниже по сравнению с пациентами с отсроченным началом лечения окре-лизумабом.
Полученные за 5 лет данные свидетельствуют о том, что профиль безопасности препарата соответствует полученному в контролируемых периодах клинических исследований. ф
Поступила/Received 25.03.2019
ЛИТЕРАТУРА/REFERENCES
Dargahi N., Katsara M., Tselios T., Androutsou M.E., de Courten M., Matsoukas J., Apostolopoulos V. Multiple sclerosis: immuno-pathology and treatment update. Brain Sci. 2017;7(7):78.
Lublin F.D., Reingold S.C., Cohen J.A., Cutter G.R., Sorensen P.S., Thompson AJ., et al. Defining the clinical course of multiple sclerosis. Neurology. 2014;83:278-286. Atlas of MS 2013: Mapping Multiple Sclerosis Around the World. London [Электронный ресурс]: Multiple Sclerosis International
Federation; 2013. URL: https://www.msif.org/ wp-content/uploads/2014/09/Atlas-of-MS.pdf. Дата доступа: 25.02.2019.
4. Бойко А.Н., Смирнова Н.Ф., Золотова С.Н., Гусев Е.И. Эпидемиология и этиология рассеянного склероза. Consilium Medicum. 2008;10(7):5-8. [Boyko A.N., Smirnova N.F., Zolotova S.N., Gusev E.I. Epidemiology and etiology of multiple sclerosis. Consilium Medicum. 2008;10(7):5-8.] (In Russ).
5. Naci H., Fleurence R., Birt J., Duhig A. Economic burden of multiple sclerosis: a systematic
review of the literature. Pharmacoeconomics. 2010;28(5):363-79.
6. Государственный реестр лекарственных
средств [Электронный ресурс]: Инструкция по медицинскому применению лекарственного препарата окрелизумаб (Окревус®). URL: https://grls.rosminzdrav.ru/Grls_View_v2. aspx?routingGuid = 1e285065-d8dd-4438-b4f8-6358eced347c&t. Дата доступа: 25.02.2019. [State Register of Drugs [Electronic resource]: Patient Information Leaflet for Ocrelizumab (Ocrevus®). URL: https://grls.ros-
minzdrav.ru/Grls_View_v2.aspx?routingGuid = 1e285065-d8dd-4438-b4f8-6358eed347c & t. Accessed date: 02/25/2019.] (In Russ).
7. Gasperi C., Stuve O., Hemmer B. B cell-directed therapies in multiple sclerosis. Neurodegener Dis Manag. 2016;6(1):37-47.
8. Montalban X., Hauser S.L, Kappos L., Arnold D.L., Bar-Or A., Comi G., et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. N Engl J Med. 2017;376(3):209-220.
9. Hauser S.L., Bar-Or A., Comi G., Giovannoni G., Hartung H.P., Hemmer B., et al. Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis. N Engl J Med. 2017 Jan 19;376(3):221-234.
10. FDA [Электронный ресурс]: Highlights of prescribing information OCREVUS™ (ocrelizumab), 2017. URL: https://www.accessdata.fda.gov/ drugsatfda_docs/label/2017/761053lbl.pdf. Дата доступа: 25.02.2019.
11. EMA [Электронный ресурс]: Assessment report. Ocrevus, 2018. URL: https//www.ema.europa. eu/en/documents/product-information/ocre-vus-epar-product-information_en.pdf. Дата доступа: 25.02.2019.
12. Распоряжение Правительства РФ от 10.12.2018 №2738-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2019 год. а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». [Order of the Government of the Russian Federation No. 2738-p «On approval of list of vital and essential drugs, as well as lists of drugs for medical use and the minimum range of drugs required for medical care in 2019» of December 10, 2018] (In Russ).
13. Roche data on file (ph35s6nd5b2454r5lmkpvk-8gho).
14. Wolinsky J., Montalban X., Hauser S., et al. Sustained and durable reduction in confirmed disability progression in patients with primary progressive multiple sclerosis receiving ocreli-zumab: Findings from the phase III ORATORIO study extended control period. 7th Joint
ECTRIMS and ACTRIMS Meeting, Paris, France; October 25-28, 2017. ECTRIMS/ACTRIMS Poster #P1234.
15. Kuhelj R., Deol-Bhullar G., Garas M., et al. Open-label Phase III extension studies to evaluate the long-term safety and efficacy of ocrelizumab in Relapsing MS and Primary Progressive MS. 2nd Congress of the EAN, Copenhagen, Denmark; May 28-31, 2016. EAN Poster #P11192.
16. Wolinsky J., Brochet B., Montalban X., et al. Sustained reduction in confirmed disability progression in patients with primary progressive multiple sclerosis treated with ocrelizumab in the open-label extension period of the Phase III ORATORIO trial. 34th Congress of the ECTRIMS, Berlin, Germany; October 10-12, 2018. ECTRIMS Poster.
17. Wolinsky J., Arnold D.L., Bar-Or A. Efficacy of ocrelizumab in patients with PPMS with and without T1 gadolinium-enhancing lesions at baseline in a Phase III, placebo-controlled trial. ACTRIMS, New Orleans, Louisiana; February 18-20, 2016. ACTRIMS Poster #LB148.
18. Elliott C., Wolinsky J., Hauser S., et al. Ocrelizumab may reduce tissue damage in chronic active lesions as measured by change in T1 hypointensity of slowly evolving lesions in patients with primary progressive multiple sclerosis. AAN Annual Meeting, Los Angeles, CA; April 21-27, 2018. AAN Poster #376.
19. Turner B., Cree B.A.C., Kappos L., Montalban X., Papeix C., Wolinsky J.S., et al. Ocrelizumab efficacy in subgroups of patients with relapsing multiple sclerosis. J Neurol. 2019 Feb 28. doi: 10.1007/s00415-019-09248-6. [Epub ahead of print].
20. Hauser S., Brochet B., Montalban X., et al. Long-Term reduction of relapse rate and confirmed disability progression after 5 years of ocrelizumab treatment in patients with relapsing multiple sclerosis. 34th Congress of the ECTRIMS, Berlin, Germany; October 10-12, 2018. ECTRIMS Poster.
21. Arnold D., Kappos L., Hauser S., et al. Long-Term reduction in brain MRI disease activity and atrophy after 5 years of ocrelizumab treatment
in patients with relapsing multiple sclerosis. 34th Congress of the ECTRIMS, Berlin, Germany; October 10-12, 2018. ECTRIMS Poster.
22. Traboulsee A., Arnold D., Klawiter E., et al. Association of Brain Volume Loss and NEDA Outcomes in Patients With Relapsing Multiple Sclerosis in the OPERA I and OPERA II Studies. 7th Joint ECTRIMS/ACTRIMS Meeting, Paris, France; October 25-28, 2017. ECTRIMS/ ACTRIMS Poster #P774.
23. Hauser S., Kappos L., Montalban X., et al. Safety of ocrelizumab in multiple sclerosis: updated analysis in patients with relapsing and primary progressive multiple sclerosis. 34th Congress of the ECTRIMS, Berlin, Germany; October 10-12, 2018. ECTRIMS Poster.
24. Vermersch P., Harp C., Herman A., et al. T-Cell Population Changes and Serious Infection Rates in the Controlled Periods of the Pivotal Phase III Trials of Ocrelizumab in Multiple Sclerosis. 7th Joint ECTRIMS/ACTRIMS Meeting, Paris, France; October 25-28, 2017. Poster #P668.
25. Roche data on file (a8u9eabn8dkk545jmeoqn-9bsek).
26. de Seze J., Hauser S., Kappos L., et al. Infusion-Related Reactions With Ocrelizumab in the Phase III Studies. 7th Joint ECTRIMS/ACTRIMS Meeting, Paris, France; October 25-28, 2017. ECTRIMS/ACTRIMS Poster #EP1671.
27. Conte W.L., Arndt N., Cipriani V.P., Dellaria A., Javed A. Reduction in ocrelizumab-induced infusion reactions by a modified premedication protocol. Mult Scler Relat Disord. 2019;27:397-399.
28. Mayer L., Kappos L., Racke M., et al. Infusion-related reactions with ocrelizumab: pooled analysis of the open-label extension of the Phase III, Interferon beta-1a-controlled OPERA studies. Annual Meeting CMSC, New Orleans, LA; May 24-27, 2017. CMSC Poster #DX44.
29. Belcher S., Edwards K., Williams T., et al. Reduction of infusion related reactions during ocrelizumab infusions in a comprehensive multiple sclerosis Care Center. 34th Congress of the ECTRIMS, Berlin, Germany; October 10-12, 2018. ECTRIMS Abstract #P1257.