Macrodantin Description
Macrodantin® (Nitrofurantoin Capsules, USP) (macrocrystals) is a synthetic chemical of controlled crystal size. It is a stable, yellow, crystalline compound. Macrodantin is an antibacterial agent for specific urinary tract infections. It is available in 25 mg, 50 mg, and 100 mg capsules for oral administration. Each capsule contains 25 mg, 50 mg, or 100 mg of nitrofurantoin macrocrystals.
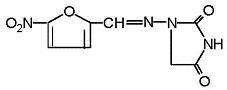
1-[[(5-nitro-2-furanyl)methylene]amino]-2, 4-imidazolidinedione
Inactive Ingredients: Each capsule contains edible black ink, gelatin, lactose, starch, talc, titanium dioxide, and may contain FD&C Yellow No. 6 and D&C Yellow No. 10.
Macrodantin — Clinical Pharmacology
Macrodantin is a larger crystal form of Furadantin® (nitrofurantoin). The absorption of Macrodantin is slower and its excretion somewhat less when compared to Furadantin. Blood concentrations at therapeutic dosage are usually low. It is highly soluble in urine, to which it may impart a brown color.
Following a dose regimen of 100 mg q.i.d. for 7 days, average urinary drug recoveries (0 to 24 hours) on day 1 and day 7 were 37.9% and 35.0%.
Unlike many drugs, the presence of food or agents delaying gastric emptying can increase the bioavailability of Macrodantin, presumably by allowing better dissolution in gastric juices.
MICROBIOLOGY
Nitrofurantoin is a nitrofuran antimicrobial agent with activity against certain Gram-positive and Gram-negative bacteria.
Mechanism of Action
The mechanism of the antimicrobial action of nitrofurantoin is unusual among antibacterials.
Nitrofurantoin is reduced by bacterial flavoproteins to reactive intermediates which inactivate or alter bacterial ribosomal proteins and other acromolecules. As a result of such inactivations, the vital biochemical processes of protein synthesis, aerobic energy metabolism, DNA synthesis, RNA synthesis, and cell wall synthesis are inhibited. Nitrofurantoin is bactericidal in urine at therapeutic doses. The broad-based nature of this mode of action may explain the lack of acquired bacterial resistance to nitrofurantoin, as the necessary multiple and simultaneous mutations of the target macromolecules would likely be lethal to the bacteria.
Interactions with Other Antibiotics
Antagonism has been demonstrated in vitro between nitrofurantoin and quinolone antimicrobials. The clinical significance of this finding is unknown.
Development of Resistance
Development of resistance to nitrofurantoin has not been a significant problem since its introduction in 1953. Cross-resistance with antibiotics and sulfonamides has not been observed, and transferable resistance is, at most, a very rare phenomenon.
Nitrofurantoin has been shown to be active against most strains of the following bacteria both in vitro and in clinical infections (see INDICATIONS AND USAGE):
Aerobic and facultative Gram-positive microorganisms:
Staphylococcus aureus
Enterococci (e.g. Enterococcus faecalis)
Aerobic and facultative Gram-negative microorganisms:
Escherichia coli
NOTE: While nitrofurantoin has excellent activity against Enterococcus faecalis, the majority of Enterococcus faecium isolates are not susceptible to nitrofurantoin.
At least 90 percent of the following microorganisms exhibit an in vitro minimum inhibitory concentration (MIC) less than or equal to the susceptible breakpoint for nitrofurantoin. However, the efficacy of nitrofurantoin in treating clinical infections due to these
microorganisms has not been established in adequate and well-controlled trials.
Aerobic and facultative Gram-positive microorganisms:
Coagulase-negative staphylococci (including Staphylococcus epidermidis and Staphylococcus saprophyticus)
Streptococcus agalactiae
Group D streptococci
Viridans group streptococci
Aerobic and facultative Gram-negative microorganisms:
Citrobacter amalonaticus
Citrobacter diversus
Citrobacter freundii
Klebsiella oxytoca
Klebsiella ozaenae
NOTE: Some strains of Enterobacter species and Klebsiella species are resistant to nitrofurantoin.
Susceptibility Testing:
For specific information regarding susceptibility test interpretive criteria and associated test methods and quality control standards recognized by FDA for this drug, please see: https://www.fda.gov/STIC.
Indications and Usage for Macrodantin
Macrodantin is specifically indicated for the treatment of urinary tract infections when due to susceptible strains of Escherichia coli, enterococci, Staphylococcus aureus, and certain susceptible strains of Klebsiella and Enterobacter species.
Nitrofurantoin is not indicated for the treatment of pyelonephritis or perinephric abscesses.
To reduce the development of drug-resistant bacteria and maintain the effectiveness of Macrodantin and other antibacterial drugs, Macrodantin should be used only to treat or prevent infections that are proven or strongly suspected to be caused by susceptible bacteria. When culture and susceptibility information are available, they should be considered in selecting or modifying antibacterial therapy. In the absence of such data, local epidemiology and susceptibility patterns may contribute to the empiric selection of therapy.
Nitrofurantoins lack the broader tissue distribution of other therapeutic agents approved for urinary tract infections. Consequently, many patients who are treated with Macrodantin are predisposed to persistence or reappearance of bacteriuria. Urine specimens for culture and susceptibility testing should be obtained before and after completion of therapy. If persistence or reappearance of bacteriuria occurs after treatment with Macrodantin, other therapeutic agents with broader tissue distribution should be selected. In considering the use of Macrodantin, lower eradication rates should be balanced against the increased potential for systemic toxicity and for the development of antimicrobial resistance when agents with broader tissue distribution are utilized.
Contraindications
Anuria, oliguria, or significant impairment of renal function (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine) are contraindications. Treatment of this type of patient carries an increased risk of toxicity because of impaired excretion of the drug.
Because of the possibility of hemolytic anemia due to immature erythrocyte enzyme systems (glutathione instability), the drug is contraindicated in pregnant patients at term (38 to 42 weeks’ gestation), during labor and delivery, or when the onset of labor is imminent. For the same reason, the drug is contraindicated in neonates under one month of age.
Macrodantin is contraindicated in patients with a previous history of cholestatic jaundice/hepatic dysfunction associated with nitrofurantoin.
Macrodantin is also contraindicated in those patients with known hypersensitivity to nitrofurantoin.
Warnings
Pulmonary reactions:
ACUTE, SUBACUTE, OR CHRONIC PULMONARY REACTIONS HAVE BEEN OBSERVED IN PATIENTS TREATED WITH NITROFURANTOIN. IF THESE REACTIONS OCCUR, MACRODANTIN SHOULD BE DISCONTINUED AND APPROPRIATE MEASURES TAKEN. REPORTS HAVE CITED PULMONARY REACTIONS AS A CONTRIBUTING CAUSE OF DEATH.
CHRONIC PULMONARY REACTIONS (DIFFUSE INTERSTITIAL PNEUMONITIS OR PULMONARY FIBROSIS, OR BOTH) CAN DEVELOP INSIDIOUSLY. THESE REACTIONS OCCUR RARELY AND GENERALLY IN PATIENTS RECEIVING THERAPY FOR SIX MONTHS OR LONGER. CLOSE MONITORING OF THE PULMONARY CONDITION OF PATIENTS RECEIVING LONG-TERM THERAPY IS WARRANTED AND REQUIRES THAT THE BENEFITS OF THERAPY BE WEIGHED AGAINST POTENTIAL RISKS (SEE RESPIRATORY REACTIONS).
Hepatotoxicity:
Hepatic reactions, including hepatitis, cholestatic jaundice, chronic active hepatitis, and hepatic necrosis, occur rarely. Fatalities have been reported. The onset of chronic active hepatitis may be insidious, and patients should be monitored periodically for changes in biochemical tests that would indicate liver injury. If hepatitis occurs, the drug should be withdrawn immediately and appropriate measures should be taken.
Neuropathy:
Peripheral neuropathy, which may become severe or irreversible, has occurred. Fatalities have been reported. Conditions such as renal impairment (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine), anemia, diabetes mellitus, electrolyte imbalance, vitamin B deficiency, and debilitating disease may enhance the occurrence of peripheral neuropathy. Patients receiving long-term therapy should be monitored periodically for changes in renal function.
Optic neuritis has been reported rarely in postmarketing experience with nitrofurantoin formulations.
Hemolytic anemia:
Cases of hemolytic anemia of the primaquine-sensitivity type have been induced by nitrofurantoin. Hemolysis appears to be linked to a glucose-6-phosphate dehydrogenase deficiency in the red blood cells of the affected patients. This deficiency is found in 10 percent of Blacks and a small percentage of ethnic groups of Mediterranean and Near-Eastern origin. Hemolysis is an indication for discontinuing Macrodantin; hemolysis ceases when the drug is withdrawn.
Clostridium difficile-associated diarrhea:
Clostridium difficile associated diarrhea (CDAD) has been reported with use of nearly all antibacterial agents, including nitrofurantoin, and may range in severity from mild diarrhea to fatal colitis. Treatment with antibacterial agents alters the normal flora of the colon leading to overgrowth of C. difficile.
C. difficile produces toxins A and B which contribute to the development of CDAD. Hypertoxin producing strains of C. difficile cause increased morbidity and mortality, as these infections can be refractory to antimicrobial therapy and may require colectomy. CDAD must be considered in all patients who present with diarrhea following antibiotic use. Careful medical history is necessary since CDAD has been reported to occur over two months after the administration of antibacterial agents.
If CDAD is suspected or confirmed, ongoing antibiotic use not directed against C. difficile may need to be discontinued. Appropriate fluid and electrolyte management, protein supplementation, antibiotic treatment of C. difficile, and surgical evaluation should be instituted as clinically indicated.
Precautions
Information for Patients
Patients should be advised to take Macrodantin with food to further enhance tolerance and improve drug absorption. Patients should be instructed to complete the full course of therapy; however, they should be advised to contact their physician if any unusual symptoms occur during therapy.
Many patients who cannot tolerate microcrystalline nitrofurantoin are able to take Macrodantin without nausea.
Patients should be advised not to use antacid preparations containing magnesium trisilicate while taking Macrodantin.
Patients should be counseled that antibacterial drugs including Macrodantin should only be used to treat bacterial infections. They do not treat viral infections (e.g., the common cold). When Macrodantin is prescribed to treat a bacterial infection, patients should be told that although it is common to feel better early in the course of therapy, the medication should be taken exactly as directed. Skipping doses or not completing the full course of therapy may (1) decrease the effectiveness of the immediate treatment and (2) increase the likelihood that bacteria will develop resistance and will not be treatable by Macrodantin or other antibacterial drugs in the future.
Diarrhea is a common problem caused by antibiotics which usually ends when the antibiotic is discontinued. Sometimes after starting treatment with antibiotics, patients can develop watery and bloody stools (with or without stomach cramps and fever) even as late as two or more months after having taken the last dose of the antibiotic. If this occurs, patients should contact their physician as soon as possible.
General: Prescribing Macrodantin in the absence of a proven or strongly suspected bacterial infection or a prophylactic indication is unlikely to provide benefit to the patient and increases the risk of the development of drug-resistant bacteria.
Drug Interactions
Antacids containing magnesium trisilicate, when administered concomitantly with nitrofurantoin, reduce both the rate and extent of absorption. The mechanism for this interaction probably is adsorption of nitrofurantoin onto the surface of magnesium trisilicate.
Uricosuric drugs, such as probenecid and sulfinpyrazone, can inhibit renal tubular secretion of nitrofurantoin. The resulting increase in nitrofurantoin serum levels may increase toxicity, and the decreased urinary levels could lessen its efficacy as a urinary tract antibacterial.
Drug/Laboratory Test Interactions
As a result of the presence of nitrofurantoin, a false-positive reaction for glucose in the urine may occur. This has been observed with Benedict’s and Fehling’s solutions but not with the glucose enzymatic test.
Carcinogenesis, Mutagenesis, Impairment of Fertility
Nitrofurantoin was not carcinogenic when fed to female Holtzman rats for 44.5 weeks or to female Sprague-Dawley rats for 75 weeks. Two chronic rodent bioassays utilizing male and female Sprague-Dawley rats and two chronic bioassays in Swiss mice and in BDF1 mice revealed no evidence of carcinogenicity.
Nitrofurantoin presented evidence of carcinogenic activity in female B6C3F1 mice as shown by increased incidences of tubular adenomas, benign mixed tumors, and granulosa cell tumors of the ovary. In male F344/N rats, there were increased incidences of uncommon kidney tubular cell neoplasms, osteosarcomas of the bone, and neoplasms of the subcutaneous tissue. In one study involving subcutaneous administration of 75 mg/kg nitrofurantoin to pregnant female mice, lung papillary adenomas of unknown significance were observed in the F1 generation.
Nitrofurantoin has been shown to induce point mutations in certain strains of Salmonella typhimurium and forward mutations in L5178Y mouse lymphoma cells. Nitrofurantoin induced increased numbers of sister chromatid exchanges and chromosomal aberrations in Chinese hamster ovary cells but not in human cells in culture. Results of the sex-linked recessive lethal assay in Drosophila were negative after administration of nitrofurantoin by feeding or by injection. Nitrofurantoin did not induce heritable mutation in the rodent models examined.
The significance of the carcinogenicity and mutagenicity findings relative to the therapeutic use of nitrofurantoin in humans is unknown.
The administration of high doses of nitrofurantoin to rats causes temporary spermatogenic arrest; this is reversible on discontinuing the drug. Doses of 10 mg/kg/day or greater in healthy human males may, in certain unpredictable instances, produce a slight to moderate spermatogenic arrest with a decrease in sperm count.
Pregnancy
Teratogenic effects: Pregnancy Category B. Several reproduction studies have been performed in rabbits and rats at doses up to 6 times the human dose and have revealed no evidence of impaired fertility or harm to the fetus due to nitrofurantoin. In a single published study conducted in mice at 68 times the human dose (based on mg/kg administered to the dam), growth retardation and a low incidence of minor and common malformations were observed. However, at 25 times the human dose, fetal malformations were not observed; the relevance of these findings to humans is uncertain. There are, however, no adequate and well-controlled studies in pregnant women. Because animal reproduction studies are not always predictive of human response, this drug should be used during pregnancy only if clearly needed.
Non-teratogenic effects: Nitrofurantoin has been shown in one published transplacental carcinogenicity study to induce lung papillary adenomas in the F1 generation mice at doses 19 times the human dose on a mg/kg basis. The relationship of this finding to potential human carcinogenesis is presently unknown. Because of the uncertainty regarding the human implications of these animal data, this drug should be used during pregnancy only if clearly needed.
Nursing Mothers
Nitrofurantoin has been detected in human breast milk in trace amounts. Because of the potential for serious adverse reactions from nitrofurantoin in nursing infants under one month of age, a decision should be made whether to discontinue nursing or to discontinue the drug, taking into account the importance of the drug to the mother (see CONTRAINDICATIONS).
Pediatric Use
Macrodantin is contraindicated in infants below the age of one month (see CONTRAINDICATIONS).
Geriatric Use
Clinical studies of Macrodantin did not include sufficient numbers of subjects aged 65 and over to determine whether they respond differently from younger subjects. Other reported clinical experience has not identified differences in responses between the elderly and younger patients. Spontaneous reports suggest a higher proportion of pulmonary reactions, including fatalities, in elderly patients; these differences appear to be related to the higher proportion of elderly patients receiving long-term nitrofurantoin therapy. As in younger patients, chronic pulmonary reactions generally are observed in patients receiving therapy for six months or longer (see WARNINGS). Spontaneous reports also suggest an increased proportion of severe hepatic reactions, including fatalities, in elderly patients (see WARNINGS).
In general, the greater frequency of decreased hepatic, renal, or cardiac function, and of concomitant disease or other drug therapy should be considered when prescribing Macrodantin. This drug is known to be substantially excreted by the kidney, and the risk of toxic reactions to this drug may be greater in patients with impaired renal function. Anuria, oliguria, or significant impairment of renal function (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine) are contraindications (see CONTRAINDICATIONS). Because elderly patients are more likely to have decreased renal function, care should be taken in dose selection, and it may be useful to monitor renal function.
Adverse Reactions/Side Effects
Respiratory:
CHRONIC, SUBACUTE, OR ACUTE PULMONARY HYPERSENSITIVITY REACTIONS MAY OCCUR.
CHRONIC PULMONARY REACTIONS OCCUR GENERALLY IN PATIENTS WHO HAVE RECEIVED CONTINUOUS TREATMENT FOR SIX MONTHS OR LONGER. MALAISE, DYSPNEA ON EXERTION, COUGH, AND ALTERED PULMONARY FUNCTION ARE COMMON MANIFESTATIONS WHICH CAN OCCUR INSIDIOUSLY. RADIOLOGIC AND HISTOLOGIC FINDINGS OF DIFFUSE INTERSTITIAL PNEUMONITIS OR FIBROSIS, OR BOTH, ARE ALSO COMMON MANIFESTATIONS OF THE CHRONIC PULMONARY REACTION. FEVER IS RARELY PROMINENT.
THE SEVERITY OF CHRONIC PULMONARY REACTIONS AND THEIR DEGREE OF RESOLUTION APPEAR TO BE RELATED TO THE DURATION OF THERAPY AFTER THE FIRST CLINICAL SIGNS APPEAR. PULMONARY FUNCTION MAY BE IMPAIRED PERMANENTLY, EVEN AFTER CESSATION OF THERAPY. THE RISK IS GREATER WHEN CHRONIC PULMONARY REACTIONS ARE NOT RECOGNIZED EARLY.
In subacute pulmonary reactions, fever and eosinophilia occur less often than in the acute form. Upon cessation of therapy, recovery may require several months. If the symptoms are not recognized as being drug-related and nitrofurantoin therapy is not stopped, the symptoms may become more severe.
Acute pulmonary reactions are commonly manifested by fever, chills, cough, chest pain, dyspnea, pulmonary infiltration with consolidation or pleural effusion on x-ray, and eosinophilia. Acute reactions usually occur within the first week of treatment and are reversible with cessation of therapy. Resolution often is dramatic (see WARNINGS).
Changes in EKG (e.g., non-specific ST/T wave changes, bundle branch block) have been reported in association with pulmonary reactions.
Cyanosis has been reported rarely.
Hepatic: Hepatic reactions, including hepatitis, cholestatic jaundice, chronic active hepatitis, and hepatic necrosis, occur rarely (see WARNINGS).
Neurologic: Peripheral neuropathy, which may become severe or irreversible, has occurred. Fatalities have been reported. Conditions such as renal impairment (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine), anemia, diabetes mellitus, electrolyte imbalance, vitamin B deficiency, and debilitating diseases may increase the possibility of peripheral neuropathy (see WARNINGS).
Asthenia, vertigo, nystagmus, dizziness, headache, and drowsiness also have been reported with the use of nitrofurantoin.
Benign intracranial hypertension (pseudotumor cerebri), confusion, depression, optic neuritis, and psychotic reactions have been reported rarely. Bulging fontanels, as a sign of benign intracranial hypertension in infants, have been reported rarely.
Dermatologic: Exfoliative dermatitis and erythema multiforme (including Stevens-Johnson syndrome) have been reported rarely. Transient alopecia also has been reported.
Allergic: A lupus-like syndrome associated with pulmonary reactions to nitrofurantoin has been reported. Also, angioedema; maculopapular, erythematous, or eczematous eruptions; pruritus; urticaria; anaphylaxis; arthralgia; myalgia; drug fever; chills; and vasculitis (sometimes associated with pulmonary reactions) have been reported. Hypersensitivity reactions represent the most frequent spontaneously-reported adverse events in worldwide postmarketing experience with nitrofurantoin formulations.
Gastrointestinal: Nausea, emesis, and anorexia occur most often. Abdominal pain and diarrhea are less common gastrointestinal reactions. These dose-related reactions can be minimized by reduction of dosage. Sialadenitis and pancreatitis have been reported. There have been sporadic reports of pseudomembranous colitis with the use of nitrofurantoin. The onset of pseudomembranous colitis symptoms may occur during or after antimicrobial treatment (see WARNINGS).
Hematologic: Cyanosis secondary to methemoglobinemia has been reported rarely.
Miscellaneous: As with other antimicrobial agents, superinfections caused by resistant organisms, e.g., Pseudomonas species or Candida species, can occur.
Laboratory Adverse Events: The following laboratory adverse events have been reported with the use of nitrofurantoin: increased AST (SGOT), increased ALT (SGPT), decreased hemoglobin, increased serum phosphorus, eosinophilia, glucose-6-phosphate dehydrogenase deficiency anemia (see WARNINGS), agranulocytosis, leukopenia, granulocytopenia, hemolytic anemia, thrombocytopenia, megaloblastic anemia. In most cases, these hematologic abnormalities resolved following cessation of therapy. Aplastic anemia has been reported rarely.
To report SUSPECTED ADVERSE REACTIONS, contact Almatica Pharma LLC at 1-877-447-7979 or FDA at 1-800-FDA-1088 or www.fda.gov/medwatch.
Overdosage
Occasional incidents of acute overdosage of Macrodantin have not resulted in any specific symptoms other than vomiting. Induction of emesis is recommended. There is no specific antidote, but a high fluid intake should be maintained to promote urinary excretion of the drug. It is dialyzable.
Macrodantin Dosage and Administration
Macrodantin should be given with food to improve drug absorption and, in some patients, tolerance.
Adults: 50 mg to 100 mg four times a day — the lower dosage level is recommended for uncomplicated urinary tract infections.
Pediatric Patients: 5 mg/kg to 7 mg/kg of body weight per 24 hours, given in four divided doses (contraindicated under one month of age).
Therapy should be continued for one week or for at least 3 days after sterility of the urine is obtained. Continued infection indicates the need for reevaluation.
For long-term suppressive therapy in adults, a reduction of dosage to 50 mg to 100 mg at bedtime may be adequate. For long-term suppressive therapy in pediatric patients, doses as low as 1 mg/kg per 24 hours, given in a single dose or in two divided doses, may be adequate. SEE WARNINGS SECTION REGARDING RISKS ASSOCIATED WITH LONG-TERM THERAPY.
How is Macrodantin supplied
Macrodantin (Nitrofurantoin Capsules, USP) (macrocrystals) is available as follows:
25 mg opaque, white capsule imprinted with «MACRODANTIN 25 mg» and «52427-286».
NDC 52427-286-01 bottle of 100
50 mg opaque, yellow and white capsule imprinted with «MACRODANTIN 50 mg» and «52427-287».
NDC 52427-287-01 bottle of 100
100 mg opaque, yellow capsule imprinted with «MACRODANTIN 100 mg» and «52427-288».
NDC 52427-288-01 bottle of 100
Store at 20° to 25°C (68° to 77°F). [See USP for Controlled Room Temperature.]
Dispense in a tight, light-resistant container as defined in the USP using a child-resistant closure.
Distributed by:
Almatica Pharma LLC
Morristown, NJ 07960 USA
Rev. 06/2020
PI286-08
NDC 52427-286-01 Rx Only
25 mg
Macrodantin®
(Nitrofurantoin Capsules, USP)
(macrocrystals)
URINARY TRACT
ANTIBACTERIAL
100 Capsules
Almatica®
NDC 52427-287-01 Rx Only
50 mg
Macrodantin®
(Nitrofurantoin Capsules, USP)
(macrocrystals)
URINARY TRACT
ANTIBACTERIAL
100 Capsules
Almatica®
NDC 52427-288-01 Rx Only
100 mg
Macrodantin®
(Nitrofurantoin Capsules, USP)
(macrocrystals)
URINARY TRACT
ANTIBACTERIAL
100 Capsules
Almatica®

Macrodantin Description
Macrodantin® (Nitrofurantoin Capsules, USP) (macrocrystals) is a synthetic chemical of controlled crystal size. It is a stable, yellow, crystalline compound. Macrodantin is an antibacterial agent for specific urinary tract infections. It is available in 25 mg, 50 mg, and 100 mg capsules for oral administration. Each capsule contains 25 mg, 50 mg, or 100 mg of nitrofurantoin macrocrystals.
1-[[(5-nitro-2-furanyl)methylene]amino]-2, 4-imidazolidinedione
Inactive Ingredients: Each capsule contains edible black ink, gelatin, lactose, starch, talc, titanium dioxide, and may contain FD&C Yellow No. 6 and D&C Yellow No. 10.
Macrodantin — Clinical Pharmacology
Macrodantin is a larger crystal form of Furadantin® (nitrofurantoin). The absorption of Macrodantin is slower and its excretion somewhat less when compared to Furadantin. Blood concentrations at therapeutic dosage are usually low. It is highly soluble in urine, to which it may impart a brown color.
Following a dose regimen of 100 mg q.i.d. for 7 days, average urinary drug recoveries (0 to 24 hours) on day 1 and day 7 were 37.9% and 35.0%.
Unlike many drugs, the presence of food or agents delaying gastric emptying can increase the bioavailability of Macrodantin, presumably by allowing better dissolution in gastric juices.
MICROBIOLOGY
Nitrofurantoin is a nitrofuran antimicrobial agent with activity against certain Gram-positive and Gram-negative bacteria.
Mechanism of Action
The mechanism of the antimicrobial action of nitrofurantoin is unusual among antibacterials.
Nitrofurantoin is reduced by bacterial flavoproteins to reactive intermediates which inactivate or alter bacterial ribosomal proteins and other acromolecules. As a result of such inactivations, the vital biochemical processes of protein synthesis, aerobic energy metabolism, DNA synthesis, RNA synthesis, and cell wall synthesis are inhibited. Nitrofurantoin is bactericidal in urine at therapeutic doses. The broad-based nature of this mode of action may explain the lack of acquired bacterial resistance to nitrofurantoin, as the necessary multiple and simultaneous mutations of the target macromolecules would likely be lethal to the bacteria.
Interactions with Other Antibiotics
Antagonism has been demonstrated in vitro between nitrofurantoin and quinolone antimicrobials. The clinical significance of this finding is unknown.
Development of Resistance
Development of resistance to nitrofurantoin has not been a significant problem since its introduction in 1953. Cross-resistance with antibiotics and sulfonamides has not been observed, and transferable resistance is, at most, a very rare phenomenon.
Nitrofurantoin has been shown to be active against most strains of the following bacteria both in vitro and in clinical infections (see INDICATIONS AND USAGE):
Aerobic and facultative Gram-positive microorganisms:
Staphylococcus aureus
Enterococci (e.g. Enterococcus faecalis)
Aerobic and facultative Gram-negative microorganisms:
Escherichia coli
NOTE: While nitrofurantoin has excellent activity against Enterococcus faecalis, the majority of Enterococcus faecium isolates are not susceptible to nitrofurantoin.
At least 90 percent of the following microorganisms exhibit an in vitro minimum inhibitory concentration (MIC) less than or equal to the susceptible breakpoint for nitrofurantoin. However, the efficacy of nitrofurantoin in treating clinical infections due to these
microorganisms has not been established in adequate and well-controlled trials.
Aerobic and facultative Gram-positive microorganisms:
Coagulase-negative staphylococci (including Staphylococcus epidermidis and Staphylococcus saprophyticus)
Streptococcus agalactiae
Group D streptococci
Viridans group streptococci
Aerobic and facultative Gram-negative microorganisms:
Citrobacter amalonaticus
Citrobacter diversus
Citrobacter freundii
Klebsiella oxytoca
Klebsiella ozaenae
NOTE: Some strains of Enterobacter species and Klebsiella species are resistant to nitrofurantoin.
Susceptibility Testing:
For specific information regarding susceptibility test interpretive criteria and associated test methods and quality control standards recognized by FDA for this drug, please see: https://www.fda.gov/STIC.
Indications and Usage for Macrodantin
Macrodantin is specifically indicated for the treatment of urinary tract infections when due to susceptible strains of Escherichia coli, enterococci, Staphylococcus aureus, and certain susceptible strains of Klebsiella and Enterobacter species.
Nitrofurantoin is not indicated for the treatment of pyelonephritis or perinephric abscesses.
To reduce the development of drug-resistant bacteria and maintain the effectiveness of Macrodantin and other antibacterial drugs, Macrodantin should be used only to treat or prevent infections that are proven or strongly suspected to be caused by susceptible bacteria. When culture and susceptibility information are available, they should be considered in selecting or modifying antibacterial therapy. In the absence of such data, local epidemiology and susceptibility patterns may contribute to the empiric selection of therapy.
Nitrofurantoins lack the broader tissue distribution of other therapeutic agents approved for urinary tract infections. Consequently, many patients who are treated with Macrodantin are predisposed to persistence or reappearance of bacteriuria. Urine specimens for culture and susceptibility testing should be obtained before and after completion of therapy. If persistence or reappearance of bacteriuria occurs after treatment with Macrodantin, other therapeutic agents with broader tissue distribution should be selected. In considering the use of Macrodantin, lower eradication rates should be balanced against the increased potential for systemic toxicity and for the development of antimicrobial resistance when agents with broader tissue distribution are utilized.
Contraindications
Anuria, oliguria, or significant impairment of renal function (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine) are contraindications. Treatment of this type of patient carries an increased risk of toxicity because of impaired excretion of the drug.
Because of the possibility of hemolytic anemia due to immature erythrocyte enzyme systems (glutathione instability), the drug is contraindicated in pregnant patients at term (38 to 42 weeks’ gestation), during labor and delivery, or when the onset of labor is imminent. For the same reason, the drug is contraindicated in neonates under one month of age.
Macrodantin is contraindicated in patients with a previous history of cholestatic jaundice/hepatic dysfunction associated with nitrofurantoin.
Macrodantin is also contraindicated in those patients with known hypersensitivity to nitrofurantoin.
Warnings
Pulmonary reactions:
ACUTE, SUBACUTE, OR CHRONIC PULMONARY REACTIONS HAVE BEEN OBSERVED IN PATIENTS TREATED WITH NITROFURANTOIN. IF THESE REACTIONS OCCUR, MACRODANTIN SHOULD BE DISCONTINUED AND APPROPRIATE MEASURES TAKEN. REPORTS HAVE CITED PULMONARY REACTIONS AS A CONTRIBUTING CAUSE OF DEATH.
CHRONIC PULMONARY REACTIONS (DIFFUSE INTERSTITIAL PNEUMONITIS OR PULMONARY FIBROSIS, OR BOTH) CAN DEVELOP INSIDIOUSLY. THESE REACTIONS OCCUR RARELY AND GENERALLY IN PATIENTS RECEIVING THERAPY FOR SIX MONTHS OR LONGER. CLOSE MONITORING OF THE PULMONARY CONDITION OF PATIENTS RECEIVING LONG-TERM THERAPY IS WARRANTED AND REQUIRES THAT THE BENEFITS OF THERAPY BE WEIGHED AGAINST POTENTIAL RISKS (SEE RESPIRATORY REACTIONS).
Hepatotoxicity:
Hepatic reactions, including hepatitis, cholestatic jaundice, chronic active hepatitis, and hepatic necrosis, occur rarely. Fatalities have been reported. The onset of chronic active hepatitis may be insidious, and patients should be monitored periodically for changes in biochemical tests that would indicate liver injury. If hepatitis occurs, the drug should be withdrawn immediately and appropriate measures should be taken.
Neuropathy:
Peripheral neuropathy, which may become severe or irreversible, has occurred. Fatalities have been reported. Conditions such as renal impairment (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine), anemia, diabetes mellitus, electrolyte imbalance, vitamin B deficiency, and debilitating disease may enhance the occurrence of peripheral neuropathy. Patients receiving long-term therapy should be monitored periodically for changes in renal function.
Optic neuritis has been reported rarely in postmarketing experience with nitrofurantoin formulations.
Hemolytic anemia:
Cases of hemolytic anemia of the primaquine-sensitivity type have been induced by nitrofurantoin. Hemolysis appears to be linked to a glucose-6-phosphate dehydrogenase deficiency in the red blood cells of the affected patients. This deficiency is found in 10 percent of Blacks and a small percentage of ethnic groups of Mediterranean and Near-Eastern origin. Hemolysis is an indication for discontinuing Macrodantin; hemolysis ceases when the drug is withdrawn.
Clostridium difficile-associated diarrhea:
Clostridium difficile associated diarrhea (CDAD) has been reported with use of nearly all antibacterial agents, including nitrofurantoin, and may range in severity from mild diarrhea to fatal colitis. Treatment with antibacterial agents alters the normal flora of the colon leading to overgrowth of C. difficile.
C. difficile produces toxins A and B which contribute to the development of CDAD. Hypertoxin producing strains of C. difficile cause increased morbidity and mortality, as these infections can be refractory to antimicrobial therapy and may require colectomy. CDAD must be considered in all patients who present with diarrhea following antibiotic use. Careful medical history is necessary since CDAD has been reported to occur over two months after the administration of antibacterial agents.
If CDAD is suspected or confirmed, ongoing antibiotic use not directed against C. difficile may need to be discontinued. Appropriate fluid and electrolyte management, protein supplementation, antibiotic treatment of C. difficile, and surgical evaluation should be instituted as clinically indicated.
Precautions
Information for Patients
Patients should be advised to take Macrodantin with food to further enhance tolerance and improve drug absorption. Patients should be instructed to complete the full course of therapy; however, they should be advised to contact their physician if any unusual symptoms occur during therapy.
Many patients who cannot tolerate microcrystalline nitrofurantoin are able to take Macrodantin without nausea.
Patients should be advised not to use antacid preparations containing magnesium trisilicate while taking Macrodantin.
Patients should be counseled that antibacterial drugs including Macrodantin should only be used to treat bacterial infections. They do not treat viral infections (e.g., the common cold). When Macrodantin is prescribed to treat a bacterial infection, patients should be told that although it is common to feel better early in the course of therapy, the medication should be taken exactly as directed. Skipping doses or not completing the full course of therapy may (1) decrease the effectiveness of the immediate treatment and (2) increase the likelihood that bacteria will develop resistance and will not be treatable by Macrodantin or other antibacterial drugs in the future.
Diarrhea is a common problem caused by antibiotics which usually ends when the antibiotic is discontinued. Sometimes after starting treatment with antibiotics, patients can develop watery and bloody stools (with or without stomach cramps and fever) even as late as two or more months after having taken the last dose of the antibiotic. If this occurs, patients should contact their physician as soon as possible.
General: Prescribing Macrodantin in the absence of a proven or strongly suspected bacterial infection or a prophylactic indication is unlikely to provide benefit to the patient and increases the risk of the development of drug-resistant bacteria.
Drug Interactions
Antacids containing magnesium trisilicate, when administered concomitantly with nitrofurantoin, reduce both the rate and extent of absorption. The mechanism for this interaction probably is adsorption of nitrofurantoin onto the surface of magnesium trisilicate.
Uricosuric drugs, such as probenecid and sulfinpyrazone, can inhibit renal tubular secretion of nitrofurantoin. The resulting increase in nitrofurantoin serum levels may increase toxicity, and the decreased urinary levels could lessen its efficacy as a urinary tract antibacterial.
Drug/Laboratory Test Interactions
As a result of the presence of nitrofurantoin, a false-positive reaction for glucose in the urine may occur. This has been observed with Benedict’s and Fehling’s solutions but not with the glucose enzymatic test.
Carcinogenesis, Mutagenesis, Impairment of Fertility
Nitrofurantoin was not carcinogenic when fed to female Holtzman rats for 44.5 weeks or to female Sprague-Dawley rats for 75 weeks. Two chronic rodent bioassays utilizing male and female Sprague-Dawley rats and two chronic bioassays in Swiss mice and in BDF1 mice revealed no evidence of carcinogenicity.
Nitrofurantoin presented evidence of carcinogenic activity in female B6C3F1 mice as shown by increased incidences of tubular adenomas, benign mixed tumors, and granulosa cell tumors of the ovary. In male F344/N rats, there were increased incidences of uncommon kidney tubular cell neoplasms, osteosarcomas of the bone, and neoplasms of the subcutaneous tissue. In one study involving subcutaneous administration of 75 mg/kg nitrofurantoin to pregnant female mice, lung papillary adenomas of unknown significance were observed in the F1 generation.
Nitrofurantoin has been shown to induce point mutations in certain strains of Salmonella typhimurium and forward mutations in L5178Y mouse lymphoma cells. Nitrofurantoin induced increased numbers of sister chromatid exchanges and chromosomal aberrations in Chinese hamster ovary cells but not in human cells in culture. Results of the sex-linked recessive lethal assay in Drosophila were negative after administration of nitrofurantoin by feeding or by injection. Nitrofurantoin did not induce heritable mutation in the rodent models examined.
The significance of the carcinogenicity and mutagenicity findings relative to the therapeutic use of nitrofurantoin in humans is unknown.
The administration of high doses of nitrofurantoin to rats causes temporary spermatogenic arrest; this is reversible on discontinuing the drug. Doses of 10 mg/kg/day or greater in healthy human males may, in certain unpredictable instances, produce a slight to moderate spermatogenic arrest with a decrease in sperm count.
Pregnancy
Teratogenic effects: Pregnancy Category B. Several reproduction studies have been performed in rabbits and rats at doses up to 6 times the human dose and have revealed no evidence of impaired fertility or harm to the fetus due to nitrofurantoin. In a single published study conducted in mice at 68 times the human dose (based on mg/kg administered to the dam), growth retardation and a low incidence of minor and common malformations were observed. However, at 25 times the human dose, fetal malformations were not observed; the relevance of these findings to humans is uncertain. There are, however, no adequate and well-controlled studies in pregnant women. Because animal reproduction studies are not always predictive of human response, this drug should be used during pregnancy only if clearly needed.
Non-teratogenic effects: Nitrofurantoin has been shown in one published transplacental carcinogenicity study to induce lung papillary adenomas in the F1 generation mice at doses 19 times the human dose on a mg/kg basis. The relationship of this finding to potential human carcinogenesis is presently unknown. Because of the uncertainty regarding the human implications of these animal data, this drug should be used during pregnancy only if clearly needed.
Labor and Delivery
See CONTRAINDICATIONS.
Nursing Mothers
Nitrofurantoin has been detected in human breast milk in trace amounts. Because of the potential for serious adverse reactions from nitrofurantoin in nursing infants under one month of age, a decision should be made whether to discontinue nursing or to discontinue the drug, taking into account the importance of the drug to the mother (see CONTRAINDICATIONS).
Pediatric Use
Macrodantin is contraindicated in infants below the age of one month (see CONTRAINDICATIONS).
Geriatric Use
Clinical studies of Macrodantin did not include sufficient numbers of subjects aged 65 and over to determine whether they respond differently from younger subjects. Other reported clinical experience has not identified differences in responses between the elderly and younger patients. Spontaneous reports suggest a higher proportion of pulmonary reactions, including fatalities, in elderly patients; these differences appear to be related to the higher proportion of elderly patients receiving long-term nitrofurantoin therapy. As in younger patients, chronic pulmonary reactions generally are observed in patients receiving therapy for six months or longer (see WARNINGS). Spontaneous reports also suggest an increased proportion of severe hepatic reactions, including fatalities, in elderly patients (see WARNINGS).
In general, the greater frequency of decreased hepatic, renal, or cardiac function, and of concomitant disease or other drug therapy should be considered when prescribing Macrodantin. This drug is known to be substantially excreted by the kidney, and the risk of toxic reactions to this drug may be greater in patients with impaired renal function. Anuria, oliguria, or significant impairment of renal function (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine) are contraindications (see CONTRAINDICATIONS). Because elderly patients are more likely to have decreased renal function, care should be taken in dose selection, and it may be useful to monitor renal function.
Adverse Reactions/Side Effects
Respiratory:
CHRONIC, SUBACUTE, OR ACUTE PULMONARY HYPERSENSITIVITY REACTIONS MAY OCCUR.
CHRONIC PULMONARY REACTIONS OCCUR GENERALLY IN PATIENTS WHO HAVE RECEIVED CONTINUOUS TREATMENT FOR SIX MONTHS OR LONGER. MALAISE, DYSPNEA ON EXERTION, COUGH, AND ALTERED PULMONARY FUNCTION ARE COMMON MANIFESTATIONS WHICH CAN OCCUR INSIDIOUSLY. RADIOLOGIC AND HISTOLOGIC FINDINGS OF DIFFUSE INTERSTITIAL PNEUMONITIS OR FIBROSIS, OR BOTH, ARE ALSO COMMON MANIFESTATIONS OF THE CHRONIC PULMONARY REACTION. FEVER IS RARELY PROMINENT.
THE SEVERITY OF CHRONIC PULMONARY REACTIONS AND THEIR DEGREE OF RESOLUTION APPEAR TO BE RELATED TO THE DURATION OF THERAPY AFTER THE FIRST CLINICAL SIGNS APPEAR. PULMONARY FUNCTION MAY BE IMPAIRED PERMANENTLY, EVEN AFTER CESSATION OF THERAPY. THE RISK IS GREATER WHEN CHRONIC PULMONARY REACTIONS ARE NOT RECOGNIZED EARLY.
In subacute pulmonary reactions, fever and eosinophilia occur less often than in the acute form. Upon cessation of therapy, recovery may require several months. If the symptoms are not recognized as being drug-related and nitrofurantoin therapy is not stopped, the symptoms may become more severe.
Acute pulmonary reactions are commonly manifested by fever, chills, cough, chest pain, dyspnea, pulmonary infiltration with consolidation or pleural effusion on x-ray, and eosinophilia. Acute reactions usually occur within the first week of treatment and are reversible with cessation of therapy. Resolution often is dramatic (see WARNINGS).
Changes in EKG (e.g., non-specific ST/T wave changes, bundle branch block) have been reported in association with pulmonary reactions.
Cyanosis has been reported rarely.
Hepatic: Hepatic reactions, including hepatitis, cholestatic jaundice, chronic active hepatitis, and hepatic necrosis, occur rarely (see WARNINGS).
Neurologic: Peripheral neuropathy, which may become severe or irreversible, has occurred. Fatalities have been reported. Conditions such as renal impairment (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine), anemia, diabetes mellitus, electrolyte imbalance, vitamin B deficiency, and debilitating diseases may increase the possibility of peripheral neuropathy (see WARNINGS).
Asthenia, vertigo, nystagmus, dizziness, headache, and drowsiness also have been reported with the use of nitrofurantoin.
Benign intracranial hypertension (pseudotumor cerebri), confusion, depression, optic neuritis, and psychotic reactions have been reported rarely. Bulging fontanels, as a sign of benign intracranial hypertension in infants, have been reported rarely.
Dermatologic: Exfoliative dermatitis and erythema multiforme (including Stevens-Johnson syndrome) have been reported rarely. Transient alopecia also has been reported.
Allergic: A lupus-like syndrome associated with pulmonary reactions to nitrofurantoin has been reported. Also, angioedema; maculopapular, erythematous, or eczematous eruptions; pruritus; urticaria; anaphylaxis; arthralgia; myalgia; drug fever; chills; and vasculitis (sometimes associated with pulmonary reactions) have been reported. Hypersensitivity reactions represent the most frequent spontaneously-reported adverse events in worldwide postmarketing experience with nitrofurantoin formulations.
Gastrointestinal: Nausea, emesis, and anorexia occur most often. Abdominal pain and diarrhea are less common gastrointestinal reactions. These dose-related reactions can be minimized by reduction of dosage. Sialadenitis and pancreatitis have been reported. There have been sporadic reports of pseudomembranous colitis with the use of nitrofurantoin. The onset of pseudomembranous colitis symptoms may occur during or after antimicrobial treatment (see WARNINGS).
Hematologic: Cyanosis secondary to methemoglobinemia has been reported rarely.
Miscellaneous: As with other antimicrobial agents, superinfections caused by resistant organisms, e.g., Pseudomonas species or Candida species, can occur.
Laboratory Adverse Events: The following laboratory adverse events have been reported with the use of nitrofurantoin: increased AST (SGOT), increased ALT (SGPT), decreased hemoglobin, increased serum phosphorus, eosinophilia, glucose-6-phosphate dehydrogenase deficiency anemia (see WARNINGS), agranulocytosis, leukopenia, granulocytopenia, hemolytic anemia, thrombocytopenia, megaloblastic anemia. In most cases, these hematologic abnormalities resolved following cessation of therapy. Aplastic anemia has been reported rarely.
To report SUSPECTED ADVERSE REACTIONS, contact Almatica Pharma LLC at 1-877-447-7979 or FDA at 1-800-FDA-1088 or www.fda.gov/medwatch.
Overdosage
Occasional incidents of acute overdosage of Macrodantin have not resulted in any specific symptoms other than vomiting. Induction of emesis is recommended. There is no specific antidote, but a high fluid intake should be maintained to promote urinary excretion of the drug. It is dialyzable.
Macrodantin Dosage and Administration
Macrodantin should be given with food to improve drug absorption and, in some patients, tolerance.
Adults: 50 mg to 100 mg four times a day — the lower dosage level is recommended for uncomplicated urinary tract infections.
Pediatric Patients: 5 mg/kg to 7 mg/kg of body weight per 24 hours, given in four divided doses (contraindicated under one month of age).
Therapy should be continued for one week or for at least 3 days after sterility of the urine is obtained. Continued infection indicates the need for reevaluation.
For long-term suppressive therapy in adults, a reduction of dosage to 50 mg to 100 mg at bedtime may be adequate. For long-term suppressive therapy in pediatric patients, doses as low as 1 mg/kg per 24 hours, given in a single dose or in two divided doses, may be adequate. SEE WARNINGS SECTION REGARDING RISKS ASSOCIATED WITH LONG-TERM THERAPY.
How is Macrodantin supplied
Macrodantin (Nitrofurantoin Capsules, USP) (macrocrystals) is available as follows:
25 mg opaque, white capsule imprinted with «MACRODANTIN 25 mg» and «52427-286».
NDC 52427-286-01 bottle of 100
50 mg opaque, yellow and white capsule imprinted with «MACRODANTIN 50 mg» and «52427-287».
NDC 52427-287-01 bottle of 100
100 mg opaque, yellow capsule imprinted with «MACRODANTIN 100 mg» and «52427-288».
NDC 52427-288-01 bottle of 100
Store at 20° to 25°C (68° to 77°F). [See USP for Controlled Room Temperature.]
Dispense in a tight, light-resistant container as defined in the USP using a child-resistant closure.
Distributed by:
Almatica Pharma LLC
Morristown, NJ 07960 USA
Rev. 06/2020
PI286-08
NDC 52427-286-01 Rx Only
25 mg
Macrodantin®
(Nitrofurantoin Capsules, USP)
(macrocrystals)
URINARY TRACT
ANTIBACTERIAL
100 Capsules
Almatica®
NDC 52427-287-01 Rx Only
50 mg
Macrodantin®
(Nitrofurantoin Capsules, USP)
(macrocrystals)
URINARY TRACT
ANTIBACTERIAL
100 Capsules
Almatica®
NDC 52427-288-01 Rx Only
100 mg
Macrodantin®
(Nitrofurantoin Capsules, USP)
(macrocrystals)
URINARY TRACT
ANTIBACTERIAL
100 Capsules
Almatica®

To reduce the development of drug-resistant bacteria and maintain the effectiveness of Macrodantin and other antibacterial drugs, Macrodantin should be used only to treat or prevent infections that are proven or strongly suspected to be caused by bacteria.
Macrodantin (nitrofurantoin macrocrystals) is a synthetic chemical of controlled crystal size. It is a stable, yellow, crystalline compound. Macrodantin is an antibacterial agent for specific urinary tract infections. It is available in 25 mg, 50 mg, and 100 mg capsules for oral administration.
Inactive Ingredients: Each capsule contains edible black ink, gelatin, lactose, starch, talc, titanium dioxide, and may contain FD&C Yellow No. 6 and D&C Yellow No. 10.
CLINICAL PHARMACOLOGY:
Macrodantin is a larger crystal form of Furadantin® (nitrofurantoin). The absorption of Macrodantin is slower and its excretion somewhat less when compared to Furadantin. Blood concentrations at therapeutic dosage are usually low. It is highly soluble in urine, to which it may impart a brown color.
Following a dose regimen of 100 mg q.i.d. for 7 days, average urinary drug recoveries (0-24 hours) on day 1 and day 7 were 37.9% and 35.0%.
Unlike many drugs, the presence of food or agents delaying gastric emptying can increase the bioavailability of Macrodantin, presumably by allowing better dissolution in gastric juices.
Microbiology: Nitrofurantoin is bactericidal in urine at therapeutic doses. The mechanism of the antimicrobial action of nitrofurantoin is unusual among antibacterials. Nitrofurantoin is reduced by bacterial flavoproteins to reactive intermediates which inactivate or alter bacterial ribosomal proteins and other macromolecules. As a result of such inactivations, the vital biochemical processes of protein synthesis, aerobic energy metabolism, DNA synthesis, RNA synthesis, and cell wall synthesis are inhibited. The broad-based nature of this mode of action may explain the lack of acquired bacterial resistance to nitrofurantoin, as the necessary multiple and simultaneous mutations of the target macromolecules would likely be lethal to the bacteria. Development of resistance to nitrofurantoin has not been a significant problem since its introduction in 1953. Cross-resistance with antibiotics and sulfonamides has not been observed, and transferable resistance is, at most, a very rare phenomenon.
Nitrofurantoin, in the form of Macrodantin, has been shown to be active against most strains of the following bacteria both in vitro and in clinical infections (see INDICATIONS AND USAGE):
- Gram-Positive Aerobes
- Staphylococcus aureus
- Enterococci (e.g., Enterococcus faecalis)
- Gram-Negative Aerobes
- Escherichia coli
NOTE: Some strains of Enterobacter species and Klebsiella species are resistant to nitrofurantoin.
Nitrofurantoin also demonstrates in vitro activity against the following microorganisms, although the clinical significance of these data with respect to treatment with Macrodantin is unknown:
- Gram-Positive Aerobes
- Coagulase-negative staphylococci
- (including Staphylococcus epidermidis and
- Staphylococcus saprophyticus)
- Streptococcus agalactiae
- Group D streptococci
- Viridans group streptococci
- Gram-Negative Aerobes
- Citrobacter amalonaticus
- Citrobacter diversus
- Citrobacter freundii
- Klebsiella oxytoca
- Klebsiella ozaenae
Nitrofurantoin is not active against most strains of Proteus species or Serratia species. It has no activity against Pseudomonas species.
Antagonism has been demonstrated in vitro between nitrofurantoin and quinolone antimicrobial agents. The clinical significance of this finding is unknown.
Susceptibility Tests:
Dilution techniques:
Quantitative methods are used to determine antimicrobial minimal inhibitory concentrations (MIC’s). These MIC’s provide estimates of the susceptibility of bacteria to antimicrobial compounds. The MIC’s should be determined using a standardized procedure. Standardized procedures are based on a dilution method1 (broth or agar) or equivalent with standardized inoculum concentrations and standardized concentrations of nitrofurantoin powder. The MIC values should be interpreted according to the following criteria:
| MIC (μg/mL) | Interpretation |
|---|---|
| ≤ 32 | Susceptible (S) |
| 64 | Intermediate (I) |
| ≥ 128 | Resistant (R) |
A report of «Susceptible» indicates that the pathogen is likely to be inhibited if the antimicrobial compound in the urine reaches the concentrations usually achievable. A report of «Intermediate» indicates that the result should be considered equivocal, and, if the microorganism is not fully susceptible to alternative, clinically feasible drugs, the test should be repeated. This category implies possible clinical applicability in body sites where the drug is physiologically concentrated or in situations where high dosage of drug can be used. This category also provides a buffer zone which prevents small uncontrolled technical factors from causing major discrepancies in interpretation. A report of «Resistant» indicates that the pathogen is not likely to be inhibited if the antimicrobial compound in the urine reaches the concentrations usually achievable; other therapy should be selected.
Standardized susceptibility test procedures require the use of laboratory control microorganisms to control the technical aspects of the laboratory procedures. Standard nitrofurantoin powder should provide the following MIC values:
| Microorganism | MIC (μg/mL) |
|---|---|
| E. coli ATCC 25922 | 4-16 |
| S. aureus ATCC 29213 | 8-32 |
| E. faecalis ATCC 29212 | 4-16 |
Diffusion techniques:
Quantitative methods that require measurement of zone diameters also provide reproducible estimates of the susceptibility of bacteria to antimicrobial compounds. One such standardized procedure2 requires the use of standardized inoculum concentrations. This procedure uses paper disks impregnated with 300 μg nitrofurantoin to test the susceptibility of microorganisms to nitrofurantoin.
Reports from the laboratory providing results of the standard single-disk susceptibility test with a 300 μg nitrofurantoin disk should be interpreted according to the following criteria:
| Zone Diameter (mm) | Interpretation |
|---|---|
| ≥ 17 | Susceptible (S) |
| 15-16 | Intermediate (I) |
| ≤ 14 | Resistant (R) |
Interpretation should be as stated above for results using dilution techniques. Interpretation involves correlation of the diameter obtained in the disk test with the MIC for nitrofurantoin.
As with standardized dilution techniques, diffusion methods require the use of laboratory control microorganisms that are used to control the technical aspects of the laboratory procedures. For the diffusion technique, the 300 μg nitrofurantoin disk should provide the following zone diameters in these laboratory test quality control strains:
| Microorganism | Zone Diameter (mm) |
|---|---|
| E. coli ATCC 25922 | 20-25 |
| S. aureus ATCC 25923 | 18-22 |
INDICATIONS AND USAGE:
Macrodantin is specifically indicated for the treatment of urinary tract infections when due to susceptible strains of Escherichia coli, enterococci, Staphylococcus aureus, and certain susceptible strains of Klebsiella and Enterobacter species.
Nitrofurantoin is not indicated for the treatment of pyelonephritis or perinephric abscesses.
To reduce the development of drug-resistant bacteria and maintain the effectiveness of Macrodantin and other antibacterial drugs, Macrodantin should be used only to treat or prevent infections that are proven or strongly suspected to be caused by susceptible bacteria. When culture and susceptibility information are available, they should be considered in selecting or modifying antibacterial therapy. In the absence of such data, local epidemiology and susceptibility patterns may contribute to the empiric selection of therapy.
Nitrofurantoins lack the broader tissue distribution of other therapeutic agents approved for urinary tract infections. Consequently, many patients who are treated with Macrodantin are predisposed to persistence or reappearance of bacteriuria. Urine specimens for culture and susceptibility testing should be obtained before and after completion of therapy. If persistence or reappearance of bacteriuria occurs after treatment with Macrodantin, other therapeutic agents with broader tissue distribution should be selected. In considering the use of Macrodantin, lower eradication rates should be balanced against the increased potential for systemic toxicity and for the development of antimicrobial resistance when agents with broader tissue distribution are utilized.
CONTRAINDICATIONS:
Anuria, oliguria, or significant impairment of renal function (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine) are contraindications. Treatment of this type of patient carries an increased risk of toxicity because of impaired excretion of the drug.
Because of the possibility of hemolytic anemia due to immature erythrocyte enzyme systems (glutathione instability), the drug is contraindicated in pregnant patients at term (38-42 weeks’ gestation), during labor and delivery, or when the onset of labor is imminent. For the same reason, the drug is contraindicated in neonates under one month of age.
Macrodantin is contraindicated in patients with a previous history of cholestatic jaundice/hepatic dysfunction associated with nitrofurantoin.
Macrodantin is also contraindicated in those patients with known hypersensitivity to nitrofurantoin.
WARNINGS:
Pulmonary reactions:
ACUTE, SUBACUTE, OR CHRONIC PULMONARY REACTIONS HAVE BEEN OBSERVED IN PATIENTS TREATED WITH NITROFURANTOIN. IF THESE REACTIONS OCCUR, MACRODANTIN SHOULD BE DISCONTINUED AND APPROPRIATE MEASURES TAKEN. REPORTS HAVE CITED PULMONARY REACTIONS AS A CONTRIBUTING CAUSE OF DEATH.
CHRONIC PULMONARY REACTIONS (DIFFUSE INTERSTITIAL PNEUMONITIS OR PULMONARY FIBROSIS, OR BOTH) CAN DEVELOP INSIDIOUSLY. THESE REACTIONS OCCUR RARELY AND GENERALLY IN PATIENTS RECEIVING THERAPY FOR SIX MONTHS OR LONGER. CLOSE MONITORING OF THE PULMONARY CONDITION OF PATIENTS RECEIVING LONG-TERM THERAPY IS WARRANTED AND REQUIRES THAT THE BENEFITS OF THERAPY BE WEIGHED AGAINST POTENTIAL RISKS (SEE RESPIRATORY REACTIONS).
Hepatotoxicity:
Hepatic reactions, including hepatitis, cholestatic jaundice, chronic active hepatitis, and hepatic necrosis, occur rarely. Fatalities have been reported. The onset of chronic active hepatitis may be insidious, and patients should be monitored periodically for changes in biochemical tests that would indicate liver injury. If hepatitis occurs, the drug should be withdrawn immediately and appropriate measures should be taken.
Neuropathy:
Peripheral neuropathy, which may become severe or irreversible, has occurred. Fatalities have been reported. Conditions such as renal impairment (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine), anemia, diabetes mellitus, electrolyte imbalance, vitamin B deficiency, and debilitating disease may enhance the occurrence of peripheral neuropathy. Patients receiving long-term therapy should be monitored periodically for changes in renal function.
Optic neuritis has been reported rarely in postmarketing experience with nitrofurantoin formulations.
Hemolytic anemia:
Cases of hemolytic anemia of the primaquine-sensitivity type have been induced by nitrofurantoin. Hemolysis appears to be linked to a glucose-6-phosphate dehydrogenase deficiency in the red blood cells of the affected patients. This deficiency is found in 10 percent of Blacks and a small percentage of ethnic groups of Mediterranean and Near-Eastern origin. Hemolysis is an indication for discontinuing Macrodantin; hemolysis ceases when the drug is withdrawn.
Clostridium difficile-associated diarrhea:
Clostridium difficile associated diarrhea (CDAD) has been reported with use of nearly all antibacterial agents, including nitrofurantoin, and may range in severity from mild diarrhea to fatal colitis. Treatment with antibacterial agents alters the normal flora of the colon leading to overgrowth of C. difficile.
C. difficile produces toxins A and B which contribute to the development of CDAD. Hypertoxin producing strains of C. difficile cause increased morbidity and mortality, as these infections can be refractory to antimicrobial therapy and may require colectomy. CDAD must be considered in all patients who present with diarrhea following antibiotic use. Careful medical history is necessary since CDAD has been reported to occur over two months after the administration of antibacterial agents.
If CDAD is suspected or confirmed, ongoing antibiotic use not directed against C. difficile may need to be discontinued. Appropriate fluid and electrolyte management, protein supplementation, antibiotic treatment of C. difficile, and surgical evaluation should be instituted as clinically indicated.
PRECAUTIONS:
Information for Patients: Patients should be advised to take Macrodantin with food to further enhance tolerance and improve drug absorption. Patients should be instructed to complete the full course of therapy; however, they should be advised to contact their physician if any unusual symptoms occur during therapy.
Many patients who cannot tolerate microcrystalline nitrofurantoin are able to take Macrodantin without nausea.
Patients should be advised not to use antacid preparations containing magnesium trisilicate while taking Macrodantin.
Patients should be counseled that antibacterial drugs including Macrodantin should only be used to treat bacterial infections. They do not treat viral infections (e.g., the common cold). When Macrodantin is prescribed to treat a bacterial infection, patients should be told that although it is common to feel better early in the course of therapy, the medication should be taken exactly as directed. Skipping doses or not completing the full course of therapy may (1) decrease the effectiveness of the immediate treatment and (2) increase the likelihood that bacteria will develop resistance and will not be treatable by Macrodantin or other antibacterial drugs in the future.
Diarrhea is a common problem caused by antibiotics which usually ends when the antibiotic is discontinued. Sometimes after starting treatment with antibiotics, patients can develop watery and bloody stools (with or without stomach cramps and fever) even as late as two or more months after having taken the last dose of the antibiotic. If this occurs, patients should contact their physician as soon as possible.
General: Prescribing Macrodantin in the absence of a proven or strongly suspected bacterial infection or a prophylactic indication is unlikely to provide benefit to the patient and increases the risk of the development of drug-resistant bacteria.
Drug Interactions: Antacids containing magnesium trisilicate, when administered concomitantly with nitrofurantoin, reduce both the rate and extent of absorption. The mechanism for this interaction probably is adsorption of nitrofurantoin onto the surface of magnesium trisilicate.
Uricosuric drugs, such as probenecid and sulfinpyrazone, can inhibit renal tubular secretion of nitrofurantoin. The resulting increase in nitrofurantoin serum levels may increase toxicity, and the decreased urinary levels could lessen its efficacy as a urinary tract antibacterial.
Drug/Laboratory Test Interactions: As a result of the presence of nitrofurantoin, a false-positive reaction for glucose in the urine may occur. This has been observed with Benedict’s and Fehling’s solutions but not with the glucose enzymatic test.
Carcinogenesis, Mutagenesis, Impairment of Fertility: Nitrofurantoin was not carcinogenic when fed to female Holtzman rats for 44.5 weeks or to female Sprague-Dawley rats for 75 weeks. Two chronic rodent bioassays utilizing male and female Sprague-Dawley rats and two chronic bioassays in Swiss mice and in BDF1 mice revealed no evidence of carcinogenicity.
Nitrofurantoin presented evidence of carcinogenic activity in female B6C3F1 mice as shown by increased incidences of tubular adenomas, benign mixed tumors, and granulosa cell tumors of the ovary. In male F344/N rats, there were increased incidences of uncommon kidney tubular cell neoplasms, osteosarcomas of the bone, and neoplasms of the subcutaneous tissue. In one study involving subcutaneous administration of 75 mg/kg nitrofurantoin to pregnant female mice, lung papillary adenomas of unknown significance were observed in the F1 generation.
Nitrofurantoin has been shown to induce point mutations in certain strains of Salmonella typhimurium and forward mutations in L5178Y mouse lymphoma cells. Nitrofurantoin induced increased numbers of sister chromatid exchanges and chromosomal aberrations in Chinese hamster ovary cells but not in human cells in culture. Results of the sex-linked recessive lethal assay in Drosophila were negative after administration of nitrofurantoin by feeding or by injection. Nitrofurantoin did not induce heritable mutation in the rodent models examined.
The significance of the carcinogenicity and mutagenicity findings relative to the therapeutic use of nitrofurantoin in humans is unknown.
The administration of high doses of nitrofurantoin to rats causes temporary spermatogenic arrest; this is reversible on discontinuing the drug. Doses of 10 mg/kg/day or greater in healthy human males may, in certain unpredictable instances, produce a slight to moderate spermatogenic arrest with a decrease in sperm count.
Pregnancy:
Teratogenic effects: Pregnancy Category B. Several reproduction studies have been performed in rabbits and rats at doses up to six times the human dose and have revealed no evidence of impaired fertility or harm to the fetus due to nitrofurantoin. In a single published study conducted in mice at 68 times the human dose (based on mg/kg administered to the dam), growth retardation and a low incidence of minor and common malformations were observed. However, at 25 times the human dose, fetal malformations were not observed; the relevance of these findings to humans is uncertain. There are, however, no adequate and well-controlled studies in pregnant women. Because animal reproduction studies are not always predictive of human response, this drug should be used during pregnancy only if clearly needed.
Non-teratogenic effects: Nitrofurantoin has been shown in one published transplacental carcinogenicity study to induce lung papillary adenomas in the F1 generation mice at doses 19 times the human dose on a mg/kg basis. The relationship of this finding to potential human carcinogenesis is presently unknown. Because of the uncertainty regarding the human implications of these animal data, this drug should be used during pregnancy only if clearly needed.
Labor and Delivery: See CONTRAINDICATIONS.
Nursing Mothers: Nitrofurantoin has been detected in human breast milk in trace amounts. Because of the potential for serious adverse reactions from nitrofurantoin in nursing infants under one month of age, a decision should be made whether to discontinue nursing or to discontinue the drug, taking into account the importance of the drug to the mother (see CONTRAINDICATIONS).
Pediatric Use: Macrodantin is contraindicated in infants below the age of one month (see CONTRAINDICATIONS).
Geriatric Use: Clinical studies of Macrodantin did not include sufficient numbers of subjects aged 65 and over to determine whether they respond differently from younger subjects. Other reported clinical experience has not identified differences in responses between the elderly and younger patients. Spontaneous reports suggest a higher proportion of pulmonary reactions, including fatalities, in elderly patients; these differences appear to be related to the higher proportion of elderly patients receiving long-term nitrofurantoin therapy. As in younger patients, chronic pulmonary reactions generally are observed in patients receiving therapy for six months or longer (see WARNINGS). Spontaneous reports also suggest an increased proportion of severe hepatic reactions, including fatalities, in elderly patients (see WARNINGS).
In general, the greater frequency of decreased hepatic, renal, or cardiac function, and of concomitant disease or other drug therapy should be considered when prescribing Macrodantin. This drug is known to be substantially excreted by the kidney, and the risk of toxic reactions to this drug may be greater in patients with impaired renal function. Anuria, oliguria, or significant impairment of renal function (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine) are contraindications (see CONTRAINDICATIONS). Because elderly patients are more likely to have decreased renal function, care should be taken in dose selection, and it may be useful to monitor renal function.
ADVERSE REACTIONS:
Respiratory:
CHRONIC, SUBACUTE, OR ACUTE PULMONARY HYPERSENSITIVITY REACTIONS MAY OCCUR.
CHRONIC PULMONARY REACTIONS OCCUR GENERALLY IN PATIENTS WHO HAVE RECEIVED CONTINUOUS TREATMENT FOR SIX MONTHS OR LONGER. MALAISE, DYSPNEA ON EXERTION, COUGH, AND ALTERED PULMONARY FUNCTION ARE COMMON MANIFESTATIONS WHICH CAN OCCUR INSIDIOUSLY. RADIOLOGIC AND HISTOLOGIC FINDINGS OF DIFFUSE INTERSTITIAL PNEUMONITIS OR FIBROSIS, OR BOTH, ARE ALSO COMMON MANIFESTATIONS OF THE CHRONIC PULMONARY REACTION. FEVER IS RARELY PROMINENT.
THE SEVERITY OF CHRONIC PULMONARY REACTIONS AND THEIR DEGREE OF RESOLUTION APPEAR TO BE RELATED TO THE DURATION OF THERAPY AFTER THE FIRST CLINICAL SIGNS APPEAR. PULMONARY FUNCTION MAY BE IMPAIRED PERMANENTLY, EVEN AFTER CESSATION OF THERAPY. THE RISK IS GREATER WHEN CHRONIC PULMONARY REACTIONS ARE NOT RECOGNIZED EARLY.
In subacute pulmonary reactions, fever and eosinophilia occur less often than in the acute form. Upon cessation of therapy, recovery may require several months. If the symptoms are not recognized as being drug-related and nitrofurantoin therapy is not stopped, the symptoms may become more severe.
Acute pulmonary reactions are commonly manifested by fever, chills, cough, chest pain, dyspnea, pulmonary infiltration with consolidation or pleural effusion on x-ray, and eosinophilia. Acute reactions usually occur within the first week of treatment and are reversible with cessation of therapy. Resolution often is dramatic (see WARNINGS).
Changes in EKG (e.g., non-specific ST/T wave changes, bundle branch block) have been reported in association with pulmonary reactions.
Cyanosis has been reported rarely.
Hepatic: Hepatic reactions, including hepatitis, cholestatic jaundice, chronic active hepatitis, and hepatic necrosis, occur rarely (see WARNINGS).
Neurologic: Peripheral neuropathy, which may become severe or irreversible, has occurred. Fatalities have been reported. Conditions such as renal impairment (creatinine clearance under 60 mL per minute or clinically significant elevated serum creatinine), anemia, diabetes mellitus, electrolyte imbalance, vitamin B deficiency, and debilitating diseases may increase the possibility of peripheral neuropathy (see WARNINGS).
Asthenia, vertigo, nystagmus, dizziness, headache, and drowsiness also have been reported with the use of nitrofurantoin.
Benign intracranial hypertension (pseudotumor cerebri), confusion, depression, optic neuritis, and psychotic reactions have been reported rarely. Bulging fontanels, as a sign of benign intracranial hypertension in infants, have been reported rarely.
Dermatologic: Exfoliative dermatitis and erythema multiforme (including Stevens-Johnson syndrome) have been reported rarely. Transient alopecia also has been reported.
Allergic: A lupus-like syndrome associated with pulmonary reactions to nitrofurantoin has been reported. Also, angioedema; maculopapular, erythematous, or eczematous eruptions; pruritus; urticaria; anaphylaxis; arthralgia; myalgia; drug fever; and chills have been reported. Hypersensitivity reactions represent the most frequent spontaneously-reported adverse events in worldwide postmarketing experience with nitrofurantoin formulations.
Gastrointestinal: Nausea, emesis, and anorexia occur most often. Abdominal pain and diarrhea are less common gastrointestinal reactions. These dose-related reactions can be minimized by reduction of dosage. Sialadenitis and pancreatitis have been reported. There have been sporadic reports of pseudomembranous colitis with the use of nitrofurantoin. The onset of pseudomembranous colitis symptoms may occur during or after antimicrobial treatment (see WARNINGS).
Hematologic: Cyanosis secondary to methemoglobinemia has been reported rarely.
Miscellaneous: As with other antimicrobial agents, superinfections caused by resistant organisms, e.g., Pseudomonas species or Candida species, can occur.
Laboratory Adverse Events: The following laboratory adverse events have been reported with the use of nitrofurantoin: increased AST (SGOT), increased ALT (SGPT), decreased hemoglobin, increased serum phosphorus, eosinophilia, glucose-6-phosphate dehydrogenase deficiency anemia (see WARNINGS), agranulocytosis, leukopenia, granulocytopenia, hemolytic anemia, thrombocytopenia, megaloblastic anemia. In most cases, these hematologic abnormalities resolved following cessation of therapy. Aplastic anemia has been reported rarely.
OVERDOSAGE:
Occasional incidents of acute overdosage of Macrodantin have not resulted in any specific symptoms other than vomiting. Induction of emesis is recommended. There is no specific antidote, but a high fluid intake should be maintained to promote urinary excretion of the drug. It is dialyzable.
DOSAGE AND ADMINISTRATION:
Macrodantin should be given with food to improve drug absorption and, in some patients, tolerance.
Adults: 50-100 mg four times a day — the lower dosage level is recommended for uncomplicated urinary tract infections.
Pediatric Patients: 5-7 mg/kg of body weight per 24 hours, given in four divided doses (contraindicated under one month of age).
Therapy should be continued for one week or for at least 3 days after sterility of the urine is obtained. Continued infection indicates the need for reevaluation.
For long-term suppressive therapy in adults, a reduction of dosage to 50-100 mg at bedtime may be adequate. For long-term suppressive therapy in pediatric patients, doses as low as 1 mg/kg per 24 hours, given in a single dose or in two divided doses, may be adequate. SEE WARNINGS SECTION REGARDING RISKS ASSOCIATED WITH LONG-TERM THERAPY.
HOW SUPPLIED:
Macrodantin is available as follows:
25 mg opaque, white capsule imprinted with one black line encircling the capsule and coded «MACRODANTIN 25 mg» and «0149-0007.»*
NDC 0149-0007-05 bottle of 100
50 mg opaque, yellow and white capsule imprinted with two black lines encircling the capsule and coded «MACRODANTIN 50 mg» and «0149-0008.»*
NDC 0149-0008-05 bottle of 100
NDC 0149-0008-67 bottle of 1000
100 mg opaque, yellow capsule imprinted with three black lines encircling the capsule and coded «MACRODANTIN 100 mg» and «0149-0009.»*
NDC 0149-0009-05 bottle of 100
NDC 0149-0009-67 bottle of 1000
*Capsule design, registered trademark of Procter & Gamble Pharmaceuticals.
Rx Only
REFERENCES:
- National Committee for Clinical Laboratory Standards. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically — Third Edition. Approved Standard NCCLS Document M7-A3, Vol. 13, No. 25, NCCLS, Villanova, PA, December 1993.
- National Committee for Clinical Laboratory Standards. Performance Standards for Antimicrobial Disk Susceptibility Tests — Fifth Edition. Approved Standard NCCLS Document M2-A5, Vol. 13, No. 24, NCCLS, Villanova, PA, December 1993.
Procter & Gamble Pharmaceuticals, Inc.,
Cincinnati, OH 45202
REVISED January 2009
Macrodantin
nitrofurantoin, macrocrystalline CAPSULE
Product Information |
|||
|---|---|---|---|
| Product Type | Human prescription drug label | Item Code (Source) | NDC:0149-0007 |
| Route of Administration | ORAL | DEA Schedule |
Active Ingredient/Active Moiety |
||
|---|---|---|
| Ingredient Name | Basis of Strength | Strength |
| nitrofurantoin, macrocrystalline nitrofurantoin | 25 mg |
Inactive Ingredients |
|
|---|---|
| Ingredient Name | Strength |
| edible black ink | |
| GELATIN | |
| LACTOSE | |
| starch | |
| talc | |
| titanium dioxide | |
| FD&C YELLOW NO. 6 | |
| D&C YELLOW NO. 10 |
Product Characteristics |
|||
|---|---|---|---|
| Color | Size | Imprint Code | Shape |
| white (opaque;white) | 14 mm | Macrodantin;25;mg;0149-0007 | OVAL |
Packaging |
||||
|---|---|---|---|---|
| # | Item Code | Package Description | Marketing Start Date | Marketing End Date |
| 1 | NDC:0149-0007-05 | 100 in 1 BOTTLE |
Macrodantin
nitrofurantoin, macrocrystalline CAPSULE
Product Information |
|||
|---|---|---|---|
| Product Type | Human prescription drug label | Item Code (Source) | NDC:0149-0008 |
| Route of Administration | ORAL | DEA Schedule |
Active Ingredient/Active Moiety |
||
|---|---|---|
| Ingredient Name | Basis of Strength | Strength |
| nitrofurantoin, macrocrystalline nitrofurantoin | 50 mg |
Inactive Ingredients |
|
|---|---|
| Ingredient Name | Strength |
| edible black ink | |
| GELATIN | |
| LACTOSE | |
| starch | |
| talc | |
| titanium dioxide | |
| FD&C YELLOW NO. 6 | |
| D&C YELLOW NO. 10 |
Product Characteristics |
|||
|---|---|---|---|
| Color | Size | Imprint Code | Shape |
| white (opaque; white) | 16 mm | Macrodantin;50;mg;0149-0008 | OVAL |
Packaging |
||||
|---|---|---|---|---|
| # | Item Code | Package Description | Marketing Start Date | Marketing End Date |
| 1 | NDC:0149-0008-05 | 100 in 1 BOTTLE | ||
| 2 | NDC:0149-0008-67 | 1000 in 1 BOTTLE |
Macrodantin
nitrofurantoin, macrocrystalline CAPSULE
Product Information |
|||
|---|---|---|---|
| Product Type | Human prescription drug label | Item Code (Source) | NDC:0149-0009 |
| Route of Administration | ORAL | DEA Schedule |
Active Ingredient/Active Moiety |
||
|---|---|---|
| Ingredient Name | Basis of Strength | Strength |
| nitrofurantoin, macrocrystalline nitrofurantoin | 100 mg |
Inactive Ingredients |
|
|---|---|
| Ingredient Name | Strength |
| edible black ink | |
| GELATIN | |
| LACTOSE | |
| starch | |
| talc | |
| titanium dioxide | |
| FD&C YELLOW NO. 6 | |
| D&C YELLOW NO. 10 |
Product Characteristics |
|||
|---|---|---|---|
| Color | Size | Imprint Code | Shape |
| yellow (opaque; yellow) | 18 mm | Macrodantin;100;mg;0149-0009 | OVAL |
Packaging |
||||
|---|---|---|---|---|
| # | Item Code | Package Description | Marketing Start Date | Marketing End Date |
| 1 | NDC:0149-0009-05 | 100 in 1 BOTTLE | ||
| 2 | NDC:0149-0009-67 | 1000 in 1 BOTTLE |
Топ 20 лекарств с такими-же компонентами:
Топ 20 лекарств с таким-же применением:
Описание Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Макродантин
Описание Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Макродантин доступно следующим образом:
25 мг непрозрачная белая капсула с надписью «МАКРОДАНТИН
25 мг »и« 52427-286 ».
NDC 52427-286-01 бутылка 100
50 мг непрозрачная желто-белая капсула с надписью
«МАКРОДАНТИН 50 мг» и «52427-287».
NDC 52427-287-01 бутылка 100
100 мг непрозрачная желтая капсула с надписью «МАКРОДАНТИН
100 мг »и« 52427-288 ».
NDC 52427-288-01 бутылка 100
Хранить при температуре от 20 ° до 25 ° C (от 68 ° до 77 ° F).
Распределите в плотном, легкостойком контейнере, как определено
в USP с использованием детской устойчивой крышки.
ССЫЛКИ
1. Институт клинических и лабораторных стандартов. Методы
для разведения антимикробных тестов на чувствительность к бактериям, которые растут
Аэробически; Утверждено Стандартно-Восьмое издание. CLSI документ M07-A8 [ISBN
1-56238-689-1]. Институт клинических и лабораторных стандартов, 940 West Valley
Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA, 2009.
2. Институт клинических и лабораторных стандартов.
Стандарты производительности для тестов на чувствительность к антимикробным дискам; Одобрено
Стандартно-десятое издание. Документ CLSI M02-A 10 [ISBN 1-56238-688-3]. Клинический
и Лабораторный институт стандартов, 940 West Valley Road, Suite 1400, Wayne,
Пенсильвания 19087-1898 США, 2009.
3. Институт клинических и лабораторных стандартов.
Стандарты эффективности тестирования на антимикробную чувствительность; Девятнадцатый
Информационное дополнение. Документ CLSI M100-S19 [ISBN 1-56238-716-2]. Клинический
и Лабораторный институт стандартов, 940 West Valley Road, Suite 1400, Wayne,
Пенсильвания 19087-1898 США, 2010.
Распространяется: Almatica Pharma, Inc. Пайн Брук, Нью-Джерси 07058
СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. Rev: 03/2013
Терапевтические показания
Описание Терапевтические показания Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Макродантин конкретно
указывается для лечения инфекций мочевыводящих путей, когда они подвержены
штаммы Escherichia coliэнтерококки Золотистый стафилококк,
и некоторые восприимчивые штаммы Klebsiella а также Enterobacter виды.
Нитрофурантоин не указан
для лечения пиелонефрита или перинфрических абсцессов. Чтобы уменьшить
развитие лекарственно-устойчивых бактерий и поддержание эффективности
Макродантин и другие антибактериальные препараты, Макродантин следует применять только для этого
лечить или предотвращать инфекции, которые, как доказано или сильно подозреваются, вызваны
восприимчивыми бактериями. Когда информация о культуре и восприимчивости доступна,
их следует учитывать при выборе или изменении антибактериальной терапии. В
отсутствие таких данных, местная эпидемиология и модели восприимчивости могут
способствовать эмпирическому выбору терапии.
Нитрофурантоинам не хватает
более широкое распределение тканей других терапевтических агентов, одобренных для мочеиспускания
желудочные инфекции. Следовательно, многие пациенты, которые получают лечение макродантином
предрасположены к стойкости или повторному появлению бактериурии. Образцы мочи
для культуры и восприимчивости тестирование должно быть получено до и после
завершение терапии. Если происходит постоянство или повторное появление бактериурии
после лечения макродантином другие терапевтические препараты с более широкой тканью
Распределение должно быть выбрано. При рассмотрении вопроса об использовании макродантина ниже
темпы ликвидации должны быть сбалансированы с возросшим потенциалом
системная токсичность и развитие устойчивости к противомикробным препаратам при
используются агенты с более широким распределением тканей.
Способ применения и дозы
Описание Способ применения и дозы Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Макродантин следует давать с пищей для улучшения приема лекарств
абсорбция и, у некоторых пациентов, толерантность.
Взрослые
50-100 мг четыре раза в день — более низкий уровень дозировки
рекомендуется при неосложненных инфекциях мочевыводящих путей.
Педиатрические пациенты
5-7 мг / кг массы тела в сутки, дается в четыре
разделенные дозы (противопоказаны в возрасте до одного месяца).
Терапия должна продолжаться в течение одной недели или, по крайней мере, в течение
Через 3 дня после стерильности мочи получается. Продолжение инфекции указывает
необходимость переоценки.
Для длительной супрессивной терапии у взрослых снижение
дозировки до 50-100 мг перед сном может быть достаточно. Для долгосрочного подавления
терапия у педиатрических пациентов, дозы до 1 мг / кг в сутки, вводимые в
однократная доза или две разделенные дозы могут быть адекватными. ВИДЕТЬ РАЗДЕЛ ПРЕДУПРЕЖДЕНИЙ
ОТНОСИТЕЛЬНО РИСКОВ, СВЯЗАННЫХ С ДЛИННОЙ ТЕРАПИЕЙ.
Противопоказания
Описание Противопоказания Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Анурия, олигурия или
значительное нарушение почечной функции (клиренс креатинина менее 60 мл на
незначительный или клинически значимый повышенный уровень креатинина в сыворотке)
противопоказания. Лечение этого типа пациента несет повышенный риск
токсичности из-за нарушения экскреции препарата.
Из-за возможности
гемолитическая анемия из-за незрелых ферментных систем эритроцитов (глутатион
нестабильность), препарат противопоказан беременным пациентам в срок (38-42
недель беременности), во время родов и родов или когда наступает роды
неизбежно. По той же причине препарат противопоказан новорожденным
один месяц возраста.
Макродантин противопоказан
у пациентов с предшествующей историей холестатической желтухи / печени
дисфункция, связанная с нитрофурантоином.
Макродантин тоже
противопоказан тем пациентам с известной гиперчувствительностью к
нитрофурантоин.
Особые предупреждения и меры предосторожности
Описание Особые предупреждения и меры предосторожности Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
ПРЕДУПРЕЖДЕНИЯ
Легочные реакции
ОСТРОЙ, ПОДЪЕМ, ИЛИ ХРОНИЧЕСКИЙ
ВНУТРЕННИЕ РЕАКЦИИ НАБЛЮДАЛИСЬ У ПАЦИЕНТОВ, ЛЕЧЕННЫХ В ЭТОМ
NITROFURANTOIN. ЕСЛИ ЭТИ РЕАКЦИИ ОККУР, МАКРОДАНТИН ДОЛЖЕН БЫТЬ ПРЕКРАЩЕН
И СООТВЕТСТВУЮЩИЕ МЕРЫ ПРИНЯТЫ. ДОКЛАДЫ ОТПРАВЛЕНЫ ПОЛЬМОНАРНЫМИ РЕАКЦИЯМИ КАК А
ВЗНОСНАЯ ПРИЧИНА СМЕРТИ .
ХРОНИЧЕСКИЕ ПЛЮМОНАРНЫЕ РЕАКЦИИ
(ДИФФЕКТИВНЫЙ ИНТЕРСТИТАЛЬНЫЙ ПНЕУМОНИТ ИЛИ ПОЛЬМОНАРНЫЙ ФИБРОЗ ИЛИ ОБА) МОЖЕТ РАЗВИТИЕ
НЕПРАВИЛЬНО. ЭТИ РЕАКЦИИ БУДУТ РЕЙДЕ И ГЕНЕРАЛЬНО В ПОЛУЧЕНИИ ПАЦИЕНТОВ
ТЕРАПИЯ НА ШЕСТЬ МЕСЯЦЕВ ИЛИ ДЛИННЕЕ. ЗАКРЫТЬ МОНИТОРИНГ ПОЛЬМОНАРНОГО СОСТОЯНИЯ
ПАЦИЕНТЫ, ПОЛУЧАЮЩИЕ ДЛИННУЮ ТЕРАПИЮ, ГАРАНТИРУЮТ И ТРЕБУЕТ, ЧТО
ПРЕИМУЩЕСТВА ТЕРАПИИ БУДУТ ВЕСЬ ПРОТИВ ПОТЕНЦИАЛЬНЫХ РИСКОВ (СМОТРИ RESPIRATORY
РЕАКЦИИ).
Гепатотоксичность
Печеночные реакции, в том числе
гепатит, холестатическая желтуха, хронический активный гепатит и печеночная
некроз, встречается редко. Смертность была зарегистрирована. Начало хронического
активный гепатит может быть коварным, и пациенты должны контролироваться
периодически для изменений в биохимических тестах, которые указывают на повреждение печени.
Если возникает гепатит, препарат следует немедленно отозвать и принять
меры должны быть приняты.
Нейропатия
Периферическая невропатия, которая
может стать серьезным или необратимым, произошло. Смертность была зарегистрирована.
Такие состояния, как почечная недостаточность (клиренс креатинина менее 60 мл на
незначительный или клинически значимый повышенный уровень креатинина в сыворотке), анемия, диабет
меллит, электролитный дисбаланс, дефицит витамина В и изнурительные заболевания
может усилить возникновение периферической невропатии. Пациенты получают
длительная терапия должна периодически контролироваться на предмет изменений почек
функция.
Оптический неврит был
редко сообщается в постмаркетинговом опыте с составами нитрофурантоина.
Гемолитическая анемия
Случаи гемолитической анемии
тип чувствительности к примахину был индуцирован нитрофурантоином. Гемолиз
по-видимому, связан с дефицитом глюкозо-6-фосфатдегидрогеназы в
эритроциты пострадавших пациентов. Этот недостаток обнаружен в 10
процент негров и небольшой процент этнических групп Средиземноморья и
Ближневосточное происхождение. Гемолиз является показателем прекращения приема Макродантина
гемолиз прекращается при отмене препарата.
Clostridium difficile-ассоциированная диарея: Clostridium difficile связанные
диарея (CDAD) была зарегистрирована с использованием почти всех антибактериальных средств
включая нитрофурантоин, и может варьироваться по степени тяжести от легкой диареи до смертельного исхода
колит. Лечение антибактериальными средствами изменяет нормальную флору
толстая кишка ведет к чрезмерному росту C. difficile.
C. difficile производит токсины А и В
которые способствуют развитию CDAD. Производящие гипертоксин штаммы C .
difficile вызывают повышенную заболеваемость и смертность, как эти инфекции могут
быть рефрактерным для антимикробной терапии и может потребовать колэктомии. CDAD должен быть
учитывается у всех пациентов с диареей после применения антибиотиков.
Тщательная история болезни необходима, так как CDAD, как сообщалось, происходит снова
через два месяца после введения антибактериальных средств.
Если CDAD подозревается или
подтверждено, продолжающееся использование антибиотиков не направлено против C. difficile может
должно быть прекращено. Соответствующее управление жидкостью и электролитом, белок
добавки, лечение антибиотиками C. difficileи хирургическая оценка
должно быть установлено как клинически указано.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Генеральный
Назначение Макродантина в
отсутствие доказанной или сильно подозреваемой бактериальной инфекции или профилактического средства
показания вряд ли принесут пользу пациенту и увеличат риск
развития лекарственно-устойчивых бактерий.
Канцерогенез, мутагенез
Нарушение плодородия
Нитрофурантоина не было
канцерогенный при кормлении самок крыс Хольцмана в течение 44,5 недель или самки
Крысы Sprague-Dawley в течение 75 недель. Два хронических биоанализа грызунов с использованием самцов
и самки крыс Sprague-Dawley и два хронических биоанализа у швейцарских мышей и в
Мыши BDF1 не выявили признаков канцерогенности.
Нитрофурантоин представлен
доказательства канцерогенной активности у самок мышей B6C3F1, что подтверждается увеличением
случаи трубчатых аденом, доброкачественных смешанных опухолей и опухолей клеток гранулезы
яичника. У самцов крыс F344 / N наблюдалось увеличение числа необычных случаев
опухолевые клетки почек, остеосаркомы кости и новообразования
подкожная клетчатка. В одном исследовании, включающем подкожное введение 75
мг / кг нитрофурантоина беременным самкам мышей, папиллярных аденом легких
неизвестное значение наблюдалось в поколении F1.
Нитрофурантоин был показан
вызывать точечные мутации в определенных штаммах Salmonella typhimurium а также
прямые мутации в клетках лимфомы мыши L5178Y. Нитрофурантоин индуцирован
увеличение числа сестринских хроматидных обменов и хромосомных аберраций в
Клетки яичника китайского хомячка, но не в клетках человека в культуре. Результаты
рецессивный летальный анализ на Drosophila был отрицательным после
введение нитрофурантоина путем кормления или инъекций. Нитрофурантоин сделал
не вызывать наследственную мутацию в исследованных моделях грызунов.
Значение
результаты канцерогенности и мутагенности относительно терапевтического использования
нитрофурантоин у людей неизвестен.
Администрация высокого
дозы нитрофурантоина крысам вызывают временную сперматогенную остановку; это
обратимый при прекращении приема препарата. Дозы 10 мг / кг / день или более в
здоровые человеческие мужчины могут в некоторых непредсказуемых случаях производить небольшое
умеренный сперматогенный арест с уменьшением количества сперматозоидов.
Беременность
Тератогенные эффекты — Беременность Категория B
Несколько исследований репродукции
были выполнены на кроликах и крысах в дозах, в шесть раз превышающих дозу для человека
и не выявили признаков нарушения фертильности или вреда для плода из-за
нитрофурантоин. В одном опубликованном исследовании, проведенном на мышах в 68 раз больше
доза для человека (в расчете на мг / кг, вводимая в плотину), задержка роста и а
наблюдалась низкая частота незначительных и распространенных пороков развития. Однако в 25
раз доза человека, пороки развития плода не наблюдались; актуальность
эти выводы для людей неопределенны. Однако нет адекватного и
хорошо контролируемые исследования у беременных женщин. Потому что исследования репродукции животных
не всегда предсказывают реакцию человека, этот препарат следует использовать во время
беременность только при необходимости.
Нетератогенные эффекты
Нитрофурантоин был показан
в одном опубликованном исследовании трансплацентарной канцерогенности, чтобы вызвать папиллярность легких
аденомы у мышей поколения F1 в дозах, в 19 раз превышающих дозу для человека в мг / кг
основа. Связь этого открытия с потенциальным канцерогенезом человека
в настоящее время неизвестно. Из-за неопределенности относительно человеческих последствий
из этих данных о животных этот препарат следует использовать во время беременности, только если
явно необходимо.
Труд и доставка
Видеть ПРОТИВОПОКАЗАНИЯ.
Сестринские матери
Нитрофурантоин был
обнаружен в грудном молоке человека в следовых количествах.
Из-за потенциала для
серьезные побочные реакции от нитрофурантоина у грудных детей до
один месяц, решение должно быть принято, прекратить ли уход или
прекратить прием препарата, принимая во внимание важность препарата для
мама (см ПРОТИВОПОКАЗАНИЯ).
Детская использования
Макродантин противопоказан детям младше возраста
одного месяца (см ПРОТИВОПОКАЗАНИЯ).
Гериатрическое использование
Клинические исследования Макродантина не включали
достаточное количество субъектов в возрасте 65 лет и старше, чтобы определить, являются ли они
отвечать по-разному от более молодых предметов. Другой зарегистрированный клинический опыт
не выявил различий в ответах между пожилыми и молодыми
пациентов. Спонтанные сообщения предполагают более высокую долю легочной артерии
реакции, в том числе со смертельным исходом, у пожилых пациентов; эти различия появляются
быть связанным с более высокой долей пожилых пациентов, получающих долгосрочные
нитрофурантоин терапия. Как и у более молодых пациентов, хронические легочные реакции
обычно наблюдаются у пациентов, получающих терапию в течение шести месяцев или дольше
(Видеть ПРЕДУПРЕЖДЕНИЯ). Спонтанные отчеты также предполагают увеличение доли
тяжелых печеночных реакций, в том числе со смертельным исходом, у пожилых пациентов (см ПРЕДУПРЕЖДЕНИЯ).
В общем, большая частота снижения печеночной
почечная или сердечная функция, а также сопутствующее заболевание или другая лекарственная терапия
следует учитывать при назначении макродантина. Этот препарат, как известно, есть
в значительной степени выводится почками, и риск токсических реакций на это
препарат может быть больше у пациентов с нарушениями функции почек. Анурия, олигурия
или значительное нарушение почечной функции (клиренс креатинина менее 60 мл
в минуту или клинически значимый повышенный уровень креатинина в сыворотке)
противопоказания (см ПРОТИВОПОКАЗАНИЯ). Потому что пожилые пациенты
более вероятно, что снизится почечная функция, следует соблюдать осторожность в дозе
выбор, и это может быть полезно для мониторинга почечной функции.
Взаимодействие с другими лекарствами
Описание Взаимодействие с другими лекарствами Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
БОКОВЫЕ ЭФФЕКТЫ
Респираторный
ХРОНИЧЕСКАЯ, ПОДВЕСНАЯ, ИЛИ ОСТРАЯ ПЛУМОНАРНАЯ ГИПЕРСЕНЗИТИВНОСТЬ
РЕАКЦИИ МОГУТ БЫТЬ .
ХРОНИЧЕСКИЕ ПЛУМОНАРНЫЕ РЕАКЦИИ, КАСАЮЩИЕСЯ В общем, у пациентов W
ХО ПОЛУЧИЛИ ПРОДОЛЖНОЕ ЛЕЧЕНИЕ ЗА ШЕСТЬ МЕСЯЦЕВ ИЛИ ДЛИН. MALAISE,
DYSPNEA по поводу выведения, кашля и ускоренной луммональной фундуции являются общими
МАНФЕСТАЦИИ, КОТОРЫЕ МОГУТ БЫТЬ ВНУТРИ. РАДИОЛОГИЧЕСКИЕ И ИСТОЛОГИЧЕСКИЕ ВЫВОДЫ
РАЗЛИЧНЫЙ ИНТЕРСТИТАЛЬНЫЙ ПНЕУМОНИТ ИЛИ ФИБРОЗ, ИЛИ ОБА, ТАКЖЕ ОБЩИЙ
ИЗМЕНЕНИЯ ХРОНИЧЕСКОЙ ПУЛЬМОНАРНОЙ РЕАКЦИИ. НЕСКОЛЬКО ОБЕЩАЕТСЯ .
НЕСКОЛЬКО ХРОНИЧЕСКИХ ПУЛЬМОНАРНЫХ РЕАКЦИЙ И ИХ
СТЕПЕНЬ РЕЗОЛЮЦИИ, ПО-видимому, СВЯЗАН С ПРОДОЛЖЕНИЕМ ТЕРАПИИ ПОСЛЕ
ПЕРВЫЕ КЛИНИЧЕСКИЕ ЗНАКИ ПОЯВЛЯЮТСЯ. ПОЛЬМОНАРНАЯ ФУНКЦИЯ МОЖЕТ БЫТЬ ПОСТАВЛЕН ПОСТОЯННО
ДАЖЕ ПОСЛЕ КЕССАЦИИ ТЕРАПИИ. РИСК БОЛЬШЕ, КОГДА ХРОНИЧЕСКИЙ ПУЛЬМОНАР
РЕАКЦИИ НЕ ПРИЗНАНЫ РАНЬШЕ .
При подострых легочных реакциях лихорадка и эозинофилия
встречаются реже, чем в острой форме. После прекращения терапии восстановление
может потребоваться несколько месяцев. Если симптомы не распознаются как бы
лекарственная и нитрофурантоин терапия не прекращается, симптомы могут стать
более суровый.
Острые легочные реакции обычно проявляются
лихорадка, озноб, кашель, боль в груди, одышка, легочная инфильтрация с
консолидация или плевральный выпот на рентгенограмме и эозинофилии. Острые реакции
обычно происходят в течение первой недели лечения и являются обратимыми с
прекращение терапии. Разрешение часто драматично (см ПРЕДУПРЕЖДЕНИЯ).
Изменения в ЭКГ (например,.неспецифические изменения волны ST / T
блок ветки пучка) были зарегистрированы в связи с легочным
реакции.
Цианоз сообщается редко.
Печеночный: Печеночные реакции, включая гепатит
Холестатическая желтуха, хронический активный гепатит и некроз печени
редко (см ПРЕДУПРЕЖДЕНИЯ).
Неврология: Периферическая невропатия, которая может
стал серьезным или необратимым, произошло. Смертность была зарегистрирована.
Такие состояния, как почечная недостаточность (клиренс креатинина менее 60 мл на
незначительный или клинически значимый повышенный уровень креатинина в сыворотке), анемия, диабет
меллит, электролитный дисбаланс, дефицит витамина В и изнурительный
заболевания могут увеличить вероятность периферической невропатии (см ПРЕДУПРЕЖДЕНИЯ).
Астения, головокружение, нистагм, головокружение, головная боль и др
сонливость также сообщалось с использованием нитрофурантоина.
Доброкачественная внутричерепная гипертензия (псевдоопухолевое головного мозга)
спутанность сознания, депрессия, неврит зрительного нерва и психотические реакции были
сообщается редко. Выпуклые роднички, как признак доброкачественного внутричерепного
гипертония у детей, сообщалось редко.
Дерматологический: Эксфолиативный дерматит и эритема
мультиформ (включая синдром Стивенса-Джонсона) сообщалось редко.
Временная алопеция также была зарегистрирована.
Аллергия: Люпус-подобный синдром, связанный с
легочные реакции на нитрофурантоин поступало. Также ангионевротический отек ;
макулопапулезные, эритематозные или экзематозные высыпания; зуд; крапивница;
анафилаксия; артралгия; миалгия; лекарственная лихорадка; озноб; и васкулит (иногда
связанные с легочными реакциями) были зарегистрированы. Гиперчувствительность
реакции представляют собой наиболее частые спонтанно сообщаемые побочные эффекты в
всемирный опыт постмаркетинга с составами нитрофурантоина.
Желудочно-кишечный тракт: Тошнота, рвота и анорексия
происходят чаще всего. Боль в животе и диарея встречаются реже в желудочно-кишечном тракте
реакции. Эти связанные с дозой реакции могут быть сведены к минимуму путем уменьшения
дозировка. Сиаладенит и панкреатит поступало. Там были
спорадические сообщения о псевдомембранозном колите с использованием нитрофурантоина.
Начало симптомов псевдомембранозного колита может возникнуть во время или после
антимикробное лечение (см ПРЕДУПРЕЖДЕНИЯ).
Гематологический: Цианоз вторичный по отношению к
метгемоглобинемия сообщается редко.
Разное: Как и с другими противомикробными агентами
суперинфекции, вызванные устойчивыми организмами, например., Pseudomonas виды
или Candida виды, могут возникнуть.
Лабораторные неблагоприятные события: Следующее
лабораторные побочные эффекты были зарегистрированы с использованием нитрофурантоина:
увеличение AST (SGOT), увеличение ALT (SGPT), снижение гемоглобина, увеличение
дефицит фосфора в сыворотке, эозинофилия, глюкозо-6-фосфатдегидрогеназы
анемия (см ПРЕДУПРЕЖДЕНИЯ), агранулоцитоз, лейкопения, гранулоцитопения,
гемолитическая анемия, тромбоцитопения, мегалобластическая анемия. В большинстве случаев это
гематологические нарушения устранены после прекращения терапии. Aplastic
анемия сообщается редко.
НАРКОТИКИ ВЗАИМОДЕЙСТВИЯ
Антациды, содержащие магний
трисиликат при одновременном назначении с нитрофурантоином уменьшает оба
скорость и степень поглощения. Механизм для этого взаимодействия, вероятно
адсорбция нитрофурантоина на поверхности трисиликата магния.
Урикосурные препараты, такие как
пробенецид и сульфинпиразон могут ингибировать секрецию почечных канальцев
нитрофурантоин. В результате повышение уровня нитрофурантоина в сыворотке может
повысить токсичность, а снижение уровня мочи может снизить его эффективность
как мочевыводящие пути антибактериальные.
Наркотик / Лабораторный тест
Взаимодействие
В результате присутствия
нитрофурантоин, может возникнуть ложноположительная реакция на глюкозу в моче.
Это наблюдалось с решениями Бенедикта и Фелинга, но не с
ферментативный тест на глюкозу.
Применение при беременности и кормлении грудью, фертильность
Описание Применение при беременности и кормлении грудью, фертильность Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Тератогенные эффекты — Беременность Категория B
Несколько исследований репродукции
были выполнены на кроликах и крысах в дозах, в шесть раз превышающих дозу для человека
и не выявили признаков нарушения фертильности или вреда для плода из-за
нитрофурантоин. В одном опубликованном исследовании, проведенном на мышах в 68 раз больше
доза для человека (в расчете на мг / кг, вводимая в плотину), задержка роста и а
наблюдалась низкая частота незначительных и распространенных пороков развития. Однако в 25
раз доза человека, пороки развития плода не наблюдались; актуальность
эти выводы для людей неопределенны. Однако нет адекватного и
хорошо контролируемые исследования у беременных женщин. Потому что исследования репродукции животных
не всегда предсказывают реакцию человека, этот препарат следует использовать во время
беременность только при необходимости.
Нетератогенные эффекты
Нитрофурантоин был показан
в одном опубликованном исследовании трансплацентарной канцерогенности, чтобы вызвать папиллярность легких
аденомы у мышей поколения F1 в дозах, в 19 раз превышающих дозу для человека в мг / кг
основа. Связь этого открытия с потенциальным канцерогенезом человека
в настоящее время неизвестно. Из-за неопределенности относительно человеческих последствий
из этих данных о животных этот препарат следует использовать во время беременности, только если
явно необходимо.
Побочные эффекты
Описание Побочные эффекты Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Респираторный
ХРОНИЧЕСКАЯ, ПОДВЕСНАЯ, ИЛИ ОСТРАЯ ПЛУМОНАРНАЯ ГИПЕРСЕНЗИТИВНОСТЬ
РЕАКЦИИ МОГУТ БЫТЬ .
ХРОНИЧЕСКИЕ ПЛУМОНАРНЫЕ РЕАКЦИИ, КАСАЮЩИЕСЯ В общем, у пациентов W
ХО ПОЛУЧИЛИ ПРОДОЛЖНОЕ ЛЕЧЕНИЕ ЗА ШЕСТЬ МЕСЯЦЕВ ИЛИ ДЛИН. MALAISE,
DYSPNEA по поводу выведения, кашля и ускоренной луммональной фундуции являются общими
МАНФЕСТАЦИИ, КОТОРЫЕ МОГУТ БЫТЬ ВНУТРИ. РАДИОЛОГИЧЕСКИЕ И ИСТОЛОГИЧЕСКИЕ ВЫВОДЫ
РАЗЛИЧНЫЙ ИНТЕРСТИТАЛЬНЫЙ ПНЕУМОНИТ ИЛИ ФИБРОЗ, ИЛИ ОБА, ТАКЖЕ ОБЩИЙ
ИЗМЕНЕНИЯ ХРОНИЧЕСКОЙ ПУЛЬМОНАРНОЙ РЕАКЦИИ. НЕСКОЛЬКО ОБЕЩАЕТСЯ .
НЕСКОЛЬКО ХРОНИЧЕСКИХ ПУЛЬМОНАРНЫХ РЕАКЦИЙ И ИХ
СТЕПЕНЬ РЕЗОЛЮЦИИ, ПО-видимому, СВЯЗАН С ПРОДОЛЖЕНИЕМ ТЕРАПИИ ПОСЛЕ
ПЕРВЫЕ КЛИНИЧЕСКИЕ ЗНАКИ ПОЯВЛЯЮТСЯ. ПОЛЬМОНАРНАЯ ФУНКЦИЯ МОЖЕТ БЫТЬ ПОСТАВЛЕН ПОСТОЯННО
ДАЖЕ ПОСЛЕ КЕССАЦИИ ТЕРАПИИ. РИСК БОЛЬШЕ, КОГДА ХРОНИЧЕСКИЙ ПУЛЬМОНАР
РЕАКЦИИ НЕ ПРИЗНАНЫ РАНЬШЕ .
При подострых легочных реакциях лихорадка и эозинофилия
встречаются реже, чем в острой форме. После прекращения терапии восстановление
может потребоваться несколько месяцев. Если симптомы не распознаются как бы
лекарственная и нитрофурантоин терапия не прекращается, симптомы могут стать
более суровый.
Острые легочные реакции обычно проявляются
лихорадка, озноб, кашель, боль в груди, одышка, легочная инфильтрация с
консолидация или плевральный выпот на рентгенограмме и эозинофилии. Острые реакции
обычно происходят в течение первой недели лечения и являются обратимыми с
прекращение терапии. Разрешение часто драматично (см ПРЕДУПРЕЖДЕНИЯ).
Изменения в ЭКГ (например,.неспецифические изменения волны ST / T
блок ветки пучка) были зарегистрированы в связи с легочным
реакции.
Цианоз сообщается редко.
Печеночный: Печеночные реакции, включая гепатит
Холестатическая желтуха, хронический активный гепатит и некроз печени
редко (см ПРЕДУПРЕЖДЕНИЯ).
Неврология: Периферическая невропатия, которая может
стал серьезным или необратимым, произошло. Смертность была зарегистрирована.
Такие состояния, как почечная недостаточность (клиренс креатинина менее 60 мл на
незначительный или клинически значимый повышенный уровень креатинина в сыворотке), анемия, диабет
меллит, электролитный дисбаланс, дефицит витамина В и изнурительный
заболевания могут увеличить вероятность периферической невропатии (см ПРЕДУПРЕЖДЕНИЯ).
Астения, головокружение, нистагм, головокружение, головная боль и др
сонливость также сообщалось с использованием нитрофурантоина.
Доброкачественная внутричерепная гипертензия (псевдоопухолевое головного мозга)
спутанность сознания, депрессия, неврит зрительного нерва и психотические реакции были
сообщается редко. Выпуклые роднички, как признак доброкачественного внутричерепного
гипертония у детей, сообщалось редко.
Дерматологический: Эксфолиативный дерматит и эритема
мультиформ (включая синдром Стивенса-Джонсона) сообщалось редко.
Временная алопеция также была зарегистрирована.
Аллергия: Люпус-подобный синдром, связанный с
легочные реакции на нитрофурантоин поступало. Также ангионевротический отек ;
макулопапулезные, эритематозные или экзематозные высыпания; зуд; крапивница;
анафилаксия; артралгия; миалгия; лекарственная лихорадка; озноб; и васкулит (иногда
связанные с легочными реакциями) были зарегистрированы. Гиперчувствительность
реакции представляют собой наиболее частые спонтанно сообщаемые побочные эффекты в
всемирный опыт постмаркетинга с составами нитрофурантоина.
Желудочно-кишечный тракт: Тошнота, рвота и анорексия
происходят чаще всего. Боль в животе и диарея встречаются реже в желудочно-кишечном тракте
реакции. Эти связанные с дозой реакции могут быть сведены к минимуму путем уменьшения
дозировка. Сиаладенит и панкреатит поступало. Там были
спорадические сообщения о псевдомембранозном колите с использованием нитрофурантоина.
Начало симптомов псевдомембранозного колита может возникнуть во время или после
антимикробное лечение (см ПРЕДУПРЕЖДЕНИЯ).
Гематологический: Цианоз вторичный по отношению к
метгемоглобинемия сообщается редко.
Разное: Как и с другими противомикробными агентами
суперинфекции, вызванные устойчивыми организмами, например., Pseudomonas виды
или Candida виды, могут возникнуть.
Лабораторные неблагоприятные события: Следующее
лабораторные побочные эффекты были зарегистрированы с использованием нитрофурантоина:
увеличение AST (SGOT), увеличение ALT (SGPT), снижение гемоглобина, увеличение
дефицит фосфора в сыворотке, эозинофилия, глюкозо-6-фосфатдегидрогеназы
анемия (см ПРЕДУПРЕЖДЕНИЯ), агранулоцитоз, лейкопения, гранулоцитопения,
гемолитическая анемия, тромбоцитопения, мегалобластическая анемия. В большинстве случаев это
гематологические нарушения устранены после прекращения терапии. Aplastic
анемия сообщается редко.
Передозировка
Описание Передозировка Macrodantin является автоматическим переводом с языка оригинала.
Ни в коем случае не используйте эту информацию для любых медицинских назначений или манипуляций.
Обязательно изучайте оригинальную инструкцию лекарства из упаковки.
В данном описании могут присутствовать многочисленные ошибки из-за автоматического перевода!
Учитывайте это и не используйте это описание!
more…
Случайные случаи острой передозировки макродантина
не привели к каким-либо конкретным симптомам, кроме рвоты. Индукция
рвота рекомендуется. Нет конкретного противоядия, но есть высокое потребление жидкости
следует поддерживать, чтобы способствовать экскреции препарата с мочой. Это
dialyzable.
Macrodantin цена
Средняя стоимость Macrodantin 50 mg за единицу в онлайн аптеках от 1.33$ до 2.78$, за упаковку от 73$ до 139$.
Доступно в странах
Найти в стране:
А
Б
В
Г
Д
Е
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ч
Ш
Э
Ю
Я
- Общее название:нитрофурантоиновые макроцисталы
- Название бренда:Макродантин
- Описание препарата
- Показания
- Дозировка
- Побочные эффекты
- Лекарственные взаимодействия
- Предупреждения
- Меры предосторожности
- Передозировка и противопоказания
- Клиническая фармакология
- Руководство по лекарствам
Описание препарата
Макродантин
(макрокристаллы нитрофурантоина) Капсулы
Чтобы уменьшить развитие устойчивых к лекарствам бактерий и поддерживать эффективность Макродантина и других антибактериальных препаратов, Макродантин следует использовать только для лечения или предотвращения инфекций, которые, как доказано или сильно подозреваются, вызваны бактериями.
ОПИСАНИЕ
Макродантин — это синтетическое химическое вещество с контролируемым размером кристаллов. Это стабильное кристаллическое соединение желтого цвета. Макродантин — антибактериальное средство против специфических инфекций мочевыводящих путей. Он доступен в капсулах по 25, 50 и 100 мг для перорального применения.
Неактивные Ингридиенты: Каждая капсула содержит съедобные черные чернила, желатин, лактозу, крахмал, тальк, диоксид титана и может содержать FD&C Yellow No. 6 и D&C Yellow No. 10.
Показания
ПОКАЗАНИЯ
Макродантин специально показан для лечения инфекций мочевыводящих путей, вызванных чувствительными штаммами кишечная палочка , энтерококки, Золотистый стафилококк , и некоторые чувствительные штаммы Клебсиелла и Энтеробактер разновидность.
Нитрофурантоин не показан для лечения пиелонефрита или околопочечных абсцессов. Чтобы уменьшить развитие устойчивых к лекарствам бактерий и сохранить эффективность Макродантина и других антибактериальных препаратов, Макродантин следует использовать только для лечения или профилактики инфекций, которые, как доказано или сильно подозреваются, вызваны чувствительными бактериями. Когда доступна информация о культуре и чувствительности, их следует учитывать при выборе или изменении антибактериальной терапии. В отсутствие таких данных местная эпидемиология и особенности восприимчивости могут способствовать эмпирическому выбору терапии.
Нитрофурантоины не имеют более широкого тканевого распределения, чем другие терапевтические агенты, одобренные для лечения инфекций мочевыводящих путей. Следовательно, многие пациенты, принимающие Макродантин, предрасположены к сохранению или повторному появлению бактериурии. Образцы мочи для посева и тестирования на чувствительность должны быть получены до и после завершения терапии. Если после лечения Макродантином возникает стойкость или повторное появление бактериурии, следует выбрать другие терапевтические агенты с более широким тканевым распределением. При рассмотрении использования Макродантина более низкие уровни эрадикации должны быть сбалансированы с повышенным потенциалом системной токсичности и развития устойчивости к противомикробным препаратам при использовании агентов с более широким распределением в тканях.
Дозировка
ДОЗИРОВКА И АДМИНИСТРИРОВАНИЕ
Макродантин следует принимать с пищей для улучшения абсорбции лекарственного средства и, у некоторых пациентов, его переносимости.
кларитин д 24 часа 15 отсчетов
Взрослые
50-100 мг четыре раза в день — более низкая дозировка рекомендуется при неосложненных инфекциях мочевыводящих путей.
Педиатрические пациенты
5-7 мг / кг массы тела в течение 24 часов в четыре приема (противопоказано в возрасте до одного месяца).
Терапию следует продолжать в течение одной недели или не менее 3 дней после получения стерильности мочи. Продолжающееся заражение указывает на необходимость повторной оценки.
Для длительной супрессивной терапии у взрослых может оказаться адекватным снижение дозировки до 50–100 мг перед сном. Для длительной супрессивной терапии у педиатрических пациентов могут быть достаточными дозы всего 1 мг / кг за 24 часа, вводимые в виде однократной дозы или в два приема. ВИДЕТЬ ПРЕДУПРЕЖДЕНИЯ РАЗДЕЛ, КАСАЮЩИЙСЯ РИСКОВ, СВЯЗАННЫХ С ДОЛГОВРЕМЕННОЙ ТЕРАПИЕЙ .
КАК ПОСТАВЛЯЕТСЯ
Макродантин доступен следующим образом:
25 мг непрозрачная белая капсула с надписью «МАКРОДАНТИН 25 мг» и «52427-286».
НДЦ 52427-286-01 флакон 100 шт.
50 мг непрозрачная желто-белая капсула с надписью «МАКРОДАНТИН 50 мг» и «52427-287».
НДЦ 52427-287-01 флакон 100 шт.
100 мг непрозрачная желтая капсула с надписью «МАКРОДАНТИН 100 мг» и «52427-288».
НДЦ 52427-288-01 флакон 100 шт.
Хранить при температуре от 20 до 25 ° C (от 68 до 77 ° F). [Видеть Фармакопея США для контролируемой комнатной температуры .]
Распределите в плотном, светостойком контейнере, как определено в USP, с использованием крышки, недоступной для детей.
РЕКОМЕНДАЦИИ
1. Институт клинических и лабораторных стандартов. Методы испытаний на чувствительность к противомикробным препаратам при разведении бактерий, которые растут в аэробных условиях; Утвержденное стандартное восьмое издание. Документ CLSI M07-A8 [ISBN 1-56238-689-1]. Институт клинических и лабораторных стандартов, 940 West Valley Road, Suite 1400, Wayne, Пенсильвания, 19087-1898, США, 2009.
2. Институт клинических и лабораторных стандартов. Стандарты производительности для тестов на чувствительность к антимикробным препаратам; Утвержденное стандартное десятое издание. Документ CLSI M02-A 10 [ISBN 1-56238-688-3]. Институт клинических и лабораторных стандартов, 940 West Valley Road, Suite 1400, Wayne, Пенсильвания, 19087-1898, США, 2009.
3. Институт клинических и лабораторных стандартов. Стандарты эффективности тестирования на чувствительность к противомикробным препаратам; Девятнадцатое информационное приложение. Документ CLSI M100-S19 [ISBN 1-56238-716-2]. Институт клинических и лабораторных стандартов, 940 West Valley Road, Suite 1400, Wayne, Пенсильвания, 19087-1898, США, 2010.
Распространяется: Almatica Pharma, Inc. Pine Brook, NJ 07058 USA. Ред .: 03/2013
Побочные эффекты
ПОБОЧНЫЕ ЭФФЕКТЫ
Респираторный
МОГУТ ПРОЙТИ ХРОНИЧЕСКИЕ, ПОДОСТРЫЕ ИЛИ ОСТРЫЕ РЕАКЦИИ ЛЕГНОЙ ГИПЕРЧУВСТВИТЕЛЬНОСТИ.
ХРОНИЧЕСКИЕ ЛЕГКИЕ РЕАКЦИИ В основном возникают у пациентов, которые получали непрерывное лечение в течение шести месяцев или дольше. Вредоносность, одышка при физической нагрузке, кашель и нарушение функции легких являются обычными проявлениями, которые могут происходить бессознательно. РАДИОЛОГИЧЕСКИЕ И ГИСТОЛОГИЧЕСКИЕ ВЫВОДЫ РАССЕЯНИЯ МЕЖСТАЛЬНЫЙ ПНЕВМОНИТ ИЛИ ФИБРОЗ ИЛИ И то и другое — ТАКЖЕ РАСПРОСТРАНЕННЫЕ ПРОЯВЛЕНИЯ ХРОНИЧЕСКОЙ ЛЕГКОЙ РЕАКЦИИ. РЕДКО ЗНАЧИТ ЛИХОРАДКА.
ТЯЖЕСТЬ ХРОНИЧЕСКИХ ЛЕГКИХ РЕАКЦИЙ И ИХ СТЕПЕНЬ РАЗРЕШЕНИЯ ПОКАЗЫВАЕТСЯ ОТНОСИТЕЛЬНО ПРОДОЛЖИТЕЛЬНОСТИ ТЕРАПИИ ПОСЛЕ ПОЯВЛЕНИЯ ПЕРВЫХ КЛИНИЧЕСКИХ ПРИЗНАКОВ. ФУНКЦИЯ ЛЕГКИМ МОЖЕТ БЫТЬ НАСТОЯЩИМ НАРУШЕННЫМ, ДАЖЕ ПОСЛЕ ПРЕКРАЩЕНИЯ ТЕРАПИИ. РИСК ПОВЫШАЕТСЯ, КОГДА ХРОНИЧЕСКИЕ ЛЕГКИЕ РЕАКЦИИ НЕ ВЫЯВЛЯЮТСЯ РАННЕЕ.
При подострых легочных реакциях лихорадка и эозинофилия возникают реже, чем при острой форме. После прекращения терапии для восстановления может потребоваться несколько месяцев. Если не распознать симптомы, связанные с приемом лекарств, и не прекратить терапию нитрофурантоином, симптомы могут стать более серьезными.
Острые легочные реакции обычно проявляются лихорадкой, ознобом, кашлем, болью в груди, одышкой, инфильтрацией легких с уплотнением или плевральным выпотом на рентгеновском снимке и эозинофилией. Острые реакции обычно возникают в течение первой недели лечения и обратимы при прекращении терапии. Разрешение часто бывает драматическим (см. ПРЕДУПРЕЖДЕНИЯ ).
Сообщалось об изменениях ЭКГ (например, неспецифических изменениях ST / T, блокаде ножек пучка Гиса) в связи с легочными реакциями.
О цианозе сообщалось редко.
Печеночная: Печеночные реакции, включая гепатит, холестатическую желтуху, хронический активный гепатит и некроз печени, возникают редко (см. ПРЕДУПРЕЖДЕНИЯ ).
Неврологический: Возникла периферическая невропатия, которая может стать серьезной или необратимой. Сообщений о гибели людей не поступало. Такие состояния, как почечная недостаточность (клиренс креатинина ниже 60 мл в минуту или клинически значимое повышение креатинина в сыворотке), анемия, сахарный диабет, дисбаланс электролитов, дефицит витамина B и изнурительные заболевания могут увеличивать вероятность периферической невропатии (см. ПРЕДУПРЕЖДЕНИЯ ).
Также при приеме нитрофурантоина сообщалось об астении, головокружении, нистагме, головокружении, головной боли и сонливости.
Редко сообщалось о доброкачественной внутричерепной гипертензии (псевдоопухоле мозга), спутанности сознания, депрессии, неврите зрительного нерва и психотических реакциях. О выпирающих родничках как о признаке доброкачественной внутричерепной гипертензии у младенцев сообщалось редко.
Дерматологический: Об эксфолиативном дерматите и мультиформной эритеме (включая синдром Стивенса-Джонсона) сообщалось редко. Сообщалось также о преходящей алопеции.
Аллергический: Сообщалось о волчаночноподобном синдроме, связанном с легочными реакциями на нитрофурантоин. Также ангионевротический отек; пятнисто-папулезные, эритематозные или экзематозные высыпания; зуд; крапивница; анафилаксия; артралгия; миалгия; лекарственная лихорадка; озноб; сообщалось о васкулите (иногда связанном с легочными реакциями). Реакции гиперчувствительности представляют собой наиболее частые нежелательные явления, о которых сообщают спонтанно, в мировом постмаркетинговом опыте применения препаратов нитрофурантоина.
Желудочно-кишечный тракт: Чаще всего возникают тошнота, рвота и анорексия. Боль в животе и диарея — менее частые желудочно-кишечные реакции. Эти дозозависимые реакции можно свести к минимуму, уменьшив дозировку. Сообщалось о сиаладените и панкреатите. Были спорадические сообщения о псевдомембранозном колите при применении нитрофурантоина. Симптомы псевдомембранозного колита могут появиться во время или после лечения антимикробными препаратами (см. ПРЕДУПРЕЖДЕНИЯ ).
Гематологические: О цианозе, вторичном по отношению к метгемоглобинемии, сообщалось редко.
Разное: Как и в случае с другими противомикробными средствами, суперинфекции, вызванные резистентными организмами, например, Псевдомонады виды или Candida виды, могут встречаться.
Лабораторные нежелательные явления: Сообщалось о следующих лабораторных побочных эффектах при использовании нитрофурантоина: повышение АСТ (SGOT), повышение АЛТ (SGPT), снижение гемоглобина, повышение сывороточного фосфора, эозинофилия, анемия, вызванная дефицитом глюкозо-6-фосфатдегидрогеназы (см. ПРЕДУПРЕЖДЕНИЯ ), агранулоцитоз, лейкопения, гранулоцитопения, гемолитическая анемия, тромбоцитопения, мегалобластная анемия. В большинстве случаев эти гематологические нарушения исчезли после прекращения терапии. Об апластической анемии сообщалось редко.
Лекарственные взаимодействия
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ
Антациды, содержащие трисиликат магния, при одновременном применении с нитрофурантоином снижают как скорость, так и степень абсорбции. Механизм этого взаимодействия, вероятно, заключается в адсорбции нитрофурантоина на поверхности трисиликата магния.
Урикозурические препараты, такие как пробенецид и сульфинпиразон, могут подавлять секрецию нитрофурантоина почечными канальцами. Возникающее в результате повышение уровня нитрофурантоина в сыворотке может увеличить токсичность, а снижение уровня в моче может снизить его эффективность в качестве антибактериального средства для мочевыводящих путей.
Взаимодействие с наркотиками / лабораторными тестами
В результате присутствия нитрофурантоина может возникнуть ложноположительная реакция на глюкозу в моче. Это наблюдалось с растворами Бенедикта и Фелинга, но не с ферментативным тестом на глюкозу.
Предупреждения
ПРЕДУПРЕЖДЕНИЯ
Легочные реакции
У БОЛЬНЫХ, ЛЕЧЕННЫХ НИТРОФУРАНТОИНОМ, НАБЛЮДАЛИСЬ ОСТРЫЕ, ПОДОСТРЫЕ ИЛИ ХРОНИЧЕСКИЕ ЛЕГКИЕ РЕАКЦИИ. ЕСЛИ ЭТИ РЕАКЦИИ ПРОИЗОШЛИ, СЛЕДУЕТ ПРЕКРАТИТЬ МАКРОДАНТИН И ПРИНЯТЬ СООТВЕТСТВУЮЩИЕ МЕРЫ. В ОТЧЕТАХ СОВЕТСЯ ПРИЧИНУ ЛЕГКИХ РЕАКЦИЙ, СПОСОБСТВУЮЩИХ СМЕРТИ.
ХРОНИЧЕСКИЕ ЛЕГКИЕ РЕАКЦИИ (ДИФФУЗНЫЙ ИНТЕРСТИТАЛЬНЫЙ ПНЕВМОНИТ ИЛИ ЛЕГОЧНЫЙ ФИБРОЗ , ИЛИ ОБА) МОГУТ БЫТЬ РАЗВИТИЕМ. ЭТИ РЕАКЦИИ ПРОНИКАЮТСЯ РЕДКО И ОБЫЧНО У ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ ЛЕЧЕНИЕ В ТЕЧЕНИЕ ШЕСТИ МЕСЯЦЕВ ИЛИ БОЛЕЕ. ТРУДНЫЙ МОНИТОРИНГ ЛЕГОЧНОГО СОСТОЯНИЯ ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ ДОЛГОСРОЧНУЮ ТЕРАПИЮ, ГАРАНТИРУЕТСЯ И ТРЕБУЕТСЯ, ЧТО ПРЕИМУЩЕСТВА ТЕРАПИИ СОЗДАВАЛИ ПОТЕНЦИАЛЬНЫЕ РИСКИ ДЫХАТЕЛЬНЫЕ РЕАКЦИИ ).
Гепатотоксичность
Печеночные реакции, включая гепатит, холестатическую желтуху, хронический активный гепатит и некроз печени, возникают редко. Сообщений о гибели людей не поступало. Начало хронического активного гепатита может быть незаметным, и пациентов следует периодически контролировать на предмет изменений в биохимических тестах, которые могут указывать на повреждение печени. При возникновении гепатита препарат следует немедленно отменить и принять соответствующие меры.
для чего используется преднизон?
Невропатия
Возникла периферическая невропатия, которая может стать серьезной или необратимой. Сообщений о гибели людей не поступало. Такие состояния, как почечная недостаточность (клиренс креатинина менее 60 мл в минуту или клинически значимое повышение креатинина сыворотки), анемия, сахарный диабет, дисбаланс электролитов, дефицит витамина B и изнурительное заболевание могут усилить возникновение периферической невропатии. Пациентов, получающих длительную терапию, следует периодически контролировать на предмет изменений функции почек.
В постмаркетинговом опыте применения нитрофурантоина редко сообщалось о неврите зрительного нерва.
Гемолитическая анемия
Нитрофурантоин вызывает случаи гемолитической анемии типа чувствительности к примахину. Гемолиз, по-видимому, связан с дефицитом глюкозо-6-фосфатдегидрогеназы в эритроцитах пораженных пациентов. Этот недостаток обнаруживается у 10 процентов чернокожих и небольшого процента этнических групп средиземноморского и ближневосточного происхождения. Гемолиз является показанием для прекращения приема Макродантина; гемолиз прекращается при отмене препарата.
Clostridium difficile -ассоциированная диарея: Clostridium difficile ассоциированная диарея (CDAD) сообщается при использовании почти всех антибактериальных средств, включая нитрофурантоин, и может варьироваться по степени тяжести от легкой диареи до фатального колита. Лечение антибактериальными средствами изменяет нормальную флору толстой кишки, что приводит к чрезмерному росту Это тяжело .
Это тяжело производит токсины A и B, которые способствуют развитию CDAD. Штаммы, продуцирующие гипертоксин Это тяжело вызывают повышенную заболеваемость и смертность, поскольку эти инфекции могут быть невосприимчивыми к противомикробной терапии и могут потребовать колэктомии. CDAD следует рассматривать у всех пациентов с диареей после приема антибиотиков. Необходим тщательный сбор анамнеза, поскольку сообщалось, что CDAD возникает в течение более двух месяцев после приема антибактериальных средств.
Если есть подозрение или подтверждение CDAD, продолжающееся использование антибиотиков не направлено против Это тяжело может потребоваться прекращение производства. Соответствующий контроль жидкости и электролитов, белковые добавки, лечение антибиотиками. Это тяжело , и хирургическое обследование должно быть назначено по клиническим показаниям.
Меры предосторожности
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Общее
Назначение Макродантина при отсутствии доказанной или сильно подозреваемой бактериальной инфекции или профилактических показаний вряд ли принесет пользу пациенту и увеличивает риск развития лекарственно-устойчивых бактерий.
Канцерогенез, мутагенез, нарушение фертильности
Нитрофурантоин не был канцерогенным при скармливании самкам крыс Holtzman в течение 44,5 недель или самкам крыс Sprague-Dawley в течение 75 недель. Два хронических биоанализа на грызунах с использованием самцов и самок крыс Sprague-Dawley и два хронических биоанализа на швейцарских мышах и мышах BDF1 не выявили никаких доказательств канцерогенности.
Нитрофурантоин продемонстрировал канцерогенную активность у самок мышей B6C3F1, о чем свидетельствует повышенная частота канальцевых аденом, доброкачественных смешанных опухолей и гранулезно-клеточных опухолей яичников. У самцов крыс F344 / N наблюдалась повышенная частота необычных новообразований почечных канальцев, остеосаркомы костей и новообразований подкожной клетчатки. В одном исследовании, включающем подкожное введение нитрофурантоина 75 мг / кг беременным самкам мышей, в поколении F1 наблюдались папиллярные аденомы неизвестного значения.
Было показано, что нитрофурантоин вызывает точечные мутации в некоторых штаммах Сальмонелла тифимуриум и прямые мутации в клетках лимфомы мыши L5178Y. Нитрофурантоин индуцировал повышенное количество обменов сестринских хроматид и хромосомных аберраций в клетках яичников китайского хомячка, но не в клетках человека в культуре. Результаты анализа рецессивной летальности, связанной с полом, у дрозофилы были отрицательными после введения нитрофурантоина путем кормления или инъекции. Нитрофурантоин не вызывал наследуемых мутаций в исследованных моделях грызунов.
Значение результатов канцерогенности и мутагенности относительно терапевтического использования нитрофурантоина у людей неизвестно.
Введение высоких доз нитрофурантоина крысам вызывает временную остановку сперматогена; это обратимо при прекращении приема препарата. Дозы 10 мг / кг / день или более для здоровых мужчин мужского пола могут в некоторых непредсказуемых случаях вызывать остановку сперматогена от легкой до умеренной с уменьшением количества сперматозоидов.
Беременность
Тератогенные эффекты — Категория B при беременности
Несколько исследований репродукции были выполнены на кроликах и крысах в дозах, в шесть раз превышающих дозу для человека, и не выявили никаких доказательств нарушения фертильности или вреда для плода из-за нитрофурантоина. В единственном опубликованном исследовании, проведенном на мышах при дозе, в 68 раз превышающей человеческую (исходя из мг / кг, вводимой матери), наблюдалась задержка роста и низкая частота мелких и общих пороков развития. Однако при дозе, в 25 раз превышающей человеческую, пороков развития плода не наблюдалось; Актуальность этих открытий для людей сомнительна. Однако адекватных и хорошо контролируемых исследований у беременных женщин не проводилось. Поскольку исследования репродукции животных не всегда позволяют предсказать реакцию человека, этот препарат следует использовать во время беременности только в случае крайней необходимости.
Нетератогенные эффекты
В одном опубликованном исследовании трансплацентарной канцерогенности было показано, что нитрофурантоин индуцирует папиллярные аденомы легких у мышей поколения F1 в дозах, в 19 раз превышающих дозу для человека из расчета на мг / кг. Связь этого открытия с потенциальным канцерогенезом у человека в настоящее время неизвестна. Из-за неопределенности в отношении воздействия этих данных на животных этот препарат следует использовать во время беременности только в том случае, если это явно необходимо.
Работа и доставка
Видеть ПРОТИВОПОКАЗАНИЯ .
Кормящие матери
Нитрофурантоин был обнаружен в грудном молоке человека в следовых количествах.
Из-за возможности серьезных побочных реакций нитрофурантоина у грудных детей в возрасте до одного месяца необходимо принять решение о прекращении кормления грудью или о прекращении приема препарата, принимая во внимание важность препарата для матери (см. ПРОТИВОПОКАЗАНИЯ ).
Педиатрическое использование
Макродантин противопоказан детям младше одного месяца (см. ПРОТИВОПОКАЗАНИЯ ).
Гериатрическое использование
Клинические исследования Macrodantin не включали достаточное количество субъектов в возрасте 65 лет и старше, чтобы определить, отличаются ли они от более молодых субъектов. Другой зарегистрированный клинический опыт не выявил различий в ответах пожилых и молодых пациентов. Спонтанные сообщения указывают на более высокую долю легочных реакций, включая летальные исходы, у пожилых пациентов; Эти различия, по-видимому, связаны с более высокой долей пожилых пациентов, получающих длительную терапию нитрофурантоином. Как и у более молодых пациентов, хронические легочные реакции обычно наблюдаются у пациентов, получающих терапию в течение шести месяцев или дольше (см. ПРЕДУПРЕЖДЕНИЯ ). Спонтанные сообщения также предполагают повышенную долю тяжелых печеночных реакций, включая летальные исходы, у пожилых пациентов (см. ПРЕДУПРЕЖДЕНИЯ ).
Как правило, при назначении Макродантина следует учитывать более частое снижение функции печени, почек или сердца, а также сопутствующие заболевания или другую лекарственную терапию. Известно, что этот препарат в значительной степени выводится почками, и риск токсических реакций на этот препарат может быть выше у пациентов с нарушением функции почек. Анурия, олигурия или значительное нарушение функции почек (клиренс креатинина ниже 60 мл в минуту или клинически значимое повышение креатинина сыворотки) являются противопоказаниями (см. ПРОТИВОПОКАЗАНИЯ ). Поскольку у пожилых пациентов более вероятно снижение функции почек, следует соблюдать осторожность при выборе дозы, и может быть полезно контролировать функцию почек.
Передозировка и противопоказания
ПЕРЕДОЗИРОВКА
Случайные случаи острой передозировки Macrodantin не привели ни к каким специфическим симптомам, кроме рвоты. Рекомендуется вызвать рвоту. Специфического антидота не существует, но следует поддерживать потребление большого количества жидкости, чтобы способствовать выведению препарата с мочой. Это диализируемый.
ПРОТИВОПОКАЗАНИЯ
Анурия, олигурия или значительное нарушение функции почек (клиренс креатинина ниже 60 мл в минуту или клинически значимое повышение креатинина сыворотки) являются противопоказаниями. Лечение этого типа пациентов связано с повышенным риском токсичности из-за нарушения выведения препарата.
картинки рака кожи на лице
Из-за возможности гемолитической анемии из-за незрелых ферментных систем эритроцитов (нестабильность глутатиона) препарат противопоказан беременным пациентам в срок (38-42 неделя беременности), во время родов и родоразрешения, или когда начало родов неизбежно. По этой же причине препарат противопоказан новорожденным в возрасте до одного месяца.
Макродантин противопоказан пациентам с холестатической желтухой / печеночной дисфункцией в анамнезе, связанной с приемом нитрофурантоина.
Макродантин также противопоказан пациентам с известной гиперчувствительностью к нитрофурантоину.
Клиническая фармакология
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
Макродантин — это более крупная кристаллическая форма фурадантина (нитрофурантоина). Всасывание Макродантина медленнее, а его выведение несколько меньше по сравнению с Фурадантином. Концентрации в крови при терапевтических дозах обычно низкие. Он хорошо растворяется в моче, что может придавать ей коричневый цвет.
После режима дозирования 100 мг четыре раза в день. в течение 7 дней среднее восстановление приема лекарств в моче (0-24 часа) в день 1 и день 7 составило 37,9% и 35,0%.
В отличие от многих лекарств, присутствие пищи или агентов, задерживающих опорожнение желудка, может увеличить биодоступность макродантина, предположительно, за счет лучшего растворения в желудочном соке.
Микробиология
Нитрофурантоин — это нитрофурановый антимикробный агент, обладающий активностью против определенных грамположительных и грамотрицательных бактерий.
Механизм действия
Механизм антимикробного действия нитрофурантоина необычен среди антибактериальных средств. Нитрофурантоин восстанавливается бактериальными флавопротеинами до реактивных промежуточных продуктов, которые инактивируют или изменяют бактериальные рибосомные белки и другие акромолекулы. В результате такой инактивации подавляются жизненно важные биохимические процессы синтеза белка, аэробного энергетического метаболизма, синтеза ДНК, синтеза РНК и синтеза клеточной стенки. Нитрофурантоин оказывает бактерицидное действие в моче в терапевтических дозах. Широкий характер этого механизма действия может объяснить отсутствие приобретенной устойчивости бактерий к нитрофурантоину, поскольку необходимые множественные и одновременные мутации целевых макромолекул, вероятно, будут летальными для бактерий.
Взаимодействие с другими антибиотиками
Антагонизм был продемонстрирован in vitro между нитрофурантоином и хинолоновыми противомикробными средствами. Клиническое значение этого открытия неизвестно.
Развитие сопротивления
Развитие устойчивости к нитрофурантоину не представляло серьезной проблемы с момента его введения в 1953 году. Перекрестная резистентность к антибиотикам и сульфаниламидам не наблюдалась, а переносимая устойчивость — в лучшем случае очень редкое явление.
Было показано, что нитрофурантоин активен против большинства штаммов следующих бактерий: in vitro и при клинических инфекциях [см. ПОКАЗАНИЯ И ИСПОЛЬЗОВАНИЕ ):
Аэробные и факультативные грамположительные микроорганизмы
Золотистый стафилококк
Энтерококки (например. Энтерококк фекальный )
Аэробные и факультативные грамотрицательные микроорганизмы
кишечная палочка
ПРИМЕЧАНИЕ: В то время как нитрофурантоин обладает отличной активностью против Энтерококк фекальный , большая часть чего-либо Enterococcus faecium изоляты не чувствительны к нитрофурантоину.
По крайней мере, 90 процентов следующих микроорганизмов проявляют in vitro минимальная ингибирующая концентрация (МПК) меньше или равна чувствительной точке разрыва для нитрофурантоина. Однако эффективность нитрофурантоина в лечении клинических инфекций, вызванных этими микроорганизмами, не была установлена в адекватных и хорошо контролируемых исследованиях.
Аэробные и факультативные грамположительные микроорганизмы
Коагулазо-отрицательный стафилококки (включая Эпидермальный стафилококк и Staphylococcus saprophyticus )
Streptococcus agalactiae
Стрептококки группы D
Группа Вириданс стрептококки
Аэробные и факультативные грамотрицательные микроорганизмы
Citrobacter amalonaticus
разные энтерококки
Citrobacter freundii
Клебсиелла окситока
Klebsiella ozaenae
ПРИМЕЧАНИЕ. Некоторые штаммы видов Enterobacter и Klebsiella устойчивы к нитрофурантоину.
Методы испытаний на чувствительность
По возможности, клиническая микробиологическая лаборатория должна предоставлять врачу кумулятивные результаты тестов на чувствительность in vitro для противомикробных препаратов, используемых в стационарных больницах, в виде периодических отчетов, описывающих профиль чувствительности нозокомиальных и внебольничных патогенов. Эти отчеты должны помочь врачу выбрать наиболее эффективный противомикробный препарат.
Методы разведения : Количественные методы используются для определения минимальных ингибирующих концентраций (МПК) противомикробных препаратов. Эти МПК позволяют оценить чувствительность бактерий к антимикробным соединениям. MIC следует определять с использованием стандартной процедуры. Стандартизированные процедуры основаны на методе разбавления (бульон или агар) (1) или его эквиваленте со стандартизованными концентрациями посевного материала и стандартизованными концентрациями порошка нитрофурантоина. Значения MIC следует интерпретировать в соответствии с критериями, приведенными в таблице 1.
Техническое распространение : Количественные методы, требующие измерения диаметра зоны, также обеспечивают воспроизводимые оценки чувствительности бактерий к антимикробным соединениям. Одна из таких стандартизированных процедур (2) требует использования стандартизированных концентраций посевного материала. В этой процедуре используются бумажные диски, пропитанные 300 мкг нитрофурантоина, для проверки чувствительности микроорганизмов к нитрофурантоину. Критерии интерпретации дисковой диффузии представлены в таблице 1.
Таблица 1: Критерии интерпретации чувствительности к нитрофурантоину
| Возбудитель | Критерии интерпретации восприимчивости | |||||
| Минимальные ингибирующие концентрации (мкг / мл) | Дисковая диффузия (диаметр зоны в мм) | |||||
| S | я | р | S | я | р | |
| Энтеробактерии | & дельта; 32 | 64 | & epsilon; 128 | & epsilon; 17 | 15–16 | & дельта; 14 |
| Стафилококк виды | & дельта; 32 | 64 | & epsilon; 128 | & epsilon; 17 | 15–16 | & дельта; 14 |
| Энтерококк виды | & дельта; 32 | 64 | & epsilon; 128 | & epsilon; 17 | 15–16 | & дельта; 14 |
Отчет о Восприимчивый указывает на то, что патоген, вероятно, будет подавлен, если антимикробное соединение в моче достигнет обычно достижимых концентраций. Отчет о Средний указывает на то, что результат следует считать сомнительным, и, если микроорганизм не полностью восприимчив к альтернативным, клинически возможным препаратам, тест следует повторить. Эта категория подразумевает возможную клиническую применимость на участках тела, где препарат физиологически сконцентрирован, или в ситуациях, когда можно использовать высокие дозировки препарата. Эта категория также обеспечивает буферную зону, которая предотвращает появление небольших неконтролируемых технических факторов, вызывающих серьезные расхождения в интерпретации. Отчет Resistant указывает на то, что патоген вряд ли будет подавлен, если антимикробное соединение в моче достигнет обычно достижимых концентраций; следует выбрать другую терапию.
Контроль качества : Стандартизированные процедуры тестирования на чувствительность требуют использования микроорганизмов для контроля качества для управления техническими аспектами процедур тестирования (3). Стандартный порошок нитрофурантоина должен обеспечивать следующий диапазон значений, указанных в таблице 2.
Таблица 2: Допустимые диапазоны контроля качества для нитрофурантоина
| Штамм контроля качества | Приемлемые диапазоны контроля качества | |
| Минимальная ингибирующая концентрация (мкг / мл) | Дисковая диффузия (диаметр зоны в мм) | |
| кишечная палочка ATCC 25922 | 4–16 | 20-25 |
| Энтерококк фекальный ATCC 29212 | 4–16 | NAк |
| Золотистый стафилококк ATCC 29213 | 8–32 | NAк |
| Золотистый стафилококк ATCC 25923 | NAк | 18–22 |
| кНепригодный |
Руководство по лекарствам
ИНФОРМАЦИЯ О ПАЦИЕНТЕ
Пациентам следует рекомендовать принимать Макродантин с пищей для дальнейшего повышения переносимости и улучшения абсорбции лекарства. Пациенты должны быть проинструктированы о прохождении полного курса терапии; однако им следует посоветовать связаться со своим врачом, если во время терапии возникнут какие-либо необычные симптомы.
Многие пациенты, которые не переносят микрокристаллический нитрофурантоин, могут принимать Макродантин без тошноты.
Пациентам следует рекомендовать не использовать антацидные препараты, содержащие трисиликат магния, во время приема Макродантина.
фентермин и топамакс для похудения
Пациентам следует сообщить, что антибактериальные препараты, включая Макродантин, следует использовать только для лечения бактериальных инфекций. Они не лечат вирусные инфекции (например, простуду). Когда Макродантин назначают для лечения бактериальной инфекции, пациенты должны быть проинформированы о том, что, хотя обычно в начале курса лечения наблюдается улучшение самочувствия, лекарство следует принимать точно в соответствии с указаниями. Пропуск доз или неполный курс лечения может (1) снизить эффективность немедленного лечения и (2) повысить вероятность того, что у бактерий разовьется резистентность и они не будут лечиться Макродантином или другими антибактериальными препаратами в будущем.
Диарея — распространенная проблема, вызванная приемом антибиотиков, которая обычно заканчивается, когда прием антибиотика прекращается. Иногда после начала лечения антибиотиками у пациентов может развиваться водянистый и кровянистый стул (с желудочными спазмами и лихорадкой или без них) даже спустя два или более месяцев после приема последней дозы антибиотика. В этом случае пациенты должны как можно скорее связаться со своим врачом.
What Is Macrodantin?
Macrodantin (nitrofurantoin) is an antibiotic prescribed to treat or prevent urinary tract infections. Macrodantin is available in generic form.
What Are Side Effects of Macrodantin?
Side effects of Macrodantin include:
- headache,
- itching,
- rash,
- nausea,
- upset stomach,
- vomiting,
- loss of appetite,
- diarrhea,
- rust-colored or brownish urine, or
- vaginal itching or discharge.
Dosage for Macrodantin
Macrodantin should be given with food to improve drug absorption and, in some patients, tolerance. Adults should take 50-100 mg four times a day-the lower dosage level is recommended for uncomplicated urinary tract infections.
What Drugs, Substances, or Supplements Interact with Macrodantin?
Macrodantin may interact with antacids, magnesium salicylate, choline magnesium salicylate, or probenecid. Tell your doctor all medications and supplements you use.
MacrodantinDuring Pregnancy or Breastfeeding
This medication is not expected to be harmful to an unborn baby, unless it is used during the last 2 to 4 weeks of pregnancy. Nitrofurantoin passes into breast milk and may harm a nursing baby. Do not take this medication without telling your doctor if you are breastfeeding a baby.
Additional Information
Our Macrodantin (nitrofurantoin) Side Effects Drug Center provides a comprehensive view of available drug information on the potential side effects when taking this medication.
To reduce the development of drug-resistant bacteria and maintain the effectiveness of Macrodantin and other antibacterial drugs, Macrodantin should be used only to treat or prevent infections that are proven or strongly suspected to be caused by bacteria.
DESCRIPTION
Macrodantin is a synthetic chemical of controlled crystal size. It is a stable, yellow, crystalline compound. Macrodantin is an antibacterial agent for specific urinary tract infections. It is available in 25 mg, 50 mg, and 100 mg capsules for oral administration.
Inactive Ingredients: Each capsule contains edible black ink, gelatin, lactose, starch, talc, titanium dioxide, and may contain FD&C Yellow No. 6 and D&C Yellow No. 10.
INDICATIONS
Macrodantin is specifically
indicated for the treatment of urinary tract infections when due to susceptible
strains of Escherichia coli, enterococci, Staphylococcus aureus,
and certain susceptible strains of Klebsiella and Enterobacter species.
Nitrofurantoin is not indicated
for the treatment of pyelonephritis or perinephric abscesses. To reduce the
development of drug-resistant bacteria and maintain the effectiveness of
Macrodantin and other antibacterial drugs, Macrodantin should be used only to
treat or prevent infections that are proven or strongly suspected to be caused
by susceptible bacteria. When culture and susceptibility information are available,
they should be considered in selecting or modifying antibacterial therapy. In
the absence of such data, local epidemiology and susceptibility patterns may
contribute to the empiric selection of therapy.
Nitrofurantoins lack the
broader tissue distribution of other therapeutic agents approved for urinary
tract infections. Consequently, many patients who are treated with Macrodantin
are predisposed to persistence or reappearance of bacteriuria. Urine specimens
for culture and susceptibility testing should be obtained before and after
completion of therapy. If persistence or reappearance of bacteriuria occurs
after treatment with Macrodantin, other therapeutic agents with broader tissue
distribution should be selected. In considering the use of Macrodantin, lower
eradication rates should be balanced against the increased potential for
systemic toxicity and for the development of antimicrobial resistance when
agents with broader tissue distribution are utilized.
DOSAGE AND ADMINISTRATION
Macrodantin should be given with food to improve drug
absorption and, in some patients, tolerance.
Adults
50-100 mg four times a day —the lower dosage level is
recommended for uncomplicated urinary tract infections.
Pediatric Patients
5-7 mg/kg of body weight per 24 hours, given in four
divided doses (contraindicated under one month of age).
Therapy should be continued for one week or for at least
3 days after sterility of the urine is obtained. Continued infection indicates
the need for reevaluation.
For long-term suppressive therapy in adults, a reduction
of dosage to 50-100 mg at bedtime may be adequate. For long-term suppressive
therapy in pediatric patients, doses as low as 1 mg/kg per 24 hours, given in a
single dose or in two divided doses, may be adequate. SEE WARNINGS SECTION
REGARDING RISKS ASSOCIATED WITH LONG-TERM THERAPY.
HOW SUPPLIED
Macrodantin is available as follows:
25 mg opaque, white capsule imprinted with “MACRODANTIN
25 mg” and “52427-286”.
NDC 52427-286-01 bottle of 100
50 mg opaque, yellow and white capsule imprinted with
“MACRODANTIN 50 mg” and “52427-287”.
NDC 52427-287-01 bottle of 100
100 mg opaque, yellow capsule imprinted with “MACRODANTIN
100 mg” and “52427-288”.
NDC 52427-288-01 bottle of 100
Store at 20° to 25°C (68° to 77°F). [See USP for
Controlled Room Temperature.]
Dispense in a tight, light-resistant container as defined
in the USP using a child-resistant closure.
REFERENCES
1. Clinical and Laboratory Standards Institute. Methods
for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow
Aerobically; Approved Standard-Eighth Edition. CLSI document M07-A8 [ISBN
1-56238-689-1]. Clinical and Laboratory Standards Institute, 940 West Valley
Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA, 2009.
2. Clinical and Laboratory Standards Institute.
Performance Standards for Antimicrobial Disk Susceptibility Tests; Approved
Standard-Tenth Edition. CLSI document M02-A 10 [ISBN 1-56238-688-3]. Clinical
and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne,
Pennsylvania 19087-1898 USA, 2009.
3. Clinical and Laboratory Standards Institute.
Performance Standards for Antimicrobial Susceptibility Testing; Nineteenth
Informational Supplement. CLSI document M100-S19[ISBN 1-56238-716-2]. Clinical
and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne,
Pennsylvania 19087-1898 USA, 2010.
Distributed by:Almatica Pharma, Inc. Pine Brook, NJ 07058
USA. Rev: 03/2013
SIDE EFFECTS
Respiratory
CHRONIC, SUBACUTE, OR ACUTE PULMONARY HYPERSENSITIVITY
REACTIONS MAY OCCUR.
CHRONIC PULMONARY REACTIONS OCCUR GENERALLY IN PATIENTS W
HO HAVE RECEIVED CONTINUOUS TREATMENT FOR SIX MONTHS OR LONGER. MALAISE,
DYSPNEA ON EXERTION, COUGH, AND ALTERED PULMONARY FUNCTION ARE COMMON
MANIFESTATIONS WHICH CAN OCCUR INSIDIOUSLY. RADIOLOGIC AND HISTOLOGIC FINDINGS
OF DIFFUSE INTERSTITIAL PNEUMONITIS OR FIBROSIS, OR BOTH, ARE ALSO COMMON
MANIFESTATIONS OF THE CHRONIC PULMONARY REACTION. FEVER IS RARELY PROMINENT.
THE SEVERITY OF CHRONIC PULMONARY REACTIONS AND THEIR
DEGREE OF RESOLUTION APPEAR TO BE RELATED TO THE DURATION OF THERAPY AFTER THE
FIRST CLINICAL SIGNS APPEAR. PULMONARY FUNCTION MAY BE IMPAIRED PERMANENTLY,
EVEN AFTER CESSATION OF THERAPY. THE RISK IS GREATER WHEN CHRONIC PULMONARY
REACTIONS ARE NOT RECOGNIZED EARLY.
In subacute pulmonary reactions, fever and eosinophilia
occur less often than in the acute form. Upon cessation of therapy, recovery
may require several months. If the symptoms are not recognized as being
drug-related and nitrofurantoin therapy is not stopped, the symptoms may become
more severe.
Acute pulmonary reactions are commonly manifested by
fever, chills, cough, chest pain, dyspnea, pulmonary infiltration with
consolidation or pleural effusion on x-ray, and eosinophilia. Acute reactions
usually occur within the first week of treatment and are reversible with
cessation of therapy. Resolution often is dramatic (see WARNINGS).
Changes in EKG (e.g., non-specific ST/T wave changes,
bundle branch block) have been reported in association with pulmonary
reactions.
Cyanosis has been reported rarely.
Hepatic: Hepatic reactions, including hepatitis,
cholestatic jaundice, chronic active hepatitis, and hepatic necrosis, occur
rarely (see WARNINGS).
Neurologic: Peripheral neuropathy, which may
become severe or irreversible, has occurred. Fatalities have been reported.
Conditions such as renal impairment (creatinine clearance under 60 mL per
minute or clinically significant elevated serum creatinine), anemia, diabetes
mellitus, electrolyte imbalance, vitamin B deficiency, and debilitating
diseases may increase the possibility of peripheral neuropathy (see WARNINGS).
Asthenia, vertigo, nystagmus, dizziness, headache, and
drowsiness also have been reported with the use of nitrofurantoin.
Benign intracranial hypertension (pseudotumor cerebri),
confusion, depression, optic neuritis, and psychotic reactions have been
reported rarely. Bulging fontanels, as a sign of benign intracranial
hypertension in infants, have been reported rarely.
Dermatologic: Exfoliative dermatitis and erythema
multiforme (including Stevens-Johnson syndrome) have been reported rarely.
Transient alopecia also has been reported.
Allergic: A lupus-like syndrome associated with
pulmonary reactions to nitrofurantoin has been reported. Also, angioedema;
maculopapular, erythematous, or eczematous eruptions; pruritus; urticaria;
anaphylaxis; arthralgia; myalgia; drug fever; chills; and vasculitis (sometimes
associated with pulmonary reactions) have been reported. Hypersensitivity
reactions represent the most frequent spontaneously-reported adverse events in
worldwide postmarketing experience with nitrofurantoin formulations.
Gastrointestinal: Nausea, emesis, and anorexia
occur most often. Abdominal pain and diarrhea are less common gastrointestinal
reactions. These dose-related reactions can be minimized by reduction of
dosage. Sialadenitis and pancreatitis have been reported. There have been
sporadic reports of pseudomembranous colitis with the use of nitrofurantoin.
The onset of pseudomembranous colitis symptoms may occur during or after
antimicrobial treatment (see WARNINGS).
Hematologic: Cyanosis secondary to
methemoglobinemia has been reported rarely.
Miscellaneous: As with other antimicrobial agents,
superinfections caused by resistant organisms, e.g., Pseudomonas species
or Candida species, can occur.
Laboratory Adverse Events: The following
laboratory adverse events have been reported with the use of nitrofurantoin:
increased AST (SGOT), increased ALT (SGPT), decreased hemoglobin, increased
serum phosphorus, eosinophilia, glucose-6-phosphate dehydrogenase deficiency
anemia (see WARNINGS), agranulocytosis, leukopenia, granulocytopenia,
hemolytic anemia, thrombocytopenia, megaloblastic anemia. In most cases, these
hematologic abnormalities resolved following cessation of therapy. Aplastic
anemia has been reported rarely.
DRUG INTERACTIONS
Antacids containing magnesium
trisilicate, when administered concomitantly with nitrofurantoin, reduce both
the rate and extent of absorption. The mechanism for this interaction probably
is adsorption of nitrofurantoin onto the surface of magnesium trisilicate.
Uricosuric drugs, such as
probenecid and sulfinpyrazone, can inhibit renal tubular secretion of
nitrofurantoin. The resulting increase in nitrofurantoin serum levels may
increase toxicity, and the decreased urinary levels could lessen its efficacy
as a urinary tract antibacterial.
Drug/Laboratory Test
Interactions
As a result of the presence of
nitrofurantoin, a false-positive reaction for glucose in the urine may occur.
This has been observed with Benedict’s and Fehling’s solutions but not with the
glucose enzymatic test.
WARNINGS
Pulmonary reactions
ACUTE, SUBACUTE, OR CHRONIC
PULMONARY REACTIONS HAVE BEEN OBSERVED IN PATIENTS TREATED W ITH
NITROFURANTOIN. IF THESE REACTIONS OCCUR, MACRODANTIN SHOULD BE DISCONTINUED
AND APPROPRIATE MEASURES TAKEN. REPORTS HAVE CITED PULMONARY REACTIONS AS A
CONTRIBUTING CAUSE OF DEATH.
CHRONIC PULMONARY REACTIONS
(DIFFUSE INTERSTITIAL PNEUMONITIS OR PULMONARY FIBROSIS, OR BOTH) CAN DEVELOP
INSIDIOUSLY. THESE REACTIONS OCCUR RARELY AND GENERALLY IN PATIENTS RECEIVING
THERAPY FOR SIX MONTHS OR LONGER. CLOSE MONITORING OF THE PULMONARY CONDITION
OF PATIENTS RECEIVING LONG-TERM THERAPY IS WARRANTED AND REQUIRES THAT THE
BENEFITS OF THERAPY BE WEIGHED AGAINST POTENTIAL RISKS (SEE RESPIRATORY
REACTIONS).
Hepatotoxicity
Hepatic reactions, including
hepatitis, cholestatic jaundice, chronic active hepatitis, and hepatic
necrosis, occur rarely. Fatalities have been reported. The onset of chronic
active hepatitis may be insidious, and patients should be monitored
periodically for changes in biochemical tests that would indicate liver injury.
If hepatitis occurs, the drug should be withdrawn immediately and appropriate
measures should be taken.
Neuropathy
Peripheral neuropathy, which
may become severe or irreversible, has occurred. Fatalities have been reported.
Conditions such as renal impairment (creatinine clearance under 60 mL per
minute or clinically significant elevated serum creatinine), anemia, diabetes
mellitus, electrolyte imbalance, vitamin B deficiency, and debilitating disease
may enhance the occurrence of peripheral neuropathy. Patients receiving
long-term therapy should be monitored periodically for changes in renal
function.
Optic neuritis has been
reported rarely in postmarketing experience with nitrofurantoin formulations.
Hemolytic anemia
Cases of hemolytic anemia of
the primaquine-sensitivity type have been induced by nitrofurantoin. Hemolysis
appears to be linked to a glucose-6-phosphate dehydrogenase deficiency in the
red blood cells of the affected patients. This deficiency is found in 10
percent of Blacks and a small percentage of ethnic groups of Mediterranean and
Near-Eastern origin. Hemolysis is an indication for discontinuing Macrodantin;
hemolysis ceases when the drug is withdrawn.
Clostridium difficile-associated diarrhea: Clostridium difficile associated
diarrhea (CDAD) has been reported with use of nearly all antibacterial agents,
including nitrofurantoin, and may range in severity from mild diarrhea to fatal
colitis. Treatment with antibacterial agents alters the normal flora of the
colon leading to overgrowth of C. difficile.
C. difficile produces toxins A and B
which contribute to the development of CDAD. Hypertoxin producing strains of C.
difficile cause increased morbidity and mortality, as these infections can
be refractory to antimicrobial therapy and may require colectomy. CDAD must be
considered in all patients who present with diarrhea following antibiotic use.
Careful medical history is necessary since CDAD has been reported to occur over
two months after the administration of antibacterial agents.
If CDAD is suspected or
confirmed, ongoing antibiotic use not directed against C. difficile may
need to be discontinued. Appropriate fluid and electrolyte management, protein
supplementation, antibiotic treatment of C. difficile, and surgical evaluation
should be instituted as clinically indicated.
PRECAUTIONS
General
Prescribing Macrodantin in the
absence of a proven or strongly suspected bacterial infection or a prophylactic
indication is unlikely to provide benefit to the patient and increases the risk
of the development of drug-resistant bacteria.
Carcinogenesis, Mutagenesis,
Impairment of Fertility
Nitrofurantoin was not
carcinogenic when fed to female Holtzman rats for 44.5 weeks or to female
Sprague-Dawley rats for 75 weeks. Two chronic rodent bioassays utilizing male
and female Sprague-Dawley rats and two chronic bioassays in Swiss mice and in
BDF1 mice revealed no evidence of carcinogenicity.
Nitrofurantoin presented
evidence of carcinogenic activity in female B6C3F1 mice as shown by increased
incidences of tubular adenomas, benign mixed tumors, and granulosa cell tumors
of the ovary. In male F344/N rats, there were increased incidences of uncommon
kidney tubular cell neoplasms, osteosarcomas of the bone, and neoplasms of the
subcutaneous tissue. In one study involving subcutaneous administration of 75
mg/kg nitrofurantoin to pregnant female mice, lung papillary adenomas of
unknown significance were observed in the F1 generation.
Nitrofurantoin has been shown
to induce point mutations in certain strains of Salmonella typhimurium and
forward mutations in L5178Y mouse lymphoma cells. Nitrofurantoin induced
increased numbers of sister chromatid exchanges and chromosomal aberrations in
Chinese hamster ovary cells but not in human cells in culture. Results of the
sex-linked recessive lethal assay in Drosophila were negative after
administration of nitrofurantoin by feeding or by injection. Nitrofurantoin did
not induce heritable mutation in the rodent models examined.
The significance of the
carcinogenicity and mutagenicity findings relative to the therapeutic use of
nitrofurantoin in humans is unknown.
The administration of high
doses of nitrofurantoin to rats causes temporary spermatogenic arrest; this is
reversible on discontinuing the drug. Doses of 10 mg/kg/day or greater in
healthy human males may, in certain unpredictable instances, produce a slight
to moderate spermatogenic arrest with a decrease in sperm count.
Pregnancy
Teratogenic effects — Pregnancy Category B
Several reproduction studies
have been performed in rabbits and rats at doses up to six times the human dose
and have revealed no evidence of impaired fertility or harm to the fetus due to
nitrofurantoin. In a single published study conducted in mice at 68 times the
human dose (based on mg/kg administered to the dam), growth retardation and a
low incidence of minor and common malformations were observed. However, at 25
times the human dose, fetal malformations were not observed; the relevance of
these findings to humans is uncertain. There are, however, no adequate and
well-controlled studies in pregnant women. Because animal reproduction studies
are not always predictive of human response, this drug should be used during
pregnancy only if clearly needed.
Non-teratogenic effects
Nitrofurantoin has been shown
in one published transplacental carcinogenicity study to induce lung papillary
adenomas in the F1 generation mice at doses 19 times the human dose on a mg/kg
basis. The relationship of this finding to potential human carcinogenesis is
presently unknown. Because of the uncertainty regarding the human implications
of these animal data, this drug should be used during pregnancy only if
clearlyneeded.
Labor and Delivery
See CONTRAINDICATIONS.
Nursing Mothers
Nitrofurantoin has been
detected in human breast milk in trace amounts.
Because of the potential for
serious adverse reactions from nitrofurantoin in nursing infants under
one month of age, a decision should be made whether to discontinue nursing or
to discontinue the drug, taking into account the importance of the drug to the
mother (see CONTRAINDICATIONS).
Pediatric Use
Macrodantin is contraindicated in infants below the age
of one month (see CONTRAINDICATIONS).
Geriatric Use
Clinical studies of Macrodantin did not include
sufficient numbers of subjects aged 65 and over to determine whether they
respond differently from younger subjects. Other reported clinical experience
has not identified differences in responses between the elderly and younger
patients. Spontaneous reports suggest a higher proportion of pulmonary
reactions, including fatalities, in elderly patients; these differences appear
to be related to the higher proportion of elderly patients receiving long-term
nitrofurantoin therapy. As in younger patients, chronic pulmonary reactions
generally are observed in patients receiving therapy for six months or longer
(see WARNINGS). Spontaneous reports also suggest an increased proportion
of severe hepatic reactions, including fatalities, in elderly patients (see WARNINGS).
In general, the greater frequency of decreased hepatic,
renal, or cardiac function, and of concomitant disease or other drug therapy
should be considered when prescribing Macrodantin. This drug is known to be
substantially excreted by the kidney, and the risk of toxic reactions to this
drug may be greater in patients with impaired renal function. Anuria, oliguria,
or significant impairment of renal function (creatinine clearance under 60 mL
per minute or clinically significant elevated serum creatinine) are
contraindications (see CONTRAINDICATIONS). Because elderly patients are
more likely to have decreased renal function, care should be taken in dose
selection, and it may be useful to monitor renal function.
Overdose & Contraindications
OVERDOSE
Occasional incidents of acute overdosage of Macrodantin
have not resulted in any specific symptoms other than vomiting. Induction of
emesis is recommended. There is no specific antidote, but a high fluid intake
should be maintained to promote urinary excretion of the drug. It is
dialyzable.
CONTRAINDICATIONS
Anuria, oliguria, or
significant impairment of renal function (creatinine clearance under 60 mL per
minute or clinically significant elevated serum creatinine) are
contraindications. Treatment of this type of patient carries an increased risk
of toxicity because of impaired excretion of the drug.
Because of the possibility of
hemolytic anemia due to immature erythrocyte enzyme systems(glutathione
instability), the drug is contraindicated in pregnant patients at term (38-42
weeks’ gestation), during labor and delivery, or when the onset of labor is
imminent. For the same reason, the drug is contraindicated in neonates under
one month of age.
Macrodantin is contraindicated
in patients with a previous history of cholestatic jaundice/ hepatic
dysfunction associated with nitrofurantoin.
Macrodantin is also
contraindicated in those patients with known hypersensitivity to
nitrofurantoin.
CLINICAL PHARMACOLOGY
Macrodantin is a larger crystal
form of Furadantin® (nitrofurantoin). The absorption of Macrodantin is slower
and its excretion somewhat less when compared to Furadantin. Blood
concentrations at therapeutic dosage are usually low. It is highly soluble in
urine, to which it may impart a brown color.
Following a dose regimen of 100
mg q.i.d. for 7 days, average urinary drug recoveries (0-24 hours) on day 1 and
day 7 were 37.9% and 35.0%.
Unlike many drugs, the presence
of food or agents delaying gastric emptying can increase the bioavailability of
Macrodantin, presumably by allowing better dissolution in gastric juices.
Microbiology
Nitrofurantoin is a nitrofuran
antimicrobial agent with activity against certain Gram-positive and
Gram-negative bacteria.
Mechanism of Action
The mechanism of the antimicrobial
action of nitrofurantoin is unusual among antibacterials. Nitrofurantoin is
reduced by bacterial flavoproteins to reactive intermediates which inactivate
or alter bacterial ribosomal proteins and other acromolecules. As a result of
such inactivations, the vital biochemical processes of protein synthesis,
aerobic energy metabolism, DNA synthesis, RNA synthesis, and cell wall
synthesis are inhibited. Nitrofurantoin is bactericidal in urine at therapeutic
doses. The broad-based nature of this mode of action may explain the lack of
acquired bacterial resistance to nitrofurantoin, as the necessary multiple and
simultaneous mutations of the target macromolecules would likely be lethal to
the bacteria.
Interactions with Other
Antibiotics
Antagonism has been
demonstrated in vitro between nitrofurantoin and quinolone antimicrobials. The
clinical significance of this finding is unknown.
Development of Resistance
Development of resistance to
nitrofurantoin has not been a significant problem since its introduction in
1953. Cross-resistance with antibiotics and sulfonamides has not been observed,
and transferable resistance is, at most, a very rare phenomenon.
Nitrofurantoin has been shown
to be active against most strains of the following bacteria both in vitro and
in clinical infections [see INDICATIONS AND USAGE):
Aerobic and facultative
Gram-positive microorganisms
Staphylococcus aureus
Enterococci (e.g. Enterococcus faecalis)
Aerobic and facultative Gram-negative microorganisms
Escherichia coli
NOTE: While nitrofurantoin has excellent activity against Enterococcus
faecalis, the majority of Enterococcus faecium isolates are not
susceptible to nitrofurantoin.
At least 90 percent of the
following microorganisms exhibit an in vitro minimum inhibitory concentration
(MIC) less than or equal to the susceptible breakpoint for nitrofurantoin.
However, the efficacy of nitrofurantoin in treating clinical infections due to
these microorganisms has not been established in adequate and well-controlled
trials.
Aerobic and facultative
Gram-positive microorganisms
Coagulase-negative
staphylococci (including Staphylococcus epidermidis and Staphylococcus
saprophyticus)
Streptococcus agalactiae
Group D streptococci
Viridans group streptococci
Aerobic and facultative
Gram-negative microorganisms
Citrobacter amalonaticus
Citrobacter diversus
Citrobacter freundii
Klebsiella oxytoca
Klebsiella ozaenae
NOTE: Some strains of Enterobacter
species and Klebsiella species are resistant to nitrofurantoin.
Susceptibility Test Methods
When available, the clinical
microbiology laboratory should provide cumulative results of the in vitro
susceptibility test results for antimicrobial drugs used in resident hospitals
to the physician as periodic reports that describe the susceptibility profile
of nosocomial and community-acquired pathogens. These reports should aid the
physician in selecting the most effective antimicrobial.
Dilution techniques: Quantitative methods are
used to determine antimicrobial minimum inhibitory concentrations (MICs). These
MICs provide estimates of the susceptibility of bacteria to antimicrobial
compounds. The MICs should be determined using a standardized procedure.
Standardized procedures are based on a dilution method (broth or agar) (1) or
equivalent with standardized inoculum concentrations and standardized
concentrations of nitrofurantoin powder. The MIC values should be interpreted
according to the criteria provided in Table 1.
Diffusion technique: Quantitative methods that
require measurement of zone diameters also provide reproducible estimates of
the susceptibility of bacteria to antimicrobial compounds. One such
standardized procedure (2) requires the use of standardized inoculum
concentrations. This procedure uses paper disks impregnated with 300 Ilg of
nitrofurantoin to test the susceptibility of microorganisms to nitrofurantoin.
The disk diffusion interpretive criteria are provided in Table 1.
Table 1: Susceptibility
Interpretive Criteria for Nitrofurantoin
| Pathogen | Susceptibility Interpretive Criteria | |||||
| Minimum Inhibitory Concentrations (μg/mL) | Disk Diffusion (zone diameter in mm) | |||||
| S | I | R | S | I | R | |
| Enterobacteriaceae | δ32 | 64 | ε128 | ε17 | 15-16 | δ14 |
| Staphylococcus spp. | δ32 | 64 | ε128 | ε17 | 15-16 | δ14 |
| Enterococcus spp. | δ32 | 64 | ε128 | ε17 | 15-16 | δ14 |
A report of Susceptible indicates
that the pathogen is likely to be inhibited if the antimicrobial compound in
the urine reaches the concentrations usually achievable. A report of Intermediate
indicates that the result should be considered equivocal, and, if the microorganism
is not fully susceptible to alternative, clinically feasible drugs, the test
should be repeated. This category implies possible clinical applicability in
body sites where the drug is physiologicallyconcentrated or in situations where
a high dosage of drug can be used. This category also provides a buffer zone,
which prevents small, uncontrolled technical factors from causing major
discrepancies in interpretation. A report of Resistant indicates that the
pathogen is not likely to be inhibited if the antimicrobial compound in the
urine reaches the concentrations usually achievable; other therapy should be
selected.
Quality Control: Standardized
susceptibility test procedures require the use of quality control
microorganisms to control the technical aspects of the test procedures (3).
Standard nitrofurantoin powder should provide the following range of values
noted in Table 2.
Table 2: Acceptable Quality
Control Ranges for Nitrofurantoin
| QC Strain | Acceptable Quality Control Ranges | |
| Minimum Inhibitory Concentration (μg/mL) | Disk Diffusion (zone diameter in mm) | |
| Escherichia coli ATCC 25922 | 4 – 16 | 20 -25 |
| Enterococcus faecalis ATCC 29212 | 4 – 16 | NAa |
| Staphylococcus aureus ATCC 29213 | 8 – 32 | NAa |
| Staphylococcus aureus ATCC 25923 | NAa | 18-22 |
| aNot applicable |
PATIENT INFORMATION
Patients should be advised to
take Macrodantin with food to further enhance tolerance and improve drug
absorption. Patients should be instructed to complete the full course of
therapy; however, they should be advised to contact their physician if any
unusual symptoms occur during therapy.
Many patients who cannot
tolerate microcrystalline nitrofurantoin are able to take Macrodantin without
nausea.
Patients should be advised not
to use antacid preparations containing magnesium trisilicate while taking
Macrodantin.
Patients should be counseled
that antibacterial drugs including Macrodantin should only be used to treat
bacterial infections. They do not treat viral infections (e.g., the common
cold). When Macrodantin is prescribed to treat a bacterial infection, patients
should be told that although it is common to feel better early in the course of
therapy, the medication should be taken exactly as directed. Skipping doses or
not completing the full course of therapy may (1) decrease the effectiveness of
the immediate treatment and (2) increase the likelihood that bacteria will
develop resistance and will not be treatable by Macrodantin or other
antibacterial drugs in the future.
Diarrhea is a common problem
caused by antibiotics which usually ends when the antibiotic is discontinued.
Sometimes after starting treatment with antibiotics, patients can develop
watery and bloody stools (with or without stomach cramps and fever) even as
late as two or more months after having taken the last dose of the antibiotic.
If this occurs, patients should contact their physician as soon as possible.
From 
Health Solutions From Our Sponsors
Report Problems to the Food and Drug Administration
You are encouraged to report negative side effects of prescription drugs to the FDA. Visit the FDA MedWatch website or call 1-800-FDA-1088.