Фармакологическое действие
Фарицимаб представляет собой гуманизированное биспецифическое антитело, относящееся к классу иммуноглобулинов G1 (IgG1), которое действует посредством ингибирования двух различных путей, нейтрализуя как Ang-2, так и фактор роста эндотелия сосудов А (VEGF-A).
Ang-2 снижает стабильность сосудов, способствуя дестабилизации эндотелия, потере перицитов и патологическому ангиогенезу, и тем самым усиливая транссудацию и воспаление. Он также повышает чувствительность кровеносных сосудов к активности VEGF-A, что приводит к их дальнейшей дестабилизации. Ang-2 и VEGF-A отличаются синергизмом действия в отношении увеличения проницаемости сосудов и стимуляции неоваскуляризации.
Двойное ингибирование Ang-2 и VEGF-A фарицимабом снижает проницаемость сосудов и уменьшает воспаление, подавляет патологический ангиогенез и восстанавливает стабильность сосудов.
Фармакокинетика
Всасывание
Препарат Вабисмо® вводится путем внутриглазной инъекции для оказания местного воздействия на глаз. Клинических исследований других путей введения не проводили.
На основании анализа популяционной фармакокинетики (включая пациентов с нВМД и ДМО, N= 2246) Cmax свободного (несвязанного с VEGF-A и Ang-2) фарицимаба в плазме крови по оценкам достигается примерно через 2 дня после введения. У пациентов с нВМД и ДМО/ДР средняя (±СО) Cmax в плазме крови по оценкам составляет 0.23 (0.07) мкг/мл и 0.22 (0.07) мкг/мл соответственно.
Предполагается, что после повторных введений средние минимальные концентрации свободного фарицимаба в плазме крови составят 0.002-0.003 мкг/мл при введении 1 р/8 нед.
В диапазоне доз 0.5-6 мг фарицимаб демонстрировал пропорциональную дозе фармакокинетику (на основании Cmax и AUC). Накопления фарицимаба в стекловидном теле или в плазме крови после ежемесячного введения не наблюдалось.
Распределение
Максимальные концентрации свободного фарицимаба в плазме крови, по прогнозам, будут примерно в 600 и 6000 раз ниже, чем в водянистой влаге и стекловидной влаге соответственно, и ниже аффинности связывания c VEGF и Ang-2. Следовательно, системные фармакодинамические эффекты маловероятны, что дополнительно подтверждается отсутствием значительных изменений концентрации свободного VEGF и Ang-2 в плазме крови после лечения фарицимабом в клинических исследованиях.
Анализ популяционной фармакокинетики продемонстрировал влияние возраста и массы тела на фармакокинетику фарицимаба в глазу или системную фармакокинетику соответственно. Оба эффекта не считались клинически значимыми; коррекция дозы не требуется.
Метаболизм
Метаболизм фарицимаба напрямую не изучался, поскольку моноклональные антитела выводятся преимущественно за счет катаболизма.
Выведение
Расчетный средний кажущийся системный T1/2 фарицимаба после внутриглазного введения составляет 7.5 дней.
Особые группы пациентов
Лица пожилого возраста. В 4 клинических исследованиях III фазы 60% (1149/1929) пациентов, рандомизированных в группу лечения препаратом Вабисмо®, были в возрасте >65 лет. В данных исследованиях не наблюдалось значимых различий в эффективности или безопасности препарата Вабисмо® с увеличением возраста.
Почечная недостаточность. Формального фармакокинетического исследования с участием пациентов с почечной недостаточностью не проводили.
Печеночная недостаточность. Формального фармакокинетического исследования с участием пациентов с печеночной недостаточностью не проводили.
Раса. Системная фармакокинетика препарата Вабисмо® не зависит от расы.
Пол. Не было показано клинически значимого влияния пола на системную фармакокинетику препарата Вабисмо®.
Дети. Эффективность и безопасность препарата Вабисмо® у детей и подростков не установлены.
Показания препарата
Вабисмо®
- взрослым пациентам с 18 лет при неоваскулярной (влажной) форме возрастной макулярной дегенерации (нВМД) и диабетическом макулярном отеке (ДМО).
Режим дозирования
Указания по дозированию
нВМД
Рекомендуемый режим дозирования препарата Вабисмо® — 6 мг (0.05 мл раствора), вводимых путем интравитреальной инъекции каждые 4 недели. Указанная схема терапии предусмотрена для первых 4 доз препарата.
После 3 месяцев вводного периода терапии дальнейший режим применения препарата будет основываться на анатомических особенностях и характеристиках зрительных функций, определяющих течение заболевания. Оценка ответа на терапию рекомендована на 20-й неделе после первой инъекции с возможной повторной оценкой на 24-й неделе после первой инъекции, что позволяет индивидуализировать схему терапии в зависимости от наличия или отсутствия признаков активности заболевания.
При отсутствии прогрессирования заболевания рекомендуется проведение интравитреальных инъекций препарата Вабисмо® каждые 16 недель, а в случае появления признаков прогрессирования — каждые 8 или 12 недель. Контрольные временные точки для оценки состояния пациента определяются по усмотрению врача на основании имеющихся у пациента жалоб и его общего состояния, ежемесячные осмотры не предусмотрены.
ДМО
Рекомендуемый режим дозирования препарата Вабисмо® — 6 мг (0.05 мл раствора), вводимых путем интравитреальной инъекции каждые 4 недели. Указанная схема терапии предусмотрена для первых 4 доз препарата.
После вводного периода терапии схема лечения может быть индивидуализирована согласно подходу «лечить и увеличивать интервал» в соответствии с оценкой анатомических параметров течения заболевания и характеристик зрительных функций. Интервал между введениями препарата может изменяться с 4 до 16 недель с шагом изменения интервала 4 недели.
При изменении активности заболевания необходима переоценка частоты введения препарата, сокращение интервала возможно на 4 недели или 8 недель при необходимости. Контрольные временные точки для оценки состояния пациента определяются по усмотрению врача на основании имеющихся у пациента жалоб и его общего состояния, ежемесячные осмотры не предусмотрены.
Продолжительность лечения
Препарат Вабисмо® предназначен для долгосрочной терапии.
Задержка введения или пропуск дозы
При задержке введения или пропуске дозы пациент должен повторно посетить врача для осмотра на следующем возможном визите и продолжить терапию по усмотрению врача.
Если результаты оценки анатомических особенностей и характеристик зрительных функций, определяющих течение заболевания, показывают, что дальнейшее лечение пациента не приносит пользы, терапию препаратом Вабисмо® следует прекратить.
Особые группы пациентов
Специальной коррекции дозы в любой из изученных популяций пациентов (например, пациенты пожилого возраста, в зависимости от пола, расы) не требуется.
У пациентов с нарушением функции почек коррекции дозы не требуется.
У пациентов с нарушением функции печени коррекции дозы не требуется.
Эффективность и безопасность препарата Вабисмо® у детей и подростков младше 18 лет не установлены. Данные отсутствуют.
Указания по применению
Только для интравитреального введения.
Препарат Вабисмо® должен вводиться квалифицированным врачом, имеющим опыт проведения внутриглазных инъекций. Каждый флакон следует использовать только для введения в один глаз.
При подготовке препарата Вабисмо® к введению всегда необходимо соблюдать надлежащие правила асептики. Следует убедиться, что инъекция вводится сразу после приготовления дозы.
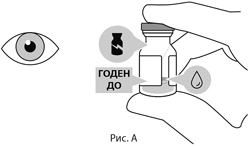
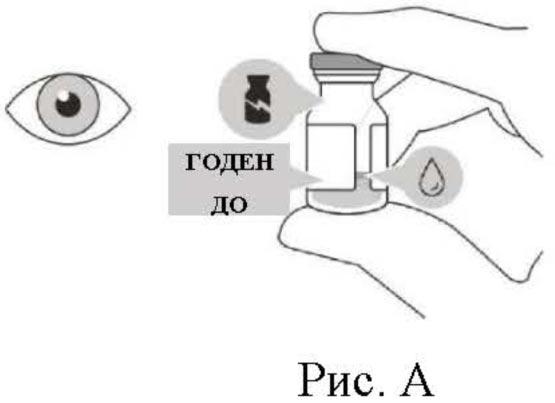
Флакон с препаратом следует визуально осмотреть перед введением. Препарат Вабисмо® представляет собой стерильную, не содержащую консервантов жидкость. Стерильность флакона не может быть гарантирована в случае, если упаковка и/или флакон повреждены, или срок годности истек. Не использовать флакон при повреждении упаковки. Не использовать флакон, если изменен цвет раствора, если раствор мутный или содержит нерастворенные частицы (см. рис. А).
Инструкция по приготовлению препарата перед применением
1. Подготовка необходимых материалов:
- один флакон препарата Вабисмо®;
- одна стерильная игла для переноса препарата с тупым наконечником и фильтром (размер пор 5 мкм), калибра 18×1.5 дюйма, 1.2 мм×40 мм;
- один стерильный шприц объемом 1 мл с люэровским наконечником, с отметкой дозы на уровне 0.05 мл;
- одна стерильная инъекционная игла, калибра 30×0.5 дюйма.
!Внимание: рекомендуется использовать инъекционную иглу 30 калибра во избежание увеличения силы введения, которое может возникнуть при использовании игл меньшего диаметра.
- спиртовая салфетка.
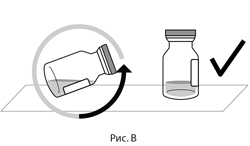
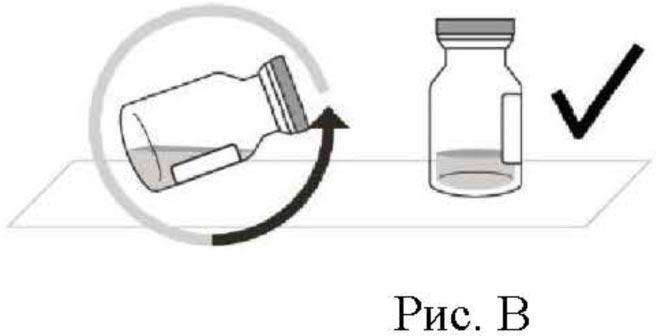
2. После извлечения из упаковки поместить флакон в прямом вертикальном положении на плоскую поверхность (примерно на 1 минуту), чтобы весь препарат осел на дне флакона (см. рис. В).
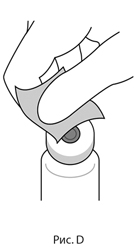
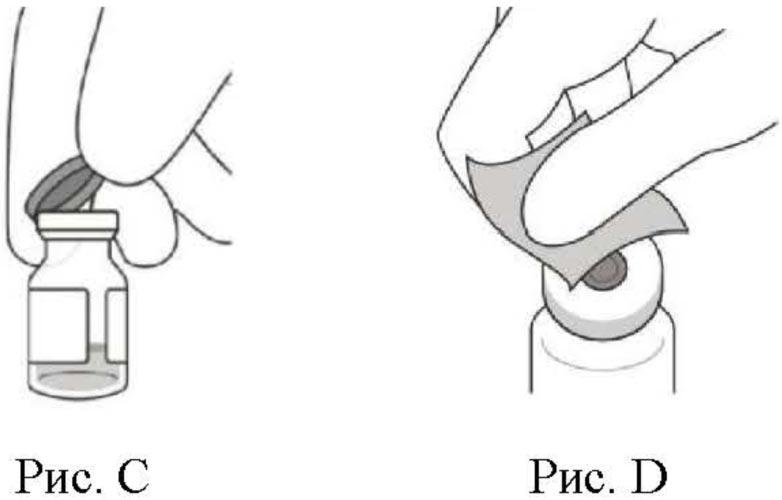
3. Удалить съемный обжимной колпачок с флакона (см. рис. С) и протереть пробку спиртовой салфеткой (см. рис. D).
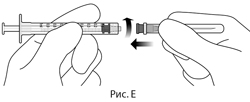
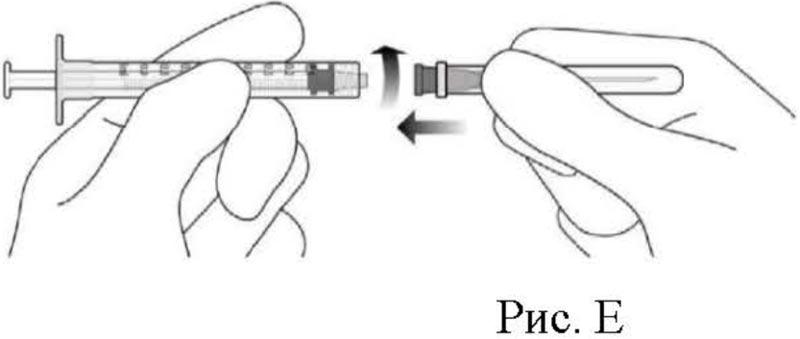
4. Соблюдая правила асептики, надежно присоединить иглу для переноса препарата, калибра 18×1.5 дюйма, к шприцу объемом 1 мл с люэровским наконечником (см. рис. Е).
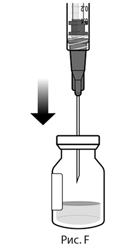
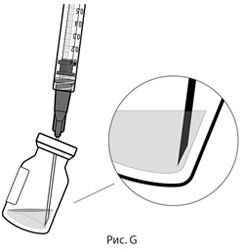
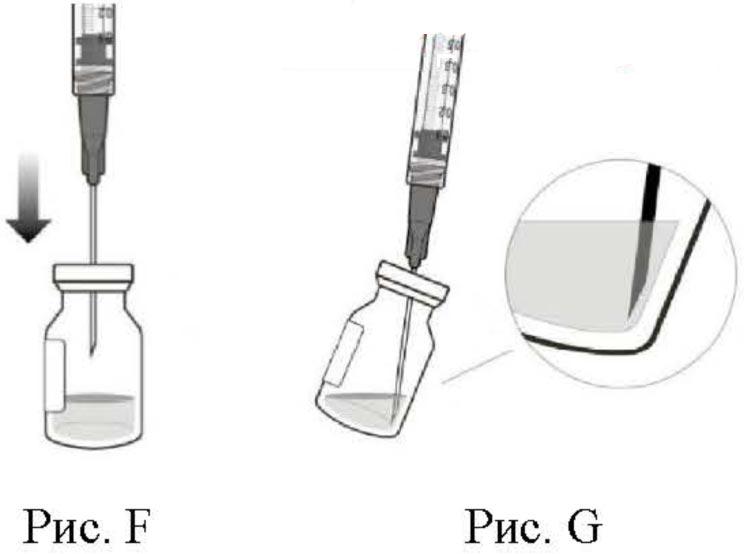
5. Соблюдая правила асептики, вставить иглу для переноса препарата с фильтром в центр пробки флакона (см. рис. F), нажать до упора, затем слегка наклонить флакон так, чтобы игла коснулась нижнего края флакона (см. рис. G).
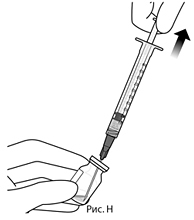
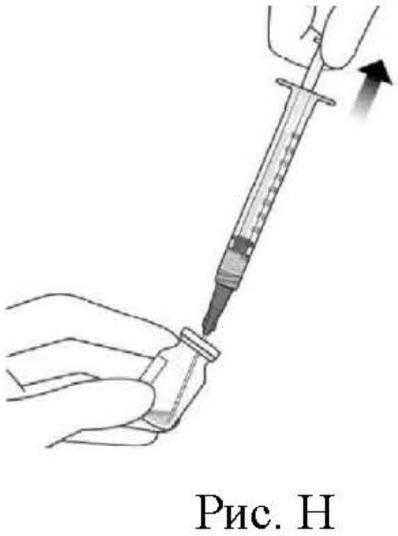
6. Удерживая флакон в слегка наклоненном положении, медленно удалить весь препарат из флакона (см. рис. Н). Срез иглы для переноса препарата с фильтром удерживать погруженным в препарат во избежание попадания воздуха.
7. Следует убедиться, что шток поршня в достаточной степени отведен назад при извлечении содержимого флакона, чтобы впоследствии полностью опустошить иглу для переноса препарата с фильтром (см. рис. Н).
8. Отсоединить иглу для переноса препарата с фильтром от шприца и утилизировать ее в установленном порядке.
Внимание: не следует использовать иглу для переноса препарата с фильтром для внутриглазного введения.
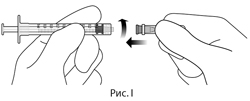
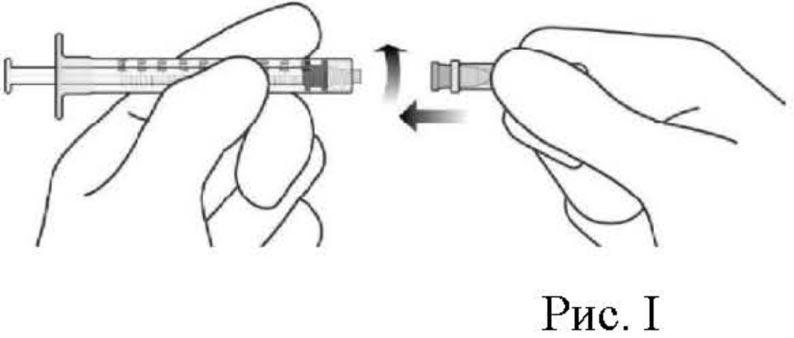
9. Соблюдая правила асептики, надежно присоединить иглу для инъекции, калибра 30×0.5 дюйма, к шприцу с люэровским наконечником (см. рис. I).
10. Аккуратно снять пластиковый колпачок с иглы, потянув за него.
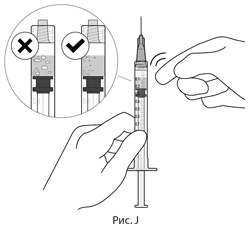
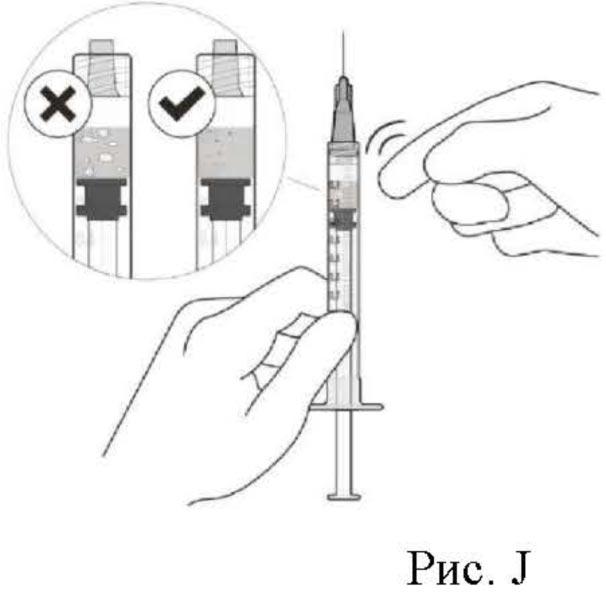
11. Для проверки наличия пузырьков воздуха держать шприц иглой вверх. При наличии пузырьков воздуха следует аккуратно постучать пальцем по шприцу, пока пузырьки не всплывут наверх (см. рис. J).
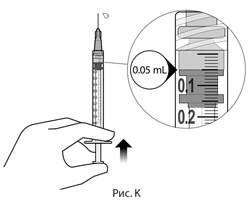
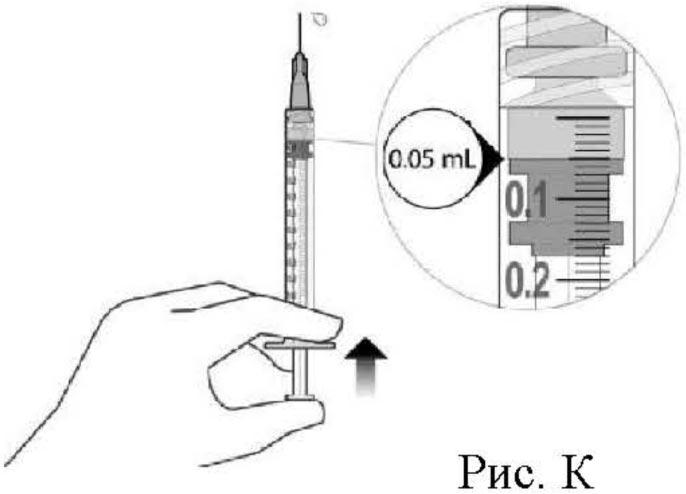
12. Осторожно выпустить воздух из шприца с иглой, медленно отпуская шток, чтобы привести верхнюю часть каучуковой пробки к отметке дозы на уровне 0.05 мл. Шприц готов к инъекции (см. рис. К). Следует убедиться, что введение осуществляется сразу после приготовления дозы.
13. Медленно вводить препарат, пока каучуковая пробка не достигнет наконечника шприца, для доставки объема 0.05 мл. Подтвердить доставку полной дозы посредством проверки того, что каучуковая пробка достигла наконечника цилиндра шприца.
Инструкция по утилизации неиспользованного препарата или с истекшим сроком годности
Попадание лекарственных препаратов в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами.
Необходимо строго соблюдать следующие рекомендации по использованию и утилизации шприцев и расходных материалов:
- иглы и шприцы никогда нельзя использовать повторно;
- использованные иглы и шприцы помещают в защищенный от проколов контейнер (емкость).
Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Побочное действие
Резюме профиля безопасности
В клинических исследованиях III фазы наиболее часто встречающимися реакциями были катаракта (10.7%), субконъюнктивальное кровоизлияние (7.3%), плавающие помутнения стекловидного тела (3.6%), повышение ВГД (3.6%), разрыв пигментного эпителия сетчатки (только при нВМД) (2.9%), боль в глазу (2.5%).
Наиболее серьезными нежелательными реакциями были катаракта (0.9%), увеит (0.5%), витреит (0.3%), эндофтальмит (0.3%), разрыв сетчатки (0.2%), регматогенная отслойка сетчатки (<0.1%).
Нежелательные реакции (НР), отмечавшиеся в ходе клинических исследований, сгруппированы в соответствии с системно-органной классификацией MedDRA. Для описания частоты нежелательных реакций используются следующие категории: очень часто (>1/10), часто (>1/100, но <1/10), нечасто (>1/1000, но <1/100), редко (>1/10000, но <1/1000).
Таблица 1: Резюме НР у пациентов, получавших препарат Вабисмо® в клинических исследованиях III фазы
Описание отдельных нежелательных реакций
После внутриглазного введения ингибиторов VEGF существует теоретический риск развития явлений артериальной тромбоэмболии, включая инсульт и инфаркт миокарда. В клинических исследованиях препарата Вабисмо® у пациентов с нВМД и ДМО наблюдалась низкая частота явлений артериальной тромбоэмболии.
Иммуногенность
Отмечена потенциальная возможность развития иммунного ответа на введение препарата Вабисмо®. После введения препарата в период до 48 недель при нВМД и 100 недель при ДМО, антитела острой фазы к фарицимабу были обнаружены у 10% пациентов. Клиническое значение наличия указанных антител и их влияние на безопасность препарата в настоящее время не ясны. Среди пациентов, у которых были обнаружены антитела к фарицимабу, более часто встречались случаи внутриглазного воспаления, хотя общая частота встречаемости положительного анализа на антитела к фарицимабу и внутриглазного воспаления во всей исследуемой популяции не превышала 1%. Не выявлено взаимосвязи между эффективностью препарата, а также его фармакокинетикой и наличием антител к фарицимабу.
Разрыв пигментного эпителия сетчатки
Разрыв пигментного эпителия сетчатки — это осложнение отслойки пигментного эпителия сетчатки у пациентов с нВМД, и представляет собой одно из наиболее распространенных осложнений терапии ингибиторами VEGF, в том числе фарицимабом. Указанное явление встречалось более часто в ходе исследований во вводном периоде терапии у пациентов, получавших фарицимаб (2.9%) по сравнению с афлиберцептом, его выраженность варьировала от легкой до средней, не отмечалось влияния на остроту зрения.
Пациент должен быть проинформирован о необходимости сообщать врачу о любых выраженных или не указанных в данной инструкции побочных реакциях. Медицинским работникам рекомендуется сообщать о любых подозреваемых НР препарата через национальные системы сообщения о нежелательных реакциях государств-членов Евразийского экономического союза.
Противопоказания к применению
- гиперчувствительность к фарицимабу или к любому из вспомогательных веществ;
- инфекция глаз или окружающих тканей;
- внутриглазное воспаление в активной форме;
- возраст до 18 лет (эффективность и безопасность применения препарата у данной категории больных не изучалась).
Применение при беременности и кормлении грудью
В случае предполагаемой, планируемой или установленной беременности необходимо проконсультироваться с врачом.
Беременность
Информация о применении фарицимаба беременными женщинами ограничена или отсутствует. Системная экспозиция препарата Вабисмо® после интравитреального введения чрезвычайно мала.
В ходе исследования влияния препарата на течение беременности, проведенного на беременных яванских макаках, не получено данных о прямом или косвенном влиянии препарата на эмбриофетальное развитие, а также на репродуктивную систему в целом. В качестве меры предосторожности не рекомендуется применение препарата Вабисмо® беременными женщинами, за исключением случаев, когда польза применения препарата для матери превышает риск для плода и ребенка.
Период грудного вскармливания
Неизвестно, выводится ли препарат Вабисмо® или его метаболиты с грудным молоком у человека. Исследований по оценке влияния препарата Вабисмо® на выработку грудного молока или по определению его наличия в грудном молоке не проводили. Поскольку многие лекарственные препараты выделяются с грудным молоком, следует соблюдать осторожность при назначении препарата Вабисмо® кормящей женщине. Необходимо принять решение либо о прекращении грудного вскармливания, либо об отмене терапии препарата Вабисмо®, принимая во внимание пользу грудного вскармливания для развития и роста ребенка и пользу терапии для женщины, а также возможные неблагоприятные эффекты препарата Вабисмо® у ребенка.
Контрацепция
Женщины с детородным потенциалом должны использовать надежные методы контрацепции во время лечения препаратом Вабисмо® и в течение по меньшей мере 3 месяцев после введения последней дозы препарата Вабисмо®.
Фертильность
Исследования репродуктивной функции или фертильности не проводились. В 6-месячном исследовании препарата Вабисмо® у яванских макак влияния на репродуктивные органы или фертильность не наблюдалось.
Применение у детей
Противопоказано применение препарат в детском возрасте до 18 лет (эффективность и безопасность применения препарата у данной категории больных не изучалась).
Особые указания
Реакции, связанные с внутриглазным введением
Внутриглазное введение, в т.ч. препарата Вабисмо®, сопровождалось эндофтальмитом, внутриглазным воспалением, регматогенной отслойкой сетчатки и разрывом сетчатки. При введении препарата Вабисмо® всегда необходимо соблюдать надлежащие правила асептики. Пациенты должны быть проинструктированы о необходимости немедленно сообщать о любых симптомах, таких как боль, потеря зрения, светобоязнь, затуманивание зрения, мушки перед глазами или покраснение, указывающих на эндофтальмит, или любое из вышеупомянутых явлений, для обеспечения быстрого и надлежащего лечения.
В течение 60 минут после внутриглазного введения, в т.ч. препарата Вабисмо®, наблюдалось временное повышение ВГД. Преходящее повышение ВГД более 21 мм. рт.ст. в ряде случаев сохранялось на протяжении 2 и более последовательных визитов. В отношении пациентов с плохо контролируемой глаукомой следует соблюдать особые меры предосторожности (не следует вводить препарат Вабисмо®, если ВГД >30 мм рт.ст.). Во всех случаях необходимо контролировать ВГД и перфузию головки зрительного нерва и при необходимости назначать лечение. В случае необходимости должно быть доступно стерильное оборудование для проведения парацентеза.
Системные эффекты
После интравитреального введения отмечались системные нежелательные явления, в т.ч. тромбозы артерий. Существует теоретический риск того, что они могут быть связаны с ингибированием VEGF.
Иммуногенность
Возможно развитие иммунной реакции на препарат Вабисмо® в связи с его принадлежностью к лекарственным препаратам белковой природы. Пациенты должны быть проинструктированы о необходимости сообщать о любых признаках или симптомах внутриглазного воспаления, таких как потеря зрения, боль в глазу, повышенная чувствительность к свету, мушки перед глазами или усиление покраснения глаз, что может быть клиническим признаком гиперчувствительности.
Билатеральная терапия
Безопасность и эффективность препарата Вабисмо® при введении одновременно в оба глаза не изучались.
Одновременное применение с другими анти-VEGF препаратами
Данные об одновременном применении препарата Вабисмо® с другими анти-VEGF препаратами на одном и том же глазу отсутствуют.
Приостановка лечения
Следует приостановить лечение у пациентов:
- с регматогенной отслойкой сетчатки, макулярным разрывом сетчатки 3-й или 4-й стадии, разрывом сетчатки; лечение не следует возобновлять до полного восстановления;
- со снижением максимально корригируемой остроты зрения (МКОЗ) на >30 букв, связанным с лечением, по сравнению с последней оценкой остроты зрения; терапию не следует возобновлять ранее следующего запланированного введения;
- с проведенным или запланированным внутриглазным хирургическим вмешательством в течение предыдущих или последующих 28 дней; лечение не следует возобновлять ранее следующего запланированного введения.
Разрыв пигментного эпителия сетчатки
Факторы риска, связанные с развитием разрыва пигментного эпителия сетчатки после терапии нВМД анти-VEGF препаратами, включают обширную и/или расположенную в верхних отделах сетчатки отслойку пигментного эпителия. Во время начала терапии препаратом Вабисмо® следует соблюдать осторожность у пациентов с факторами риска разрыва пигментного эпителия сетчатки.
Популяции пациентов с ограниченными данными
Опыт лечения пациентов с ДМО с показателем гликированного гемоглобина (HbA1c) >10%, пациентов с высоким риском пролиферативной диабетической ретинопатии (ДР) или пациентов с нВМД и ДМО с системными инфекциями в активной форме ограничен. Опыт лечения препаратом Вабисмо® пациентов с сахарным диабетом и неконтролируемой артериальной гипертензией отсутствует. При лечении таких пациентов врачу следует учитывать отсутствие соответствующей информации.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Вабисмо® может оказывать слабое влияние на способность управлять транспортными средствами и работать с механизмами из-за возможных временных нарушений зрения после внутриглазного введения и сопутствующего обследования глаз. Пациентам не следует управлять транспортными средствами и работать с механизмами до тех пор, пока зрительная функция в достаточной степени не восстановится.
Передозировка
Дозы, превышающие рекомендованные, не изучались. Передозировка при введении объема, превышающего рекомендуемый, может повысить ВГД.
Лечение: при передозировке следует контролировать ВГД и, если врач сочтет это необходимым, начать соответствующее лечение.
Лекарственное взаимодействие
Исследования взаимодействия не проводились. В связи с отсутствием исследований совместимости, данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
Пациенту следует сообщить врачу обо всех лекарственных препаратах, которые он применяет или планирует применять.
Условия хранения препарата Вабисмо®
Препарат следует хранить в оригинальной упаковке (пачка картонная), в недоступном для детей месте при температуре от 2° до 8°С. Не замораживать. Не встряхивать.
Срок годности препарата Вабисмо®
Срок годности — 2 года 6 мес. Препарат не следует применять после истечения срока годности.
Перед применением невскрытый флакон препарата может оставаться при комнатной температуре от 20°-25°C до 24 ч.
Условия реализации
Препарат отпускают по рецепту.

18.09.2023
Описание препарата Вабисмо® (раствор для внутриглазного введения, 120 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2023 году
Дата согласования: 18.09.2023
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для внутриглазного введения | 1/0,05 мл |
| действующее вещество: | |
| фарицимаб | 120/6 мг |
| вспомогательные вещества (полный перечень): L-гистидин; уксусная кислота 30%; L-метионин; натрия хлорид; D-сахароза; полисорбат 20; вода для инъекций |
Описание лекарственной формы
Раствор для внутриглазного введения: жидкость от прозрачной до опалесцирующей, от бесцветной до коричневато-желтого цвета.
Фармакологическое действие
Фармакологическое действие
—
ингибирующее ангиогенез.
Фармакодинамика
Механизм действия
Фарицимаб представляет собой гуманизированное биспецифическое антитело, относящееся к классу иммуноглобулинов G1 (IgG1), которое действует посредством ингибирования двух различных путей, нейтрализуя как Ang-2, так и фактор роста эндотелия сосудов А (VEGF-A). Ang-2 снижает стабильность сосудов, способствуя дестабилизации эндотелия, потере перицитов и патологическому ангиогенезу, и тем самым усиливая транссудацию и воспаление. Он также повышает чувствительность кровеносных сосудов к активности VEGF-A, что приводит к их дальнейшей дестабилизации. Ang-2 и VEGF-A отличаются синергизмом действия в отношении увеличения проницаемости сосудов и стимуляции неоваскуляризации. Двойное ингибирование Ang-2 и VEGF-A фарицимабом снижает проницаемость сосудов и уменьшает воспаление, подавляет патологический ангиогенез и восстанавливает стабильность сосудов.
Фармакодинамические эффекты
В четырех клинических исследованиях III фазы с 7-го дня лечения наблюдалось снижение средних концентраций свободного Ang-2 и свободного VEGF-A в глазу по сравнению с исходным уровнем.
Неоваскулярная форма возрастной макулярной дегенерации (нВМД). В исследованиях III фазы у пациентов с нВМД (исследования TENAYA, LUCERNE) для принятия решений о лечении использовались объективные, выбранные до начала лечения критерии эффективности терапии, основанные на данных оценки зрительных функций и анатомических параметров, а также клиническая оценка лечащего врача во временных точках оценки активности заболевания (нед. 20-я и 24-я).
При применении препарата Вабисмо® в период от исходного уровня до 48-й нед наблюдалось снижение средней толщины центрального подполя (CST), которое было сопоставимо с таковым при применении афлиберцепта. Среднее снижение CST от исходного уровня до визитов в первичной конечной точке (в среднем на нед 40–48-й) составляло -137 и -137 мкм при применении препарата Вабисмо®, вводимого каждые ≤16 недель (до 1 р/16 нед), по сравнению с -129 и -131 мкм при применении афлиберцепта в исследованиях TENAYA и LUCERNE соответственно. Среднее снижение CST сохранялось в течение 2-го года лечения.
В исследованиях TENAYA и LUCERNE на 48-й нед уменьшение количества интраретинальной жидкости (ИРЖ), субретинальной жидкости (СРЖ) и отслоения пигментного эпителия (ОПЭ) при применении препарата Вабисмо® и афлиберцепта были сопоставимыми и сохранялись на протяжении 2-го года лечения (104–108-я нед).
На 48-й нед изменение общей площади хориоидальной неоваскуляризации (CNV) и уменьшение площади CNV от исходного уровня были также сопоставимым в группах лечения препаратом Вабисмо® и группой афлиберцепта, в исследованиях TENAYA и LUCERNE соответственно.
Диабетический макулярный отек (ДМО). В исследованиях III фазы у пациентов с ДМО (YOSEMITE и RHINE) анатомические параметры, связанные с макулярным отеком, являлись частью оценки активности заболевания, определяющей принятие решения о лечении. Среднее снижение CST от исходного уровня на визитах первичной конечной точки (в среднем на неделях 48–56-й) было численно больше у пациентов, получавших лечение препаратом Вабисмо® по сравнению с афлиберцептом, и составило 207 и 197 мкм у пациентов, получавших препарат Вабисмо® 1 р/8 нед и корректируемую дозу препарата Вабисмо® до 1 р/16 нед, по сравнению с 170 мкм у пациентов в группе афлиберцепта 1 р/8 нед в исследовании YOSEMITE; в исследовании RHINE результаты составляли 196, 188 и 170 мкм соответственно. Последовательные снижения CST наблюдались во время всего лечения. В обоих исследованиях отсутствие интраретинальной жидкости (ИРЖ) и ДМО (определяемого как достижение CST менее 325 мкм) было достигнуто у большей доли пациентов в обеих группах препарата Вабисмо® по сравнению с группами афлиберцепта.
Клиническая эффективность и безопасность
Лечение нВМД. Безопасность и эффективность препарата Вабисмо® у пациентов с нВМД оценивали в двух рандомизированных, многоцентровых 2-летних исследованиях не меньшей эффективности с двойной маскировкой и с активным препаратом сравнения — TENAYA и LUCERNE. В общей сложности в эти исследования было включено 1329 пациентов, из них 1135 (85%) пациентов завершили исследования на 112-й нед. В общей сложности 1326 пациентов получили по крайней мере одну дозу препарата (664 пациента получили препарат Вабисмо®). Возраст пациентов находился в диапазоне от 50 до 99 лет, в среднем — 75.9 года. В обоих исследованиях пациенты были рандомизированы в соотношении 1:1 в одну из двух групп лечения:
— препарат Вабисмо®, 6 мг, до 1 р/16 нед, после введения первых четырех ежемесячных доз;
— афлиберцепт, 2 мг, 1 р/8 нед после введения первых трех ежемесячных доз.
После введения первых четырех ежемесячных доз (недели 0-я, 4-я, 8-я и 12-я) пациенты, рандомизированные в группу препарата Вабисмо®, получали дозу 1 р/16 нед, каждые 12 нед (1 р/12 нед) или 1 р/8 нед на основании оценки активности заболевания на 20-й и 24-й нед с использованием объективных, выбранных до начала лечения критериев эффективности терапии, основанных на данных оценки зрительных функций и анатомических параметров, а также клинической оценки лечащего врача. Эти фиксированные интервалы введения сохранялись у пациентов до 60-й нед без дополнительной терапии. С 60-й нед пациенты в группе препарата Вабисмо® перешли на корректируемую дозу препарата, когда интервал введения может быть увеличен с шагом 4 нед (до 1 р/16 нед) или уменьшен с шагом 8 нед (до 1 р/8 нед) на основе выбранных до начала лечения критериев эффективности терапии, основанных на данных оценки зрительных функций и анатомических параметров.
У пациентов, получавших афлиберцепт, сохранялся интервал введения 1 р/8 нед в течение всего периода исследования. Продолжительность обоих исследований составила 112 нед.
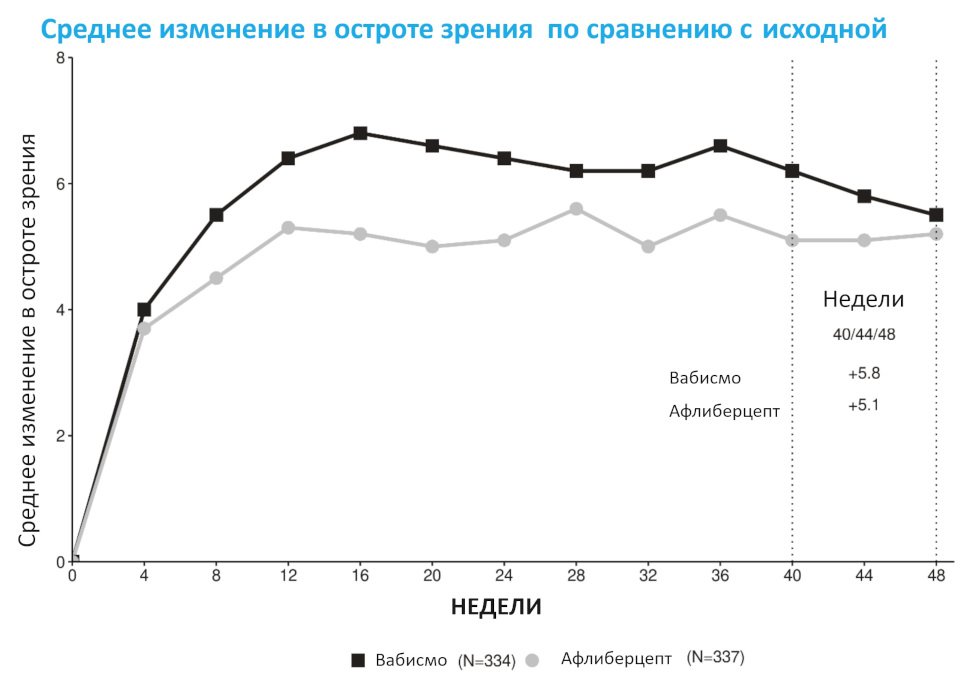
Первичной конечной точкой эффективности было изменение максимальной корригированной остроты зрения (МКОЗ) по сравнению с исходным уровнем на основании среднего значения на 40-й, 44-й и 48-й нед, измеренного с помощью схемы исследования раннего лечения диабетической ретинопатии (ETDRS). В обоих исследованиях в течение 1-го года лечения у пациентов, получавших препарат Вабисмо® до 1 р/16 нед, отмечалось сопоставимое среднее изменение МКОЗ по сравнению с исходным уровнем, как и у пациентов, получавших афлиберцепт 1 р/8 нед. Значительное улучшение зрения по сравнению с исходным уровнем наблюдалось на 112-й нед в обеих группах лечения.
Подробные результаты обоих исследований представлены в таблице 1, на Рис. 1 и Рис. 2 ниже.
Доля пациентов при каждом из разных интервалов между дозами на 48-й нед в исследованиях TENAYA и LUCERNE соответственно составляла:
— 1 р/16 нед: 46%, 45%;
— 1 р/12 нед: 34% 33%;
— 1 р/8 нед: 20% 22%.
Доля пациентов при каждом из разных интервалов между дозами на 112-й нед в исследованиях TENAYA и LUCERNE соответственно составляла:
— 1 р/16 нед: 59% 67%;
— 1 р/12 нед: 15% 14%;
— 1 р/8 нед: 26% 19%.
Таблица 1
Показатели эффективности на визитах первичных конечных точек 1-го годаа и 2-го годаb лечения в исследованиях TENAYA и LUCERNE
| Показатель эффективности | TENAYA | LUCERNE | ||||||
| 1-й год | 2-й год | 1-й год | 2-й год | |||||
| Вабисмо® до 1р/16 нед N=334 |
Афлиберцепт 1р/8 нед N=337 |
Вабисмо® до 1р/16 нед N=334 |
Афлиберцепт 1р/8 нед N=337 |
Вабисмо® до 1р/16 нед N=331 |
Афлиберцепт 1р/8 нед N=327 |
Вабисмо® до 1р/16 нед N=331 |
Афлиберцепт 1р/8 нед N=327 |
|
| Среднее отклонение от исходных значений МКОЗ, измеренное с помощью ETDRS (95%ДИ) | 5,8 (4,6;7,1) |
5,1 (3,9;6,4) |
3,7 (2,1;5,4) |
3,3 (1,7;4,9) |
6,6 (5,3;7,8) |
6,6 (5,3;7,8) |
5,0 (3,4;6;6) |
5,2 (3,6;6,8) |
| Разница в среднем LS (95%ДИ) | 0,7 (−1,1; 2,5) |
0,4 (−1,9; 2,8) |
0,0 (−1,7; 1,8) |
−0,2 (−2,4;2,1) |
||||
| Доля пациентов с увеличением на ≥15 букв от исходного уровня (взвешенная доля по КМХ (95%ДИ) | 20,0% (15,6; 24,4%) |
15,7% (11,9; 19,6%) |
22,5% (17,8; 27,2%) |
16,9% (12,7; 21,1%) |
20,2% (15,9; 24,6%) |
22,2% (17.7; 26,8%) |
22,4% (17.8; 27,1%) |
21,3% (16,8; 25,9%) |
| Разница взвешенного процента по КМХ (95%ДИ) | 4,3% (−1,6; 10,1%) |
5,6% (−0,7; 11,9%) |
−2,0% (−8,3; 4,3%) |
−1,1% (−5,4; 7,0%) |
||||
| Доля пациентов, избежавших снижения на ≥15 букв по сравнению с исходным уровнем (взвешенная доля по КМХ (95%ДИ) | 95,4% (93,0; 97,7%) |
94,1% (91,5; 96,7%) |
92,1% (89,1; 95,1%) |
88,0% (85,1; 92,2%) |
95,8% (93,6; 98,0%) |
97,3% (95,5; 99,1%) |
92,9% (90,1; 95,8%) |
93,2% (90,2; 96,2%) |
| Разница взвешенного процента по КМХ (95%ДИ) | 1,3% (−2,2; 4,8%) |
3,4% (−1,2; 8,1%) |
−1,5% (−4,4; 1,3%) |
−0,2% (−4,4; 3,9%) |
a Среднее значение на 40-й, 44-й и 48-й нед.
b Среднее значение на 104-й, 108-й и 112-й нед.
МКОЗ — максимальная корригированная острота зрения.
ETDRS — исследование раннего лечения диабетической ретинопатии.
ДИ — доверительный интервал.
LS — метод наименьших квадратов.
КМХ — метод Кохрана-Мантеля-Хензеля; статистический критерий, который позволяет провести оценку связи с бинарным показателем и используется для оценки категориальных переменных.
Рисунок 1. Среднее отклонение остроты зрения от исходных значений до 112-й нед в исследовании TENAYA
Рисунок 2. Среднее отклонение остроты зрения от исходных значений до 112-й нед в исследовании LUCERNE
В обоих исследованиях TENAYA и LUCERNE улучшения МКОЗ и CST на 60-й нед по сравнению с исходным уровнем были сопоставимы в двух группах лечения и соответствовали таковым на 48-й нед.
На 60-й нед 46% пациентов в исследованиях TENAYA и LUCERNE получали препарат Вабисмо® 1 р/16 нед. Из них у 69% пациентов в обоих исследованиях сохранялся интервал введения 1 р/16 нед до 112-й нед без уменьшения интервала.
На 60-й нед 80 и 78% пациентов в исследованиях TENAYA и LUCERNE, соответственно, получали препарат Вабисмо® с интервалом введения ≥1 р/12 нед (1 р/16 нед или 1 р/12 нед). Из них у 67 и 75% пациентов, соответственно, сохранялся интервал введения ≥1 р/12 нед до 112-й нед без уменьшения интервала <1 р/12 нед.
На 60-й нед 33% пациентов в исследованиях TENAYA и LUCERNE получали препарат Вабисмо® 1 р/12 нед. Из них у 3.2 и 0% пациентов в исследованиях TENAYA и LUCERNE, соответственно, сохранялся интервал введения 1 р/12 нед до 112-й нед.
На 60-й неделе 20 и 22% пациентов в исследованиях TENAYA и LUCERNE, соответственно, получали препарат Вабисмо® с интервалом введения 1 р/8 нед. Из них у 34 и 30% пациентов в исследованиях TENAYA и LUCERNE, соответственно, сохранялся интервал введения 1 р/8 нед до 112-й нед.
Результаты оценки эффективности во всех оцениваемых подгруппах (например, в зависимости от возраста, пола, расы, исходной остроты зрения, типа поражения, размера поражения) в каждом исследовании и в объединенном анализе соответствовали результатам, полученным в общей популяции.
В обоих исследованиях при применении препарата Вабисмо® до 1 р/16 нед были продемонстрированы клинически значимые улучшения в предварительно определенной конечной точке эффективности — среднему изменению по сравнению с исходным уровнем до 48-й нед по 25-балльной комплексной шкале Опросника оценки состояния зрения Национального института офтальмологии (NEI VFQ), что было сопоставимо с группой афлиберцепта 1 р/8 нед. Пациенты в группах препарата Вабисмо® в исследованиях TENAYA и LUCERNE на 48-й нед достигли улучшения по сравнению с исходным уровнем на ≥4 балла по 25-балльной комплексной шкале NEI VFQ. Эти результаты сохранялись на 112-й нед.
Лечение ДМО. Безопасность и эффективность препарата Вабисмо® у пациентов с ДМО оценивали в двух рандомизированных, многоцентровых, 2-летних исследованиях не меньшей эффективности с двойной маскировкой и активным препаратом сравнения (YOSEMITE и RHINE). В общей сложности в этих двух исследованиях участвовал 1891 пациент, из них 1622 пациента (86%) завершили участие в исследовании до 100-й нед. В общей сложности 1887 пациентов получали по крайней мере одну дозу до 56-й нед (1262 пациента в группе препарата Вабисмо®). Возраст пациентов находился в диапазоне от 24 до 91 года, в среднем — 62,2 года. Общая популяция включала как пациентов, ранее не получавших лечения антителами к VEGF (78%), так и пациентов, которые до участия в исследовании получали терапию ингибитором VEGF (22%). В обоих исследованиях пациенты были рандомизированы в соотношении 1:1:1 в одну из трех групп лечения:
— препарат Вабисмо®, 6 мг, 1 р/8 нед после введения первых 6 ежемесячных доз;
— препарат Вабисмо®, 6 мг, до 1 р/16 нед, корректируемая доза, вводимая с интервалами в 4, 8, 12 или 16 нед после введения первых 4 ежемесячных доз;
— афлиберцепт, 2 мг, 1 р/8 нед после введения первых 5 ежемесячных доз.
В группе с корректируемой дозой до 1 р/16 нед дозировка соответствовала стандартному подходу «лечить и увеличивать интервал». Интервал введения может быть увеличен с шагом 4 нед или уменьшен с шагом 4 или 8 нед на основе выбранных до начала лечения критериев эффективности терапии, основанных на данных оценки зрительных функций и анатомических параметров.
В обоих исследованиях была продемонстрирована эффективность в отношении первичной конечной точки, определяемой как изменение МКОЗ по сравнению с исходным уровнем через 1 год (среднее значение на 48-й, 52-й и 56-й нед), измеренное с помощью схемы ETDRS. В обоих исследованиях через 1 год лечения у пациентов, получавших препарат Вабисмо® до 1 р/16 нед, отмечалось сопоставимое среднее изменение МКОЗ по сравнению с исходным уровнем, как и у пациентов, получавших афлиберцепт 1 р/8 нед; эти зрительные улучшения сохранялись в течение 2-го года лечения. Подробные результаты обоих исследований представлены в таблице 2, на рисунках 3 и 4 далее.
После введения первых четырех ежемесячных доз пациенты, рандомизированные в группу с корректируемой дозой препарата Вабисмо до 1 р/16 нед, могли получить в общей сложности от 6 до 21 инъекции к 96-й нед. На 52-й нед у 74 и 71% пациентов в группе с корректируемой дозой препарата Вабисмо до 1 р/16 нед был достигнут интервал введения 1 р/16 нед или 1 р/12 нед в исследовании YOSEMITE и RHINE соответственно (53 и 51% для 1 р/16 нед, 21 и 20% для 1 р/12 нед). Из них у 75 и 84% пациентов сохранялся интервал введения ≥1 р/12 нед без уменьшения интервала <1 р/12 нед к 96-й нед; среди пациентов с интервалом введения 1 р/16 нед на 52-й нед у 70 и 82% пациентов сохранялся интервал введения 1 р/16 нед без снижения интервала к 96-й нед в исследованиях YOSEMITE и RHINE соответственно. В обоих исследованиях на 96-й нед 78% пациентов в группе с корректируемой дозой препарата Вабисмо до 1 р/16 нед достигли интервала введения 1 р/16 нед или 1 р/12 нед (60 и 64% пациентов получали препарат 1 р/16 нед, 18 и 14% пациентов получали препарат 1 р/12 нед). 4 и 6% пациентов перевели на интервал введения 1 р/8 нед, и у них оставался интервал введения ≤1 р/8 нед до 96-й нед; 3 и 5% пациентов получали препарат 1 р/4 нед до 96-й нед в исследованиях YOSEMITE и RHINE соответственно.
Подробные результаты анализов исследований YOSEMITE и RHINE представлены в таблице 2, на рисунках 3 и 4 ниже.
Таблица 2
Показатели эффективности на визитах первичных конечных точек 1-го годаа и 2-го годаb лечения в исследованиях YOSEMITE и RHINE
| Показатели эффективности | YOSEMITE | RHINE | ||||||||||
| 1-й год | 2-й год | 1-й год | 2-й год | |||||||||
| Вабисмо 1 р/8 нед N = 315 |
Вабисмо коррект ируемая доза до 1 р/16 нед N = 313 |
Афлиберцепт 1 р/8 нед N = 312 |
Вабисмо 1 р/8 нед N = 262 |
Вабисмо коррект ируемая доза до 1 р/16 нед N = 270 |
Афлиберцепт 1 р/8 нед N = 259 |
Вабисмо 1 р/8 нед N = 317 |
Вабисмо коррект ируемая доза до 1 р/16 нед N = 319 |
Афлиберцепт 1 р/8 нед N = 315 |
Вабисмо 1 р/8 нед N = 259 |
Вабисмо коррект ируемая доза до 1 р/16 нед N = 282 |
Афлиберцепт 1 р/8 нед N = 254 |
|
| Среднее отклонение от исходных значений МКОЗ, измеренное с помощью схемы ETDRS (1 год: 97.5 % ДИ и 2 год: 95% ДИ) | 10,7 (9,4;2,0) |
11,6 (10,3;12,9) | 10,9 (9,6; 12,2) |
10,7 (9,4; 12,1) |
10,7 (9,4; 12,1) |
11,4 (10,6; 13,0) |
11,8 (10,0; 12,7) |
10,8 (9,6; 11,9) |
10,3 (9,1; 11,4) |
10,9 (9,5; 12,3) |
10,1 (8,7; 11,5) |
9,4 (7,9; 10,8) |
| Разница в среднем LS (1-й год: 97,5% ДИ и 2-й год: 95 % ДИ) | −0,2 (−2,0; 1,6) |
0,7 (−1,1; 2,5) |
−0,7 (−2,6; 1,2) |
−0,7 (−2,5; 1,2) |
1,5 (−0,1; 3,2) |
0,5 (−1,1; 2,1) |
1,5 (−0,5; 3,6) |
0,5 (−1,3; 2,7) |
||||
| Доля пациентов с увеличением не менее чем на 15 букв от исходного уровня по результатам оценки МКОЗ (взвешенная доля по КМХ, 1-й и 2-й год: 95% ДИ) | 29,2% (23,9; 34,5%) |
35,5% (30,1; 40,9%) |
31,8% (26,6: 37,0%) |
37,2% (31,4 42,9%) |
38,2% (32,8; 43,7%) |
37,4% (31,7; 43,0%) |
33,8% (28,4; 39,2%) |
28,5% (23,6; 33,3%) |
30,3% (25,0; 35,5%) |
39,8% (34,0; 45,6%) |
31,1% (26,1: 36,1%) |
39,0% (33,2; 44,8%) |
| Разница взвешенного % по КМХ (1-й и 2-й год: 95% ДИ) | −2,6% (−10,0; 4,9%) |
3,5% (−4,0; 11,1%) |
−0,2% (−8,2; 7,8%) |
0,2% (−7,6; 8,1%) |
3,5% (−4,0; 11,1%) |
−2,0% (−9,1; 5,2%) |
0,8% (−7,4; 9,0%) |
−8,0% (−15,7; 0,3%) |
||||
| Доля пациентов, избежавших снижения не менее чем на 15 букв от исходного уровня по результатам оценки МКОЗ (взвешенная доля по КМХ, 1-й и 2-й год: 95% ДИ) | 98,1% (96,5; 99,7%) |
98,6% (97,2; 100,0%) |
98,9% (97,6; 100,0%) |
97,6% (95,7; 99,5%) |
97,8% (96,1; 99,5%) |
98,0% (96,2; 99,7%) |
98,9% (97,6; 100,0%) |
98,7% (97,4; 100,0%) |
98,6% (97,2; 99,9%) |
96,6% (94,4; 98,8%) |
96,8% (94,8; 98,9%) |
97,6% (95,7; 99,5%) |
| Разница взвешенного % по КМХ (1-й и 2-й год: 95% ДИ) | −0,8% (−2,8; 1,3%) |
−0,3% (−2,2; 1,5%) |
−0,4% (−2,9; 2,2%) |
−0,2% (−2,6; 2,2%) |
0,3% (−1,6; 2,1%) |
0,0% (−1,8; 1,9%) |
−1,0% (−3,9; 1,9%) |
−0,7 (−3,5; 2,0) |
a Среднее значение на 48-й, 52-й, 56-й нед.
b Среднее значение на 92-й, 96-й, 100-й нед.
МКОЗ — максимальная корригированная острота зрения.
ETDRS — исследование раннего лечения диабетической ретинопатии.
ДИ — доверительный интервал LS: метод наименьших квадратов.
КМХ — метод Кохрана-Мантеля-Хензеля; статистический критерий, который позволяет провести оценку связи с бинарным показателем и используется для оценки категориальных переменных.
Примечание: взвешенный % по КМХ в группе афлиберцепта представлен для сравнения препарата Вабисмо® (1 р/8 нед) и афлиберцепта, однако соответствующий взвешенный % КМХ для корректируемого сравнения препарата Вабисмо® и афлиберцепта сходен с указанным выше.
Рисунок 3. Среднее отклонение остроты зрения от исходного уровня до 2-го года лечения (нед 100-я) в исследовании YOSEMITE
Рисунок 4. Среднее отклонение остроты зрения от исходного уровня до 2-го года лечения (нед 100-я) в исследовании RHINE
В каждом исследовании результаты оценки эффективности у пациентов, которые до участия в исследовании не получали лечения антителами к VEGF, и во всех других оцениваемых подгруппах (например, в зависимости от возраста, пола, расы, исходного уровня HbA1c, исходной остроты зрения) соответствовали результатам в общей популяции. В обоих исследованиях при применении препарата Вабисмо® 1 р/8 нед и в корректируемой дозе до 1 р/16 нед были продемонстрированы улучшения в предварительно определенной конечной точке эффективности — среднему изменению по сравнению с исходным уровнем до 52-й нед по 25-балльной комплексной шкале NEI VFQ зрения вблизи, зрения вдаль и оценок вождения, что было сопоставимо с группой афлиберцепта 1 р/8 нед. Величина этих изменений соответствует увеличению на 15 букв по результатам оценки МКОЗ. При применении препарата Вабисмо® 1 р/8 нед, препарата Вабисмо® в корректируемой дозе 1 р/16 нед и афлиберцепта 1 р/8 нед у сходной доли пациентов происходило клинически значимое улучшение на ≥4 балла по сравнению с исходным уровнем на 52-й нед по 25-балльной комплексной шкале NEI VFQ. Эти результаты сохранялись на 100-й нед.
Дополнительным ключевым показателем эффективности в исследованиях ДМО было изменение от исходного уровня до 52-й нед по шкале тяжести диабетической ретинопатии (ДР) в рамках исследования раннего лечения ДР (ETDRS-DRSS). Из 1891 пациента, включенного в исследования YOSEMITE и RHINE, 708 и 720 пациентов подлежали оценке по конечным точкам ДР соответственно. На исходном уровне баллы по шкале ETDRS-DRSS варьировали от 10 до 71. У большинства пациентов (примерно 60%) на исходном уровне была непролиферативная ДР средней или тяжелой степени тяжести (DRSS 43/47/53). На 52-й нед в обоих исследованиях доля пациентов, у которых состояние улучшилось на ≥2 ступени по шкале ETDRS-DRSS, составила 43 и 46% в группах препарата Вабисмо® 1 р/8 нед и препарата Вабисмо® в корректируемой дозе до 1 р/16 нед по сравнению с 36 и 47% в группах афлиберцепта 1 р/8 нед в исследованиях YOSEMITE и RHINE соответственно. Результаты на 96-й нед в обоих исследованиях составили от 43 до 54% в группах препарата Вабисмо 1 р/8 нед и препарата Вабисмо® в корректируемой дозе до 1 р/16 нед по сравнению с 42 и 44% в группах афлиберцепта 1 р/8 нед в исследованиях YOSEMITE и RHINE соответственно. В обоих исследованиях в группах лечения отмечали сопоставимые доли пациентов, у которых наблюдалось улучшение на ≥3 ступени по ETDRS-DRSS на 52-й нед по сравнению с исходным уровнем, эти результаты сохранялись на 96-й нед.
Результаты анализа улучшения на ≥2 ступени и ≥3 ступени по ETDRS-DRSS на 52-й и 96-й нед по сравнению с исходным уровнем представлены в таблице 3 ниже.
Таблица 3
Доля пациентов, достигших на 52-й и 96-й нед улучшения на ≥2 ступени и ≥3 ступени по ETDRS-DRSS по сравнению с исходным уровнем в исследованиях YOSEMITE и RHINE (оцениваемая популяция ДР)
| Показатели | YOSEMITE | RHINE | ||||||||||
| 52-я нед | 96-я нед | 52-я нед | 96-я нед | |||||||||
| Вабисмо 1 р/8 нед N = 237 |
Вабисмо коррект ируемая доза до 1 р/16 нед N = 242 |
Афлиберцепт 1 р/8 нед N = 229 |
Вабисмо 1 р/8 нед N = 220 |
Вабисмо коррект ируемая доза до 1 р/16 нед N = 234 |
Афлиберцепт 1 р/8 нед N = 221 |
Вабисмо 1 р/8 нед N = 231 |
Вабисмо коррект ируемая доза до 1 р/16 нед N = 251 |
Афлиберцепт 1 р/8 нед N = 238 |
Вабисмо 1 р/8 нед N = 214 |
Вабисмо коррект ируемая доза до 1 р/16 нед N = 228 |
Афлиберцепт 1 р/8 нед N = 203 |
|
| Доля пациентов с улучшением на ≥2 ступени по ETDRS-DRSS по сравнению с исходным уровнем (взвешенная доля по КМХ),% | 46,0 | 42,5 | 35,8 | 51,4 | 42,8 | 42,2 | 44,2 | 43,7 | 46,8 | 53,5 | 44,3 | 43,8 |
| Взвешенная разность (1-й год: 97.5% ДИ и 2-й год: 95 % ДИ) | 10,2% (1,6; 19,7%) |
6,1%(−2,4%; 14,6) | 9,1% (0,0; 18,2%) |
−0,0% (−8,9; 8,9%) |
−2,6% (−11,3; 6,2%) |
−3,5% (−12,1; 5,1%) |
9,7% (0,4; 19,1%) |
0,3% (−8,9; 9,5%) |
||||
| Доля пациентов с улучшением на ≥3 ступени по сравнению с исходным уровнем (взвешенная доля по КМХ),% | 16,8 | 15,5 | 14,7 | 22,4 | 14,6 | 20,9 | 16,7 | 18,9 | 19,4 | 25,1 | 19,3 | 21,8 |
| Взвешенная разность (1-й и 2-й год: 95% ДИ) | 2,1% (−4,3; 8,6%) |
0,6 (−5,8; 6,9%) |
1,5 (−6,0; 9,0%) |
−6,7 (−13,6; 0,1%) |
−0,2 (−5,8; 5,3%) |
−1,1 (−8,0; 5,9%) |
3,3 (−4,6; 11,3%) |
−2,7 (−10,2; 4,8%) |
ETDRS-DRSS — шкала тяжести ДР в рамках исследования ее раннего лечения.
ДИ — доверительный интервал LS: метод наименьших квадратов.
КМХ — метод Кохрана-Мантеля-Хензеля; статистический критерий, который позволяет провести оценку связи с бинарным показателем и используется для оценки категориальных переменных.
Примечание: взвешенный % по КМХ в группе афлиберцепта представлен для сравнения препарата Вабисмо (1 р/8 нед) и афлиберцепта, однако соответствующий взвешенный % КМХ для корректируемого сравнения препарата Вабисмо и афлиберцепта сходен с указанным выше.
В исследованиях YOSEMITE и RHINE доли пациентов с новым диагнозом «пролиферативная ДР» (определенным как 61 балл или более по шкале по ETDRS-DRSS) от исходного уровня до 96-й нед были сопоставимы между пациентами в каждой группе лечения. В течение 2-летней продолжительности исследований практически никому из пациентов не потребовалась витрэктомия (от 0 до 4 в каждой группе) или панретинальная фотокоагуляция (ПРФ) (от 1 до 2 в каждой группе).
Эффекты лечения ДР в оцениваемой подгруппе пациентов, которые до участия в исследовании не получали лечения антителами к VEGF, были сопоставимы с эффектами, наблюдаемыми в общей популяции оцениваемых пациентов с ДР.
Эффекты лечения в оцениваемых подгруппах (например, в зависимости от возраста, пола, расы, исходного уровня HbA1c, исходной остроты зрения) в каждом исследовании в целом соответствовали результатам в общей популяции.
Эффекты лечения в подгруппах в зависимости от степени тяжести ДР на исходном уровне различались; среди пациентов с непролиферативной ДР средней или тяжелой степени тяжести было продемонстрировано наибольшее улучшение на ≥2 ступени по DRSS, причем улучшение было достигнуто примерно у 90% пациентов. Эти результаты были сопоставимы между группами исследования и сопоставимы в общей популяции и в популяции пациентов, ранее не получавших лечения антителами к VEGF.
Фармакокинетика
Абсорбция. Препарат Вабисмо® вводится путем внутриглазной инъекции для оказания местного воздействия на глаз. Клинических исследований других путей введения не проводили. На основании анализа популяционной фармакокинетики (включая пациентов с нВМД и ДМО, N = 2246) Cmax свободного (несвязанного с VEGF-A и Ang-2) фарицимаба в плазме крови по оценкам достигается примерно через 2 дня после введения. У пациентов с нВМД и ДМО/ДР средняя (±СО) Cmax в плазме крови по оценкам составляет 0,23 (0,07) и 0,22 (0,07) мкг/мл соответственно. Предполагается, что после повторных введений средние Cmin свободного фарицимаба в плазме крови составят 0,002–0,003 мкг/мл при введении 1 р/8 нед. В диапазоне доз 0,5–6 мг фарицимаб демонстрировал пропорциональную дозе фармакокинетику (на основании Cmax и AUC). Накопления фарицимаба в стекловидном теле или в плазме крови после ежемесячного введения не наблюдалось.
Распределение. Cmax свободного фарицимаба в плазме крови, по прогнозам, будут примерно в 600 и 6000 раз ниже, чем в водянистой влаге и стекловидной влаге соответственно, и ниже аффинности связывания c VEGF и Ang-2. Следовательно, системные фармакодинамические эффекты маловероятны, что дополнительно подтверждается отсутствием значительных изменений концентрации свободного VEGF и Ang-2 в плазме крови после лечения фарицимабом в клинических исследованиях. Анализ популяционной фармакокинетики продемонстрировал влияние возраста и массы тела на фармакокинетику фарицимаба в глазу или системную фармакокинетику соответственно. Оба эффекта не считались клинически значимыми; коррекция дозы не требуется.
Биотрансформация. Метаболизм фарицимаба напрямую не изучался, поскольку моноклональные антитела выводятся преимущественно за счет катаболизма.
Элиминация. Расчетный средний кажущийся системный T1/2 фарицимаба после внутриглазного введения составляет 7,5 дней.
Особые группы пациентов
Лица пожилого возраста. В четырех клинических исследованиях III фазы ~60% (1149/1929) пациентов, рандомизированных в группу лечения препаратом Вабисмо®, были в возрасте ≥65 лет. Анализ популяционной фармакокинетики показал влияние возраста на фармакокинетику фарицимаба. Это влияние не считается клинически значимым.
Почечная недостаточность. Формального фармакокинетического исследования с участием пациентов с почечной недостаточностью не проводили.
Печеночная недостаточность. Формального фармакокинетического исследования с участием пациентов с печеночной недостаточностью не проводили.
Прочее. Системная фармакокинетика препарата Вабисмо® не зависит от расы. Не было показано клинически значимого влияния пола на системную фармакокинетику препарата Вабисмо®.
Дети. Эффективность и безопасность препарата Вабисмо® у детей и подростков не установлены.
Данные доклинической безопасности
Канцерогенность. Исследования канцерогенности с целью определения канцерогенного потенциала препарата Вабисмо® не проводились.
Генотоксичность. Исследования с целью определения мутагенного потенциала препарата Вабисмо® не проводились.
Нарушение фертильности. В то время как компоненты антител к VEGF и Ang2 могут нести потенциальный теоретический риск для репродуктивной функции, основанный на механизме действия, системная экспозиция вследствие внутриглазного введения позволяет предположить, что этот риск может быть незначительно мал. В 6-месячном исследовании препарата Вабисмо® у яванских макак влияния на фертильность не наблюдалось.
Репродуктивная токсичность. Было продемонстрировано, что ингибирование VEGF вызывает пороки развития, резорбцию эмбриона и плода и снижение массы плода. Было продемонстрировано, что ингибирование VEGF также влияет на развитие фолликулов, функцию желтого тела и фертильность. Специальные исследования, посвященные влиянию ингибирования Ang-2 на беременность, отсутствуют. На основании доклинической информации ингибирование Ang-2 может приводить к эффектам, сравнимым с ингибированием VEGF. Системная экспозиция после введения в глаз препарата Вабисмо® очень низка. В 6-месячном исследовании препарата Вабисмо® у яванских макак влияния на репродуктивные органы не наблюдалось. В исследовании эмбриофетального развития, проведенном на беременных самках яванских макак, которым вводили 5 еженедельных в/в инъекций препарата Вабисмо®, начиная с 20-го дня беременности в дозе 1 или 3 мг/кг, не наблюдалось влияния на течение беременности или плод. У обезьян при максимальной дозе, не вызывающей наблюдаемых нежелательных эффектов (доза 3 мг/кг), экспозиция в сыворотке крови (Cmax) была более чем в 500 раз выше, чем у человека при дозе 6 мг при внутриглазном введении один раз в 4 нед.
Показания
Вабисмо показан к применению у взрослых пациентов с 18 лет при следующих заболеваниях:
- неоваскулярная (влажная) форма возрастной макулярной дегенерации (нВМД);
- диабетический макулярный отек (ДМО).
Противопоказания
- гиперчувствительность к фарицимабу или любому из вспомогательных веществ («Состав»);
- инфекция глаз или окружающих тканей;
- внутриглазное воспаление в активной форме.
Применение при беременности и кормлении грудью
Беременность. Информация о применении фарицимаба беременными женщинами ограничена или отсутствует. Системная экспозиция препарата Вабисмо® после интравитреального введения чрезвычайно мала. В ходе исследования влияния препарата на течение беременности, проведенного на беременных яванских макаках, не получено данных о прямом или косвенном влиянии препарата на эмбриофетальное развитие, а также на репродуктивную систему в целом. В качестве меры предосторожности не рекомендуется применение препарата Вабисмо® беременными женщинами, за исключением случаев, когда польза применения препарата для матери превышает риск для плода и ребенка.
Лактация. Неизвестно, выводится ли препарат Вабисмо® или его метаболиты с грудным молоком у человека. Исследований по оценке влияния препарата Вабисмо® на выработку грудного молока или по определению его наличия в грудном молоке не проводили. Поскольку многие лекарственные препараты выделяются с грудным молоком, что может привести к их всасыванию и нарушить рост и развитие ребенка, следует соблюдать осторожность при назначении препарата Вабисмо® кормящей женщине. Необходимо принять решение либо о прекращении грудного вскармливания либо об отмене терапии препарата Вабисмо®, принимая во внимание пользу грудного вскармливания для развития и роста ребенка и пользу терапии для женщины, а также возможные неблагоприятные эффекты препарата Вабисмо® у ребенка.
Фертильность. Исследования репродуктивной функции или фертильности не проводились. В 6-месячном исследовании препарата Вабисмо® у яванских макак влияния на репродуктивные органы или фертильность не наблюдалось.
Женщины с детородным потенциалом (контрацепция у мужчин и женщин). Женщины с детородным потенциалом должны использовать надежные методы контрацепции во время лечения препаратом Вабисмо® и в течение по меньшей мере 3 мес после введения последней дозы препарата Вабисмо®.
Способ применения и дозы
Реклама: ООО «РЛС-Библиомед», ИНН 7714758963, erid=4CQwVszH9pUmKjt23pm
Интравитреально. Перед введением препарат Вабисмо® следует проверить визуально на предмет посторонних включений или изменения цвета. Сразу после внутриглазного введения пациенты должны находиться под наблюдением на предмет повышения ВГД. Соответствующий мониторинг может включать проверку перфузии головки зрительного нерва или тонометрию. В случае необходимости должно быть доступно стерильное оборудование для проведения парацентеза. После внутриглазного введения пациенты должны быть проинструктированы о необходимости немедленно сообщать о любых симптомах, указывающих на эндофтальмит (например, потеря зрения, боль в глазу, покраснение глаза, светобоязнь, затуманивание зрения).
Перед применением невскрытый флакон препарата Вабисмо® может оставаться при комнатной температуре от 20 до 25 °C до 24 ч. Следует убедиться, что инъекция вводится сразу после приготовления дозы.
Препарат Вабисмо® должен вводиться квалифицированным врачом, имеющим опыт проведения внутриглазных инъекций. Каждый флакон следует использовать только для введения в один глаз.
Режим дозирования
нВМД
Рекомендуемый режим дозирования Вабисмо® 6 мг (0,05 мл раствора), вводимых путем интравитреальной инъекции каждые 4 нед. Указанная схема терапии предусмотрена для первых 4 доз препарата. После 3 мес вводного периода терапии дальнейший режим применения препарата будет основываться на анатомических особенностях и характеристиках зрительных функций, определяющих течение заболевания. Оценка ответа на терапию рекомендована на 20-й нед после первой инъекции с возможной повторной оценкой на 24-й нед после первой инъекции, что позволяет индивидуализировать схему терапии в зависимости от наличия или отсутствия признаков активности заболевания. При отсутствии прогрессирования заболевания рекомендуется проведение интравитреальных инъекций Вабисмо® каждые 16 нед, а в случае появления признаков прогрессирования — каждые 8 или 12 нед. Контрольные временные точки для оценки состояния пациента определяются по усмотрению врача на основании имеющихся у пациента жалоб и его общего состояния, ежемесячные осмотры не предусмотрены.
ДМО
Рекомендуемый режим дозирования Вабисмо® 6 мг (0,05 мл раствора), вводимых путем интравитреальной инъекции каждые 4 нед. Указанная схема терапии предусмотрена для первых 4 доз препарата. После вводного периода терапии схема лечения может быть индивидуализирована согласно подходу «лечить и увеличивать интервал» в соответствии с оценкой анатомических параметров течения заболевания и характеристик зрительных функций. Интервал между введениями препарата может изменяться с 4 до 16 нед с шагом изменения интервала 4 нед. При изменении активности заболевания необходима переоценка частоты введения препарата, сокращение интервала возможно на 4 или 8 нед при необходимости. Контрольные временные точки для оценки состояния пациента определяются по усмотрению врача на основании имеющихся у пациента жалоб и его общего состояния, ежемесячные осмотры не предусмотрены.
Продолжительность лечения. Препарат Вабисмо® предназначен для долгосрочной терапии.
Задержка введения или пропуск дозы. При задержке введения или пропуске дозы пациент должен повторно посетить врача для осмотра на следующем возможном визите и продолжить терапию по усмотрению врача. Если результаты оценки анатомических особенностей и характеристик зрительных функций, определяющих течение заболевания, показывают, что дальнейшее лечение пациента не приносит пользы, терапию препаратом Вабисмо® следует прекратить.
Особые группы пациентов
Пациенты пожилого возраста. В четырех клинических исследованиях III фазы ~60% (1149/1929) пациентов, рандомизированных в группу лечения препаратом Вабисмо®, были в возрасте ≥65 лет. Анализ популяционной фармакокинетики показал влияние возраста на фармакокинетику фарицимаба. Данное влияние не считается клинически значимым. У пациентов в возрасте ≥65 лет коррекции дозы не требуется (см. «Фармакокинетика»).
Пациенты с нарушением функции почек. Специальных исследований применения препарата Вабисмо® у пациентов с нарушением функции почек не проводилось. В фармакокинетическом анализе, проведенном среди пациентов четырех клинических исследований III фазы, у 64% из которых имелось нарушение функции почек (легкой степени тяжести — 38%, средней степени тяжести — 24% и тяжелой степени — 2 %), не было выявлено различий в системной фармакокинетике фарицимаба после внутриглазного введения препарата Вабисмо®. У пациентов с нарушением функции почек коррекции дозы не требуется.
Пациенты с нарушением функции печени. Специальных исследований применения препарата Вабисмо® у пациентов с нарушением функции печени не проводилось. Однако данная популяция пациентов не требует особого внимания, поскольку метаболизм препарата происходит посредством протеолиза и не зависит от функции печени. У пациентов с нарушением функции печени коррекции дозы не требуется.
Другие особые популяции пациентов. Специальной коррекции дозы в любой из изученных популяций пациентов (например, пациенты пожилого возраста, в зависимости от пола, расы) не требуется.
Дети. Эффективность и безопасность препарата Вабисмо® у детей и подростков младше 18 лет не установлены. Данные отсутствуют.
Побочные действия
Резюме профиля безопасности
В общей сложности в четырех клинических исследованиях III фазы в популяцию для оценки безопасности было включено 3213 пациента (1926 пациентов получали препарат Вабисмо®: 664 пациента с нВМД и 1262 пациента с ДМО).
В клинических исследованиях III фазы наиболее часто встречающимися реакциями были катаракта (12,7%), субконъюнктивальное кровоизлияние (8,0%), отслойка стекловидного тела (4,8%), повышение ВГД (4,2%), плавающие помутнения стекловидного тела (4,1%), боль в глазу (3,0%) и разрыв пигментного эпителия сетчатки (только при нВМД) (2,9%).
Наиболее серьезными нежелательными реакциями были катаракта (12,7%), увеит (0,6%), эндофтальмит (0,5%), витреит (0,3%), разрыв сетчатки (0,2%), регматогенная отслойка сетчатки (0,1%) и травматическая катаракта (<0,1%).
Табличное резюме нежелательных реакций
Данные по безопасности, представленные ниже, включают все нежелательные реакции из объединенных данных четырех клинических исследований III фазы у пациентов с нВМД и ДМО, для данных нежелательных реакций существует обоснованная возможность установления причинно-следственной связи с процедурой инъекции или лекарственным препаратом.
Нежелательные реакции, отмечавшиеся в ходе клинических исследований, сгруппированы в соответствии с системно-органной классификацией медицинского словаря для медицинско-правовой деятельности (MedDRA). Для описания частоты нежелательных реакций используются следующие категории: очень часто (≥1/10); часто (≥1/100, но <1/10); нечасто (≥1/1000, но <1/100); редко (≥1/10000, но <1/1000).
Таблица 4
Резюме нежелательных реакций у пациентов, получавших препарат Вабисмо® в клинических исследованиях III фазы
| Нежелательные реакции | Вабисмо® N=1926 | Категория частоты |
| Нарушения со стороны органа зрения | ||
| Катаракта | 12,7% | Очень часто |
| Субконъюнктивальное кровоизлияние | 8,0% | Часто |
| Отслойка стекловидного тела | 4,8% | Часто |
| Повышение ВГД | 4,2% | Часто |
| Плавающие помутнения стекловидного тела | 4,1% | Часто |
| Боль в глазу | 3,0% | Часто |
| Разрыв пигментного эпителия сетчатки (только при нВМД) | 2,9% | Часто |
| Слезотечение | 1,1% | Часто |
| Эрозия роговицы | 1,1% | Часто |
| Раздражение глаза | 1,0% | Часто |
| Дискомфорт в глазу | 0,9% | Нечасто |
| Зуд в глазу | 0,9% | Нечасто |
| Конъюнктивальная инъекция | 0,8% | Нечасто |
| Затуманивание зрения | 0,8% | Нечасто |
| Снижение остроты зрения | 0,7% | Нечасто |
| Ирит | 0,7% | Нечасто |
| Увеит | 0,6% | Нечасто |
| Эндофтальмит | 0,5% | Нечасто |
| Ощущение инородного тела | 0,5% | Нечасто |
| Кровоизлияние в стекловидное тело | 0,5% | Нечасто |
| Иридоциклит | 0,4% | Нечасто |
| Витреит | 0.3% | Нечасто |
| Конъюнктивальная гиперемия | 0,3% | Нечасто |
| Боль во время процедуры | 0.2% | Нечасто |
| Разрыв сетчатки | 0,2% | Нечасто |
| Регматогенная отслойка сетчатки | 0,1% | Нечасто |
| Транзиторное снижение остроты зрения | <0,1% | Редко |
| Травматическая катаракта | <0,1% | Редко |
Описание отдельных нежелательных реакций
После внутриглазного введения ингибиторов VEGF существует теоретический риск развития явлений артериальной тромбоэмболии, включая инсульт и инфаркт миокарда. В клинических исследованиях препарата Вабисмо® у пациентов с нВМД и ДМО наблюдалась низкая частота явлений артериальной тромбоэмболии. Заметных различий между группами пациентов, которые получали препарат Вабисмо® и препарат сравнения, для всех показаний к применению не было.
Иммуногенность. Отмечена потенциальная возможность развития иммунного ответа на введение препарата Вабисмо®. После введения препарата в период до 48 нед при нВМД и 100 нед при ДМО, антитела острой фазы к фарицимабу были обнаружены у 13,8% пациентов с нВМД и 9,6% пациентов с ДМО соответственно. Клиническое значение наличия указанных антител и их влияние на безопасность препарата в настоящее время не ясны. Среди пациентов, у которых были обнаружены антитела к фарицимабу, более часто встречались случаи внутриглазного воспаления, хотя общая частота встречаемости положительного анализа на антитела к фарицимабу и внутриглазного воспаления во всей исследуемой популяции не превышала 1%. Не выявлено взаимосвязи между эффективностью препарата, а также его фармакокинетикой и наличием антител к фарицимабу.
Разрыв пигментного эпителия сетчатки Разрыв пигментного эпителия сетчатки — это осложнение отслойки пигментного эпителия сетчатки у пациентов с нВМД, и представляет собой одно из наиболее распространенных осложнений терапии ингибиторами VEGF, в т.ч. фарицимабом. Указанное явление встречалось более часто в ходе исследований во вводном периоде терапии у пациентов, получавших фарицимаб (2,9%) по сравнению с афлиберцептом, его выраженность варьировала от легкой до средней, не отмечалось влияния на остроту зрения.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения польза — риск лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств — членов Евразийского экономического союза.
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор) РФ, 109012, Москва, Славянская пл., 4, стр. 1
Тел.: (499) 578-02-72, 7 (499) 578-02-20 (справочная), +7 (499) 578-06-70 (многоканальный).
e-mail: pharm@roszdravnadzor.gov.ru
www.roszdravnadzor.gov.ru
Взаимодействие
Исследования взаимодействия не проводились.
Передозировка
Дозы, превышающие рекомендованные, не изучались.
Передозировка при введении объема, превышающего рекомендуемый, может повысить ВГД.
При передозировке следует контролировать ВГД и, если врач сочтет это необходимым, начать соответствующее лечение.
Особые указания
Чтобы улучшить прослеживаемость биологических лекарственных препаратов, следует четко зафиксировать торговое наименование и номер серии вводимого препарата.
Реакции, связанные с внутриглазным введением. Внутриглазное введение, в т.ч. препарата Вабисмо®, сопровождалось эндофтальмитом, внутриглазным воспалением, регматогенной отслойкой сетчатки, разрывом сетчатки и ятрогенной травматической катарактой. При введении препарата Вабисмо® всегда необходимо соблюдать надлежащие правила асептики. Пациенты должны быть проинструктированы о необходимости немедленно сообщать о любых симптомах, таких как боль, потеря зрения, светобоязнь, затуманивание зрения, мушки перед глазами или покраснение, указывающих на эндофтальмит, или любое из вышеупомянутых явлений, для обеспечения быстрого и надлежащего лечения. В течение 60 мин после внутриглазного введения, в т.ч. препарата Вабисмо®, наблюдалось временное повышение ВГД. Преходящее повышение ВГД более 21 мм рт.ст. в ряде случаев сохранялось на протяжении двух и более последовательных визитов. В отношении пациентов с плохо контролируемой глаукомой следует соблюдать особые меры предосторожности (не следует вводить препарат Вабисмо®, если ВГД ≥30 мм рт.ст.). Во всех случаях необходимо контролировать ВГД и перфузию головки зрительного нерва и при необходимости назначать лечение.
Системные эффекты. После интравитреального введения отмечались системные нежелательные явления, в т.ч. тромбозы артерий. Существует теоретический риск того, что они могут быть связаны с ингибированием VEGF.
Иммуногенность. Возможно развитие иммунной реакции на препарат Вабисмо® в связи с его принадлежностью к лекарственным препаратам белковой природы. Пациенты должны быть проинструктированы о необходимости сообщать о любых признаках или симптомах внутриглазного воспаления, таких как потеря зрения, боль в глазу, повышенная чувствительность к свету, мушки перед глазами или усиление покраснения глаз, что может быть клиническим признаком гиперчувствительности.
Билатеральная терапия. Безопасность и эффективность препарата Вабисмо® при введении одновременно в оба глаза не изучались.
Одновременное применение с другими антителами к VEGF Данные об одновременном применении препарата Вабисмо® с лекарственными препаратами-антителами к VEGF на одном и том же глазу отсутствуют.
Приостановка лечения Следует приостановить лечение у пациентов:
— с регматогенной отслойкой сетчатки, макулярным разрывом сетчатки 3-й или 4-й стадии, разрывом сетчатки; лечение не следует возобновлять до полного восстановления;
— со снижением МКОЗ на ≥30 букв, связанным с лечением, по сравнению с последней оценкой остроты зрения; терапию не следует возобновлять ранее следующего запланированного введения;
— с проведенным или запланированным внутриглазным хирургическим вмешательством в течение предыдущих или последующих 28 дней; лечение не следует возобновлять ранее следующего запланированного введения.
Разрыв пигментного эпителия сетчатки. Факторы риска, связанные с развитием разрыва пигментного эпителия сетчатки после терапии нВМД антителами к VEGF, включают обширную и/или расположенную в верхних отделах сетчатки отслойку пигментного эпителия. Во время начала терапии препаратом Вабисмо® следует соблюдать осторожность у пациентов с факторами риска разрыва пигментного эпителия сетчатки.
Популяции пациентов с ограниченными данными Опыт лечения пациентов с ДМО с показателем гликированного гемоглобина (HbA1c) >10%, пациентов с высоким риском пролиферативной ДР или пациентов с нВМД и ДМО с системными инфекциями в активной форме ограничен. Опыт лечения препаратом Вабисмо® пациентов с сахарным диабетом и неконтролируемой артериальной гипертензией отсутствует. При лечении таких пациентов врачу следует учитывать отсутствие соответствующей информации.
Влияние на способность управлять транспортными средствами и работать с механизмами. Препарат Вабисмо® может оказывать слабое влияние на способность управлять транспортными средствами и работать с механизмами из-за возможных временных нарушений зрения после внутриглазного введения и сопутствующего обследования глаз. Пациентам не следует управлять транспортными средствами и работать с механизмами до тех пор, пока зрительная функция в достаточной степени не восстановится.
Форма выпуска
Раствор для внутриглазного введения. По 6 мг/0.05 мл препарата во флаконе бесцветного стекла (гидролитический класс 1ЕФ), укупоренном пробкой из бутилкаучука, ламинированного фторполимером, обжатом алюминиевым колпачком и закрытом пластмассовой крышкой. 1 фл. с препаратом вместе с 1 иглой с фильтром и листком-вкладышем помещают в картонную пачку.
Производитель
Держатель регистрационного удостоверения. Швейцария Ф. Хоффманн-Ля Рош Лтд./F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070, Basel, Switzerland.
Тел./факс: + 41-61-68-688-01-92.
www.roche.com
Представитель держателя регистрационного удостоверения. Претензии потребителей направлять по адресу АО «Рош-Москва», РФ, 107031, Москва, Трубная пл., 2, пом. 1, эт. 1-й, комн. 42.
Тел.: (495) 229-29-99
www.roche.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре 2–8 °C, в картонной пачке для защиты от света.
Не замораживать. Не встряхивать
Хранить в недоступном для детей месте.
Срок годности
2 года 6 мес.
Не применять по истечении срока годности, указанного на упаковке.
Вабисмо — инструкция по применению
Синонимы, аналоги
Статьи
Листок-вкладыш – информация для пациента
ЛП-№(001664)-(РГ-RU)
Вабисмо®, 120 мг/мл, раствор для внутриглазного введения
Действующее вещество: фарицимаб
▼ Лекарственный препарат подлежит дополнительному мониторингу, который способствует быстрому выявлению новых сведений о безопасности. Вы можете помочь, сообщая информацию о любых нежелательных реакциях, которые возникли в период применения лекарственного препарата (в том числе и о случаях его неэффективности).
Способ сообщения о нежелательных реакциях описан в разделе 4 листка-вкладыша.
Перед применением препарата полностью прочитайте листок-вкладыш, поскольку в нем содержатся важные для Вас сведения.
- Сохраните листок-вкладыш. Возможно, Вам потребуется прочитать его еще раз.
- Если у Вас возникли дополнительные вопросы, обратитесь к лечащему врачу, работнику аптеки или медицинской сестре.
- Препарат назначен именно Вам. Не передавайте его другим людям. Он может навредить им, даже если симптомы их заболевания совпадают с Вашими.
- Если у Вас возникли какие-либо нежелательные реакции, обратитесь к лечащему врачу, работнику аптеки или медицинской сестре. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в разделе 4 листка-вкладыша.
Содержание листка-вкладыша
- Что из себя представляет препарат Вабисмо®, и для чего его применяют.
- О чем следует знать перед применением препарата Вабисмо®.
- Применение препарата Вабисмо®.
- Возможные нежелательные реакции.
- Хранение препарата Вабисмо®.
- Содержимое упаковки и прочие сведения.
1. Что из себя представляет препарат Вабисмо®, и для чего его применяют
Препарат Вабисмо® содержит действующее вещество фарицимаб, который принадлежит к антинеоваскуляризационным препаратам (то есть препятствует росту аномальных кровеносных сосудов).
Способ действия препарата Вабисмо®
Препарат Вабисмо® применяют для лечения взрослых с такими заболеваниями, как нВМД и ДМО, поражающими макулу – центральную зону сетчатки (светочувствительного слоя, расположенного в задней части глаза), которая отвечает за четкое, центральное зрение.
Заболевание нВМД развивается вследствие роста аномальных кровеносных сосудов, из которых происходит просачивание крови и жидкости в макулу, а ДМО развивается в связи с просачиванием крови из кровеносных сосудов, которая приводит к отеку макулы.
Препарат Вабисмо® специфически распознает и блокирует активность белков ангиопоэтина-2 и фактора роста эндотелия сосудов А. Когда концентрации этих белков превышают норму, они могут вызывать рост аномальных кровеносных сосудов и/или повреждение нормальных сосудов, с последующим просачиванием из них крови и жидкости в сетчатку, что приводит к отеку сетчатки или повреждению слоев сетчатки и может негативно повлиять на зрение человека.
Связываясь с этими белками, препарат Вабисмо® может блокировать их действие и предотвращать рост аномальных сосудов и/или повреждение нормальных сосудов, а также просачивание из них крови и жидкости, и развитие отека. Препарат Вабисмо® может уменьшить проявление заболевания и/или замедлить его ухудшение, что позволяет сохранить или даже улучшить Ваше зрение.
Показания к применению
Препарат Вабисмо® показан к применению у взрослых в возрасте старше 18 лет при неоваскулярной (влажной) форме возрастной макулярной дегенерации (нВМД) и диабетическом макулярном отеке (ДМО).
Если улучшение не наступило или Вы чувствуете ухудшение, необходимо обратиться к лечащему врачу.
2. О чем следует знать перед применением препарата Вабисмо®
Противопоказания
Не применяйте препарат Вабисмо®, если у Вас:
- аллергия на фарицимаб или любые другие компоненты препарата (перечисленные в разделе 6 листка-вкладыша);
- активная инфекция или подозрение на инфекцию глаза или вокруг глаза;
- боль в глазу или покраснение глаза (воспаление глаза).
Если что-либо из вышеперечисленного относится к Вам, сообщите лечащему врачу. Вам не следует применять препарат Вабисмо®.
Особые указания и меры предосторожности
Перед применением препарата Вабисмо® проконсультируйтесь с лечащим врачом, если у Вас:
- глаукома (заболевание глаз, обычно вызываемое высоким давлением в глазу);
- возникали вспышки света (молнии) или мушки (темные плавающие пятна) перед глазами, а также если у Вас произошло внезапное увеличение размера и количества мушек перед глазами;
- была операция глаза в течение последних четырех недель или если операция глаза планируется в течение следующих четырех недель;
- когда-либо были любые заболевания глаз или Вы получали препараты для лечения глаз.
Немедленно сообщите лечащему врачу, если у Вас:
- произошла внезапная потеря зрения;
- возникли признаки возможной инфекции или воспаления глаза, такие как усиление покраснения глаза, боль в глазу, усиление дискомфорта в глазу, затуманивание или ухудшение зрения, увеличение количества мелких частиц в Вашем поле зрения, повышенная чувствительность к свету (светобоязнь).
Помимо этого, Вам важно знать о том, что:
- безопасность и эффективность препарата Вабисмо® при одновременном введении в оба глаза не были изучены, и такое введение может привести к повышенному риску возникновения нежелательных реакций;
- введение препарата Вабисмо® может вызывать временное повышение внутриглазного давления у некоторых пациентов в течение 60 минут после инъекции; врач будет следить за внутриглазным давлением после каждой инъекции;
- врач будет проверять, имеются ли у Вас другие факторы риска, которые могут увеличить вероятность разрыва или отслоения одного из слоев в задней стенке глаза (отслойка или разрыв сетчатки, отслоение или разрыв пигментного эпителия сетчатки), поскольку в таких случаях препарат Вабисмо® следует применять с осторожностью.
Системное применение ингибиторов фактора роста эндотелия сосудов – препаратов, аналогичных Вабисмо® – может быть связано с риском возникновения сгустков крови, блокирующих кровеносные сосуды (артериальные тромбоэмболические явления), что может привести к сердечному приступу (инфаркту миокарда) или инсульту. Существует теоретический риск возникновения таких явлений после введения препарата Вабисмо® в глаз.
Дети и подростки
Применение препарата Вабисмо® у детей и подростков не изучалось, поскольку такие заболевания как нВМД и ДМО встречаются в основном у взрослых.
Другие препараты и препарат Вабисмо®
Сообщите лечащему врачу о том, что Вы принимаете, недавно принимали или можете начать принимать какие-либо другие препараты.
Беременность и грудное вскармливание
Если Вы беременны или кормите грудью, думаете, что забеременели, или планируете беременность, перед началом применения препарата проконсультируйтесь с лечащим врачом.
Беременность
Применение препарата Вабисмо® у беременных женщин не изучали. Препарат Вабисмо® не следует применять во время беременности, за исключением случаев, когда потенциальная польза для матери превышает возможный риск для нерожденного ребенка.
Грудное вскармливание
Грудное вскармливание не рекомендуется во время лечения препаратом Вабисмо®, поскольку неизвестно, проникает ли препарат Вабисмо® в грудное молоко. Перед началом лечения препаратом Вабисмо® проконсультируйтесь с лечащим врачом.
Контрацепция
Женщины, которые могут забеременеть, должны использовать эффективный метод контрацепции во время лечения и в течение, как минимум, трех месяцев после прекращения лечения препаратом Вабисмо®. Если Вы забеременели или у Вас возникло подозрение, что Вы беременны, во время лечения, немедленно сообщите об этом лечащему врачу.
Управление транспортными средствами и работа с механизмами
После введения препарата Вабисмо® у Вас могут возникнуть временные проблемы со зрением (например, затуманивание зрения). Не управляйте транспортными средствами и не работайте с механизмами до тех пор, пока эти проблемы не разрешатся.
3. Применение препарата Вабисмо®
Всегда принимайте препарат в полном соответствии с рекомендациями лечащего врача. При появлении сомнений проконсультируйтесь с лечащим врачом.
Рекомендуемая доза
Рекомендуемая доза препарата составляет 6 мг фарицимаба.
Частоту проведения инъекций определит лечащий врач.
нВМД
Вы будете получать одну инъекцию препарата каждые 4 недели в течение первых 3 месяцев (0, 4, 8, 12 неделя лечения).
После этого Вы можете получать инъекции реже, до одного раза в 4 месяца. Лечащий врач определит частоту введения препарата в зависимости от состояния Вашего глаза.
ДМО
Вы будете получать одну инъекцию препарата каждые 4 недели в течение первых 3 месяцев (0, 4, 8, 12 неделя лечения).
После этого Вы можете получать инъекции реже, до одного раза в 4 месяца. Лечащий врач определит частоту введения препарата в зависимости от состояния Вашего глаза.
Путь и (или) способ введения
Препарат Вабисмо® вводится путем инъекции в глаз (внутриглазное введение), которую должен осуществлять врач, имеющий опыт проведения такого рода процедур. Внутриглазное введение препарата проводится в условиях операционной.
Перед введением лечащий врач промоет Ваши глаза специальной дезинфицирующей жидкостью, чтобы тщательно очистить глаза для предотвращения возникновения инфекции. Лечащий врач закапает Вам глазные капли (местный анестетик), чтобы обезболить глаз, с целью уменьшения или предотвращения боли от инъекции.
Продолжительность лечения
Это длительное лечение, которое может продолжаться в течение нескольких месяцев или лет. Лечащий врач будет регулярно контролировать Ваше состояние, чтобы удостовериться в эффективности лечения. В зависимости от Вашей реакции на лечение препаратом Вабисмо® лечащий врач может предложить Вам перейти на более или менее частое введение препарата.
Если Вы забыли применить препарат Вабисмо®
Если Вы пропустили введение дозы препарата Вабисмо®, запишитесь на новый прием к врачу как можно скорее.
Если Вы прекратили применение препарата Вабисмо®
Перед прекращением применения препарата Вабисмо® проконсультируйтесь с лечащим врачом. Прекращение лечения может увеличить риск потери и ухудшения зрения.
При наличии вопросов по применению препарата обратитесь к лечащему врачу.
4. Возможные нежелательные реакции
Подобно всем лекарственным препаратам препарат может вызывать нежелательные реакции, однако они возникают не у всех.
Нежелательные реакции при применении препарата Вабисмо® связаны либо с самим лекарственным препаратом, либо с процедурой инъекции, и в основном влияют на глаз. Некоторые нежелательные реакции могут быть серьезными.
Немедленно обратитесь к лечащему врачу в случае, если у Вас появляются любые из следующих нежелательных реакций.
Очень часто – могут возникать у более чем 1 человека из 10:
- помутнение хрусталика глаза: размытое или затуманенное зрение, нарушение восприятия цветов, свечение вокруг ярких предметов, трудности при чтении мелкого шрифта, трудности в подборе подходящих очков (катаракта).
Часто – могут возникать не более чем у 1 человека из 10:
- внезапное ухудшение или изменение зрения: вспышки яркого света, движущиеся мушки или темные зоны в поле зрения, ощущение пелены перед глазами (разрыв сетчатки (слой в задней части глаза, который улавливает свет) или одного из ее слоев).
Нечасто – могут возникать не более чем у 1 человека из 100:
- боль в глазу, усиление дискомфорта в глазу, усиление покраснения глаз, затуманивание или ухудшение зрения, большее количество мелких частиц в Вашем поле зрения или повышенная чувствительность к свету – все эти признаки указывают на возможную инфекцию или воспаление глаза (увеит, витреит, эндофтальмит).
Редко – могут возникать не более чем у 1 человека из 1000:
- внезапное ухудшение или изменение зрения: вспышки яркого света, движущиеся мушки или темные зоны в поле зрения, ощущение пелены перед глазами (регматогенная отслойка сетчатки).
Прочие нежелательные реакции
Прочие нежелательные реакции, которые могут возникать при применении препарата Вабисмо®, перечислены ниже.
Большинство нежелательных реакций имеют легкую или среднюю степень и обычно исчезают в течение недели после каждой инъекции препарата.
Обратитесь к лечащему врачу, если любой из следующих побочных эффектов станет тяжелым.
Часто – могут возникать не более чем у 1 человека из 10:
- повышение давления внутри глаза (повышенное внутриглазное давление);
- кровотечение из мелких кровеносных сосудов внешнего слоя глаза (субконъюнктивальное кровоизлияние);
- движущиеся мушки или темные зоны в поле зрения (плавающие помутнения стекловидного тела);
- боль в глазу.
Нечасто – могут возникать не более чем у 1 человека из 100:
- воспаление радужной оболочки и прилегающих к ней тканей глаза (ирит, иридоциклит);
- снижение остроты зрения (снижение остроты зрения или затуманивание зрения);
- кровотечение внутри глаза (кровоизлияние в стекловидное тело);
- царапины на роговице, повреждение прозрачного слоя глазного яблока, покрывающего радужную оболочку (эрозия роговицы);
- раздражение глаза;
- дискомфорт в глазу;
- зуд (зуд в глазу);
- повышенная выработка слезной жидкости (слезотечение);
- покраснение глаза (конъюнктивальная инъекция);
- ощущение инородного тела в глазу.
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с лечащим врачом, работником аптеки или медицинской сестрой. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях в информационную базу данных по нежелательным реакциям (действиям) на лекарственные препараты, включая сообщения о неэффективности лекарственных препаратов, выявленным на территории государства – члена Евразийского экономического союза. Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Российская Федерация
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор)
109012, г. Москва, Славянская площадь, д. 4, стр. 1
www.roszdravnadzor.gov.ru
5. Хранение препарата Вабисмо®
- Храните препарат в недоступном для ребенка месте так, чтобы ребенок не мог увидеть его.
- Не применяйте препарат после истечения срока годности (срока хранения), указанного на картонной пачке и этикетке флакона после слов «Годен до». Датой истечения срока годности является последний день данного месяца.
- Хранить при температуре 2-8 °С в картонной пачке для защиты от света.
- Не замораживать.
- Не встряхивать.
- Перед применением невскрытый флакон препарата Вабисмо® может оставаться вне холодильника при комнатной температуре 20-25 °С до 24 часов.
- Препарат предназначен только для однократного применения. Не выбрасывайте (не выливайте) препарат в канализацию. Уточните у работника аптеки, как следует утилизировать (уничтожать) препарат, который больше не потребуется. Эти меры позволят защитить окружающую среду.
6. Содержимое упаковки и прочие сведения
Препарат Вабисмо® содержит
- Действующим веществом является фарицимаб. Каждый мл раствора содержит 120 мг фарицимаба. Каждый флакон содержит 6 мг фарицимаба в 0.05 мл раствора.
- Прочими ингредиентами (вспомогательными веществами) являются L-гиетидин, L-метионин, натрия хлорид, D-сахароза, Полисорбат 20, уксусная кислота 30%, вода для инъекций.
Внешний вид препарата Вабисмо® и содержимое его упаковки
Препарат Вабисмо® представляет собой стерильную, не содержащую консервантов, жидкость от прозрачной до опалесцирующей, от бесцветной до коричневато-желтого цвета.
По 6 мг/0.05 мл препарата во флакон бесцветного стекла (гидролитический класс 1 ЕФ), укупоренный пробкой из бутилкаучука, ламинированного фторполимером, обжатый алюминиевым колпачком и закрытый пластмассовой крышкой.
1 флакон с препаратом вместе с 1 иглой с фильтром и листком-вкладышем помещают в картонную пачку.
Держатель регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 24, 4070 Basel, Switzerland
Производатель/Выпускающий контроль качества
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Wurmisweg, 4303 Kaiseraugst, Switzerland
За любой информацией о препарате, а также в случаях возникновения претензий, следует обращаться к местному представителю держателя регистрационного удостоверения
Российская Федерация
АО «Рош-Москва»
107031, г. Москва, Трубная площадь, д. 2, помещение 1, этаж 1, комната 42
www.roche.ru
Листок-вкладыш пересмотрен
Прочие источники информации
Подробные сведения о препарате содержатся на веб-сайте Союза
еес.eaeunion.org.
Следующие сведения предназначены исключительно для медицинских работников
Перед тем, как Вы начнете
- Внимательно прочитайте все инструкции перед применением препарата Вабисмо®.
- Стеклянный флакон с препаратом Вабисмо® предназначен только для однократного применения.
- Препарат Вабисмо® следует хранить в холодильнике при температуре 2-8 °С.
Не замораживать.
Не встряхивать. - Оставьте препарат Вабисмо® для достижения комнатной температуры (20-25 °С) перед подготовкой к введению. Флакон следует хранить в картонной пачке для защиты от света.
- Флакон с препаратом Вабисмо® можно хранить при комнатной температуре до 24 часов.
- Флакон с препаратом Вабисмо® следует визуально осмотреть перед введением. Препарат Вабисмо® представляет собой жидкость от прозрачной до опалесцирующей, от бесцветной до коричневато-желтого цвета.
Не применяйте препарат, если видны частицы, помутнение или изменение цвета.
Не применяйте препарат, если картонная пачка и/или флакон повреждены, вскрыты или срок годности препарата истек (см. Рис. А). - При подготовке препарата Вабисмо® к введению всегда необходимо соблюдать надлежащие правила асептики.
Инструкции по применению препарата
1. Подготовьте следующие материалы.
- Один флакон препарата Вабисмо®.
- Одна стерильная игла для переноса препарата с тупым наконечником и фильтром с размером пор 5 мкм, калибра 18×1½ дюйма, 1.2 мм × 40 мм.
- Один стерильный шприц объемом 1 мл с люэровским наконечником, с отметкой дозы на уровне 0.05 мл.
- Одна стерильная инъекционная игла, калибра 30×½ дюйма.
Обратите внимание, что рекомендуется использовать инъекционную иглу 30-го калибра во избежание увеличения силы введения, которое может возникнуть при использовании игл меньшего диаметра. - Спиртовая салфетка.
2. После извлечения из упаковки поместите флакон в прямом вертикальном положении на плоскую поверхность (примерно на 1 минуту), чтобы весь препарат осел на дне флакона (см. рис. В).
3. Удалите съемный обжимной колпачок е флакона (см. рис. С) и протрите пробку флакона спиртовой салфеткой (см. рис. D).
4. Соблюдая правила асептики, надежно присоедините иглу для переноса препарата, калибра 18×1½ дюйма, к шприцу объемом 1 мл с люэровским наконечником (см. рис. Е).
5. Соблюдая правила асептики, вставьте иглу для переноса препарата с фильтром в центр пробки флакона (см. рис. F), нажмите до упора, затем слегка наклоните флакон так, чтобы игла коснулась нижнего края флакона (см. рис. G).
6. Удерживая флакон в слегка наклоненном положении, медленно удалите весь препарат из флакона (см. рис. Н). Срез иглы для переноса препарата с фильтром удерживайте погруженным в препарат во избежание попадания воздуха.
7. Убедитесь, что шток поршня в достаточной степени отведен назад при извлечении содержимого флакона, чтобы впоследствии полностью опустошить иглу для переноса препарата с фильтром (см. рис. Н).
8. Отсоедините иглу для переноса препарата с фильтром от шприца и утилизируйте ее в установленном порядке.
Не используйте иглу для переноса препарата с фильтром для внутриглазного введения.
9. Соблюдая правила асептики, надежно присоедините иглу для инъекции, калибра 30×½ дюйма, к шприцу с люэровеким наконечником (см. рис. I).
10. Аккуратно снимите пластиковый колпачок с иглы, потянув за него.
11. Для проверки наличия пузырьков воздуха держите шприц иглой вверх. При наличии пузырьков воздуха следует аккуратно постучать пальцем по шприцу, пока пузырьки не всплывут наверх (см. рис. J).
12. Осторожно выпустите воздух из шприца с иглой, медленно отпуская шток, чтобы привести верхнюю часть каучуковой пробки к отметке дозы на уровне 0.05 мл. Шприц готов к инъекции (см. рис. К). Убедитесь, что введение осуществляется сразу после приготовления дозы.
13. Медленно вводите препарат, пока каучуковая пробка не достигнет наконечника шприца, для доставки объема 0.05 мл. Подтвердите доставку полной дозы посредством проверки того, что каучуковая пробка достигла наконечника цилиндра шприца.
Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
*Цены в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Новый препарат для лечения влажной формы макулодистрофии и диабетического макулярного отёка Вабисмо, который появился в России в 2023 году.[1]
Вабисмо производится швейцарской компанией «Рош» (Roche) и в английском варианте название звучит как «Вобайзмо», действующее вещество – фарицимаб и вводится этот препарат внутрь глаза, в стекловидное тело с помощью интравитреальной инъекции (ИВВ).
Рис.1 Внешний вид упаковки препарата
Показания
Показаниями для применения служат два диагноза – неоваскулярная форма возрастной макулодистрофии (ВМД) и диабетический макулярный отёк (ДМО).[2]
Как работает препарат
В здоровом глазу кровеносные сосуды питают ткани без нарушения их проницаемости. При влажной макулодистрофии и диабетическом отёке появляется 2 типа белков, которые называются фактор роста эндотелия сосудов (VEGF) и ангиопоэтин-2 (ang-2).[3]
Когда концентрации этих белков превышают норму, они вызывают рост аномальных кровеносных сосудов и повреждение нормальных, с последующим просачиванием из них крови и жидкости в сетчатку, что приводит к отеку и повреждению ткани, потере зрения.
Текущие препараты в основном нацелены только на блокировку VEGF, они так и называются anti-VEGF. Вабисмо — это первое и единственное на сегодняшний день средство, предназначенное для блокирования обоих типов белков, чтобы помочь уменьшить рост аномальных кровеносных сосудов, просачивание и отёк.
По утверждению производителя, промежуток между уколами, может быть, до 4-х месяцев. Но не сразу, а только после первых 4-х загрузочных доз, которые вводятся с промежутком в 4 недели (месяц). Дальше ваш лечащий врач оценивает оптимальный срок до следующей инъекции по данным оптической когерентной томографии сетчатки (ОКТ).
Рис.2 ОКТ сетчатки до (слева) и после (справа) инъекции фарицимаба: уменьшение устойчивого к лечению отёка (субретинальной жидкости) на 140 мкм.
Эффективность
Если обратиться к исследованиям, можно заметить особенность – очень многие из них проводились на пациентах, у которых была устойчивость ДМО или влажной ВМД к лечению ранибизумабом (Луцентис) или афлиберцептом (Эйлеа).[4,5] В них показано уменьшение отёка, увеличение остроты зрения и расширение интервалов между введениями.
График 1. Сравнение прибавки остроты зрения при использовании Вабисмо и афлиберцепта (Эйлеа), исследование TENAYA (NCT03823287)
Таким образом у нас появился инструмент, который обнадёживает пациентов, которые применяют имеющиеся недешёвые препараты, но не видят эффекта.
Противопоказания
Противопоказания стандартные – возраст до 18 лет, воспалительные заболевания глаз и аллергия на фарицимаб.[2] Но вряд ли кто-то в своей жизни уже использовал этот новый препарат в других обстоятельствах и знает о его непереносимости.
Видео нашего специалиста о препарате
Стоимость инъекции
Цена интравитреальной инъекции Вабисмо (в условиях стерильной операционной) — 140 000 рублей.
Список использованных источников
- Регистрационное удостоверение ЛП-(001664)-(РГ-RU) от 13.01.2023.
- Инструкция по медицинскому применению препарата Вабисмо® (фарицимаб).
- Heier JS, et al. Efficacy, durability and safety of intravitreal faricimab up to every 16 weeks for neovascular age-related macular degeneration (TENAYA and LUCERNE): Two randomised, double-masked, phase III, non-inferiority trials. The Lancet. 2022;399(10326):741-755,
- Ohara H, Harada Y, Hiyama T, Sadahide A, Minamoto A, Kiuchi Y. Faricimab for Diabetic Macular Edema in Patients Refractory to Ranibizumab or Aflibercept. Medicina (Kaunas). 2023 Jun 11;59(6):1125. doi: 10.3390/medicina59061125. PMID: 37374329; PMCID: PMC10302733.
- Inoda S, Takahashi H, Takahashi R, Hashimoto Y, Yoshida H, Takahashi H, Takayama T, Kawashima H, Yanagi Y. Visual and Anatomical Outcomes After Initial Intravitreal Faricimab Injection for Neovascular Age-Related Macular Degeneration in Patients with Prior Treatment History. Ophthalmol Ther. 2023 Oct;12(5):2703-2712. doi: 10.1007/s40123-023-00779-w. Epub 2023 Aug 2. PMID: 37531030; PMCID: PMC10441946.
На сайте справочной системы Фарминдекс.рф вы можете узнать, в каких аптеках и интернет-аптеках России можно приобрести ВАБИСМО, а также сравнить цены в аптеках.
Лекарственный препарат подлежит дополнительному мониторингу, который способствует быстрому выявлению новых сведений о безопасности. Вы можете помочь, сообщая информацию о любых нежелательных реакциях, которые возникли в период применения лекарственного препарата (в том числе и о случаях его неэффективности).
Описание
Препарат Вабисмо® содержит действующее вещество фарицимаб, который принадлежит к антинеоваскуляризационным препаратам (то есть препятствует росту аномальных кровеносных сосудов).
Препарат Вабисмо® применяют для лечения взрослых с такими-заболеваниями, как нВМД и ДМО, поражающими макулу — центральную зону сетчатки (светочувствительного слоя, расположенного в задней части глаза), которая отвечает за чёткое, центральное зрение. Заболевание нВМД развивается вследствие роста аномальных кровеносных сосудов, из которых происходит просачивание крови и жидкости в макулу, а ДМО развивается в связи с просачиванием крови из кровеносных сосудов, которая приводит к отеку макулы. Препарат Вабисмо® специфически распознает и блокирует активность белков ангиопоэтина-2 и фактора роста эндотелия сосудов А. Когда концентрации этих белков превышают норму, они могут вызывать рост аномальных кровеносных сосудов и/или повреждение нормальных сосудов, с последующим просачиванием из них крови и жидкости в сетчатку, что приводит к отеку сетчатки или повреждению слоёв сетчатки и может негативно повлиять на зрение человека.
Связываясь с этими белками, препарат Вабисмо® может блокировать их действие и предотвращать рост аномальных сосудов и/или повреждение нормальных сосудов, а также просачивание из них крови и жидкости, и развитие отёка. Препарат Вабисмо® может уменьшить проявление заболевания и/или замедлить его ухудшение, что позволяет сохранить или даже улучшить Ваше зрение.
Показания к применению
Препарат Вабисмо® показан к применению у взрослых в возрасте старше 18 лет при неоваскулярной (влажной) форме возрастной макулярной дегенерации (нВМД) и диабетическом макулярном отёке (ДМО).
Если улучшение не наступило или Вы чувствуете ухудшение, необходимо обратиться к лечащему врачу.
Противопоказания
Не применяйте препарат Вабисмо®, если у вас:
аллергия на фарицимаб или любые другие компоненты препарата (перечисленные в разделе 6 листка-вкладыша);
активная инфекция или подозрение на инфекцию глаза или вокруг глаза;
боль в глазу или покраснение глаза (воспаление глаза).
Если что-либо из вышеперечисленного относится к вам, сообщите лечащему врачу. Вам не следует применять препарат Вабисмо®.
Особые указания и меры предосторожности
Перед применением препарата Вабисмо® проконсультируйтесь с лечащим врачом, если у вас:
глаукома (заболевание глаз, обычно вызываемое высоким давлением в глазу);
возникали вспышки света (молнии) или мушки (тёмные плавающие пятна) перед глазами, а также если у Вас произошло внезапное увеличение размера и количества мушек перед глазами;
была операция глаза в течение последних четырёх недель или если операция глаза планируется в течение следующих четырёх недель;
когда-либо были любые заболевания глаз или вы получали препараты для лечения глаз.
Немедленно сообщите лечащему врачу, если у вас:
произошла внезапная потеря зрения;
возникли признаки возможной инфекции или воспаления глаза, такие как усиление покраснения глаза, боль в глазу, усиление дискомфорта в глазу, затуманивание или ухудшение зрения, увеличение количества мелких частиц в вашем поле зрения, повышенная чувствительность к свету (светобоязнь).
Помимо этого, вам важно знать о том, что:
безопасность и эффективность препарата Вабисмо® при одновременном введении в оба глаза не были изучены, и такое введение может привести к повышенному риску возникновения нежелательных реакций;
введение препарата Вабисмо® может вызывать временное повышение внутриглазного давления у некоторых пациентов в течение 60 минут после инъекции; врач будет следить за внутриглазным давлением после каждой инъекции;
врач будет проверять, имеются ли у Вас другие факторы риска, которые могут увеличить вероятность разрыва или отслоения одного из слоёв в задней стенке глаза (отслойка или разрыв сетчатки, отслоение или разрыв пигментного эпителия сетчатки), поскольку в таких случаях препарат Вабисмо® следует применять с осторожностью.
Системное применение ингибиторов фактора роста эндотелия сосудов — препаратов, аналогичных Вабисмо® — может быть связано с риском возникновения сгустков крови, блокирующих кровеносные сосуды (артериальные тромбоэмболические явления), что может привести к сердечному приступу (инфаркту миокарда) или инсульту. Существует теоретический риск возникновения таких явлений после введения препарата Вабисмо® в глаз.
Дети и подростки
Применение препарата Вабисмо® у детей и подростков не изучалось, поскольку такие заболевания как нВМД и ДМО встречаются в основном у взрослых.
Другие препараты и препарат Вабисмо®
Сообщите лечащему врачу о том, что вы принимаете, недавно принимали или можете начать принимать какие-либо другие препараты.
Применение препарата Вабисмо
Всегда принимайте препарат в полном соответствии с рекомендациями лечащего врача. При появлении сомнений проконсультируйтесь с лечащим врачом.
Рекомендуемая доза
Рекомендуемая доза препарата составляет 6 мг фарицимаба.
Частоту проведения инъекций определит лечащий врач.
*информация о лекарственных препаратах предназначена только для медицинских и фармацевтических работников
Главное
«Вабисмо» (Vabysmo, фарицимаб) — новый лекарственный препарат, предназначенный для лечения пациентов с неоваскулярной (влажной) возрастной макулодистрофией (nAMD) или диабетическим макулярным отеком (DME).
«Вабисмо», разработанный «Рош» (Roche), одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).
Европейское агентство по лекарственным средствам (EMA) продолжает изучение регистрационного досье фарицимаба (faricimab).
Ключевое маркетинговое преимущество «Вабисмо» перед другими лекарственными средствами, широко применяемыми в офтальмологической практике указанных заболеваний, заключено в возможности более редкого дозирования. Схема назначения фарицимаба предполагает несколько нагрузочных доз ежемесячно с последующими дозами препарата каждые 2, 3 или 4 месяца; интервал зависит от особенностей активности заболевания и фиксирования должного терапевтического эффекта. С учетом того, что все подобные препараты назначаются внутриглазными инъекциями (интравитреально), менее частое использование «Вабисмо» окажет меньший травмирующий эффект на органы зрения. В итоге пациенты охотнее будут придерживаться лечения, что отразится должным сдерживанием прогрессирования заболевания.
«Вабисмо»: механизм действия фарицимаба
Фарицимаб (faricimab, RG7716, RO6867461) — биспецифическое моноклональное антитело, связывающее и инактивирующее одновременно фактор роста эндотелия сосудов A (VEGF-A) и ангиопоэтин-2 (Ang2).
Ингибирование VEGF-A отражается подавлением пролиферации эндотелиальных клеток, неоваскуляризации, проницаемости сосудов. Ингибирование Ang2 способствует стабильности сосудов и их десенсибилизации к действию VEGF-A.
Применяемый интравитреально фарицимаб разработан «Дженентек» (Genentech) в составе «Рош», и японской «Шугай фармасьютикал» (Chugai Pharmaceutical), в которой швейцарскому фармацевтическому гиганту принадлежит мажоритарная доля.
«Вабисмо»: эффективность фарицимаба для лечения неоваскулярной возрастной макулодистрофии
Идентичные по дизайну клинические исследования TENAYA (NCT03823287) и LUCERNE (NCT03823300) фазы III (рандомизированные, двойные слепые, с активным препаратом сравнения, многоцентровые, международные) пригласили взрослых (50 лет и старше) пациентов (n=1329) с ранее нелеченной хориоидальной неоваскуляризацией, вторичной к неоваскулярной возрастной макулодистрофии.
Участникам назначали фарицимаб (каждые 2, 3 или 4 месяца после 4 ежемесячных нагрузочных доз) или афлиберцепт (каждые 2 месяца после 3 ежемесячных нагрузочных доз).
После 48-недельного лечения зафиксировано, что 45% пациентам в группе «Вабисмо» был показан, согласно результатам оптической когерентной томографии и оценке остроты зрения, 4-месячный интервал между дозами препарата, 33% испытуемым — 3-месячный, оставшимся 22% — 2-месячный. Это, впрочем, не означает, что подобное пропорциональное распределение режима дозирования фарицимаба окажется безусловно справедливым в клинической практике: всё зависит от особенностей течения заболевания у каждого конкретного пациента.
Первичная конечная точка эффективности лечения была установлена изменением остроты зрения с максимальной коррекцией (BCVA), усредненным за 40, 44 и 48 недель терапии, согласно шкале Группы по изучению эффективности раннего лечения диабетической ретинопатии (ETDRS).
Выяснилось, что «Вабисмо» оказался не хуже «Эйлеа»: соответственно в TENAYA и LUCERNE усредненное изменение BCVA составило 5,8 (95% ДИ: 4,6–7,1) и 6,6 (95% ДИ: 5,3–7,8) литер в группах фарицимаба — против 5,1 (95% ДИ: 3,9–6,4) и 6,6 (95% ДИ: 5,3–7,8) литер в группах афлиберцепта.
«Вабисмо»: эффективность фарицимаба для лечения диабетического макулярного отека
Идентичные по дизайну клинические исследования YOSEMITE (NCT03622580) и RHINE (NCT03622593) фазы III (рандомизированные, двойные слепые, с активным препаратом сравнения, многоцентровые, международные) пригласили взрослых (18 лет и старше) пациентов (n=1891) с утолщением макулы (желтого пятна), вторичным к диабетическому макулярному отеку и затрагивающим центр фовеальной зоны сетчатки.
У пациентов должен был быть сахарный диабет 1-го или 2-го типа (уровень гликированного гемоглобина [HbA1c] ≤ 10%), а снижение остроты зрения — связано в первую очередь с диабетическим макулярным отеком.
Участникам назначали фарицимаб (либо каждые 2 месяца после 6 ежемесячных нагрузочных доз, либо каждые 2, 3 или 4 месяца после 4 ежемесячных нагрузочных доз) или афлиберцепт (каждые 2 месяца после 5 ежемесячных нагрузочных доз).
Первичная конечная точка эффективности лечения была установлена изменением остроты зрения с максимальной коррекцией (BCVA), усредненным за 48, 52 и 56 недель терапии, согласно шкале Группы по изучению эффективности раннего лечения диабетической ретинопатии (ETDRS).
Установлено, что «Вабисмо» сработал не хуже «Эйлеа»: соответственно в группах фарицимаба с фиксированной дозой, фарицимаба с вариабельной дозой и афлиберцепта усредненное изменение BCVA составило 10,7 (97,5% ДИ: 9,4–12,0), 11,6 (97,5% ДИ: 10,3–12,9) и 10,9 (97,5% ДИ: 9,6–12,2) [в YOSEMITE], 11,8 (97,5% ДИ: 10,6–13,0), 10,8 (97,5% ДИ: 9,6–11,9) и 10,3 (97,5% ДИ: 9,1–11,4) [в RHINE].
Впоследствии «Рош» раскрыла результаты применения «Вабисмо» на протяжении 2 лет в ходе лечения диабетического макулярного отека:
- Получавшие «Вабисмо» пациенты засвидетельствовали сохранение улучшения зрения, достигнутое после 1 года лечения, притом что это улучшение было нехудшим в сравнении с применением «Эйлеа». Усредненное улучшение зрения в YOSEMITE составило 10,7, 10,7 и 11,4 литер — соответственно в группах фарицимаба с фиксированной дозой, фарицимаба с вариабельной дозой и афлиберцепта, и 10,9, 10,1 и 9,4 литер в RHINE.
- «Вабисмо» обеспечил улучшение минимум на 2 балла, согласно шкале тяжести диабетической ретинопатии Группы по изучению эффективности раннего лечения диабетической ретинопатии (ETDRS-DRSS), у 42,8% и 44,3% испытуемых в YOSEMITE и RHINE соответственно.
- «Вабисмо» лучше, чем «Эйлеа», справился с задачей уменьшения толщины центрального подполя (CST).
- «Вабисмо» назначался один раз в 4 месяца 60% пациентов в YOSEMITE и 64,5% в RHINE при сохранении нехудшей эффективности терапии в сравнении с применением «Эйлеа» один раз 2 месяца.
«Вабисмо»: безопасность фарицимаба
Профиль безопасности «Вабисмо», согласно частоте побочных реакций, в целом не отличался от такового у «Эйлеа». Приблизительно одинаковые пропорции пациентов столкнулись с такими негативными явлениями, связанными с лечением, как кровоизлияние в конъюнктиву, плавающие помутнения в стекловидном теле («мушки»), разрыв пигментного эпителия сетчатки, повышение внутриглазного давления, боль в глазах, внутриглазное воспаление (включая иридоциклит, ирит, увеит, витрит), раздражение глаз, глазной дискомфорт, кровоизлияние в стекловидное тело.
«Вабисмо»: экспертные комментарии
Фарицимаб — потенциальный бестселлер: согласно отраслевым прогнозам, к 2026 году «Вабисмо» может выйти на уровень продаж 2,72 млрд долларов ежегодно.
Следует, однако, понимать, что фарицимаб поступил на изрядно насыщенный рынок ингибиторов фактора роста эндотелия сосудов (VEGF), используемых в лечении влажной возрастной макулодистрофии и диабетического макулярного отека. Среди таких препаратов: «Эйлеа» (Eylea, афлиберцепт), за которым стоят «Ридженерон фармасьютикалс» (Regeneron Pharmaceuticals) и «Байер» (Bayer); «Луцентис» (Lucentis, ранибизумаб), реализуемый «Рош» и «Новартис» (Novartis); «Беову» (Beovu, бролуцизумаб) разработки «Новартис». Офф-лейбл (вне инструкции) применяют противоопухолевый «Авастин» (Avastin, бевацизумаб) всё той же «Рош».
Основным конкурентом «Вабисмо» выступает «Эйлеа», в 2020 году заработавший 8,36 млрд долларов. Более того, во-первых, в 2023 году и 2025-м афлиберцепт потеряет патентную защиту в США и Европе, тем самым распахнув двери для менее дорогостоящих биоаналогичных копий, во-вторых, «Ридженерон» и «Байер» разрабатывают 8-мг рецептуру афлиберцепта (вместо 2-мг) для его применения каждые 4 месяца.
«Рош», осознающая напряженную конкуренцию, установила стоимость лечения американских пациентов в 2190 долларов за дозу «Вабисмо» (цена по прейскуранту, без учета скидок и дисконтов). И потому первый год лечения влажной возрастной макулодистрофии при 4-месячном цикле дозирования «Вабисмо» обойдется в 13140 долларов, последующие годы терапии встанут в 6570 долларов.
Для сравнения: цена одной дозы «Эйлеа» составляет 1940 долларов. Первый год лечения потребует 13580, последующие годы — 11640 долларов.
Тем временем начали появляться биосимиляры «Луцентиса», но «Рош» к этому подготовилась, предложив удобную замену в лице «Сасвимо» (Susvimo, ранибизумаб) — внутриглазного импланта, который однократно устанавливается в глаз хирургическим путем в амбулаторных условиях и который затем пополняется лекарственным средством каждые шесть месяцев.
«Аутлук терапьютикс» (Outlook Therapeutics) готовит препарат «Литенава» (Lytenava, ONS-5010), офтальмологическую версию бевацизумаба. Для справки: оригинальный «Авастин» вне инструкции применяют в половине случаев влажной возрастной макулодистрофии в США.
Австралийская «Оптеа» (Opthea) занимается OPT-302, который блокирует фактор роста эндотелия сосудов C (VEGF-C) и фактор роста эндотелия сосудов D (VEGF-D) и который, если получит регуляторное одобрение, будет назначаться совместно с афлиберцептом или ранибизумабом.
«Кадьяк сайенсиз» (Kodiak Sciences) трудится над KSI-301 — биополимерным конъюгатом антитела против VEGF с интервалом интравитреального дозирования до 6 месяцев.
«Ридженексбайо» (Regenxbio) поставила на генную терапию RGX-314 (фрагмент антитела против VEGF), однократное применение которой навсегда предупредит VEGF-опосредованное образование новых протекающих кровеносных сосудов и накопление жидкости в сетчатке.
Швейцарская «Молекьюлар партнерс» (Molecular Partners) пробует решить вопросы по части безопасности абиципара пегола (abicipar pegol, AGN-150998), относящегося к соединениям из класса DARPin (от англ. designed ankyrin repeat protein, сконструированный белок с анкириновым повтором), таргетированного на VEGF-A и назначаемого раз в квартал.