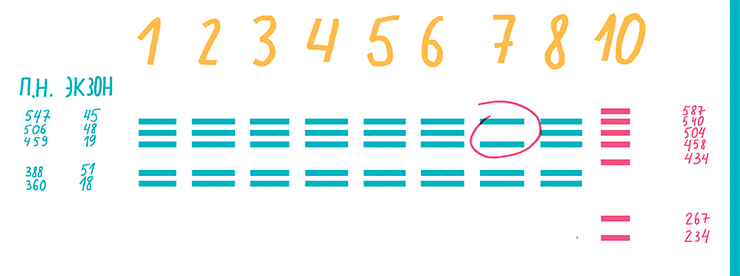Полимеразная цепная реакция почти для каждого из нас стала обыденностью, даже если этот каждый никогда и слов таких не слышал. Медицинские центры наперебой предлагают диагностировать у вас все мыслимые болезни с помощью «ПЦР-анализа». Но задумывались ли вы о том, что это за анализ? как там всё работает? для чего еще применяют ПЦР? и есть ли какие-то альтернативные, менее дорогие, трудоёмкие и, может быть, более эффективные методы анализа? Нет? А мы вам всё равно об этом расскажем…
12 биологических методов в картинках
Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Партнер этой статьи — Bio-Rad
Компания Bio-Rad Laboratories, Inc. USA («Био-Рад», США) является одним из мировых лидеров производства оборудования и реагентов для научных исследований. В рамках взаимодействия с научными, медицинскими, биотехнологическими и образовательными организациями «Био-Рад» предлагает современные технологии, оборудование и реагенты.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Полимеразная цепная реакция (ПЦР, PCR) — метод молекулярной биологии, позволяющий создать копии определенного фрагмента ДНК из исходного образца, повысив его содержание в пробе на несколько порядков.
Изобретение ПЦР полностью и безвозвратно изменило медицину, науку и нашу жизнь в целом. Появилась возможность быстро и эффективно диагностировать наследственные заболевания и инфекции, определять личность преступников по одному волоску и свободно манипулировать генами. Не будь этого уникального метода, человечество вряд ли оказалось бы на пороге эпохи генной терапии.
История метода
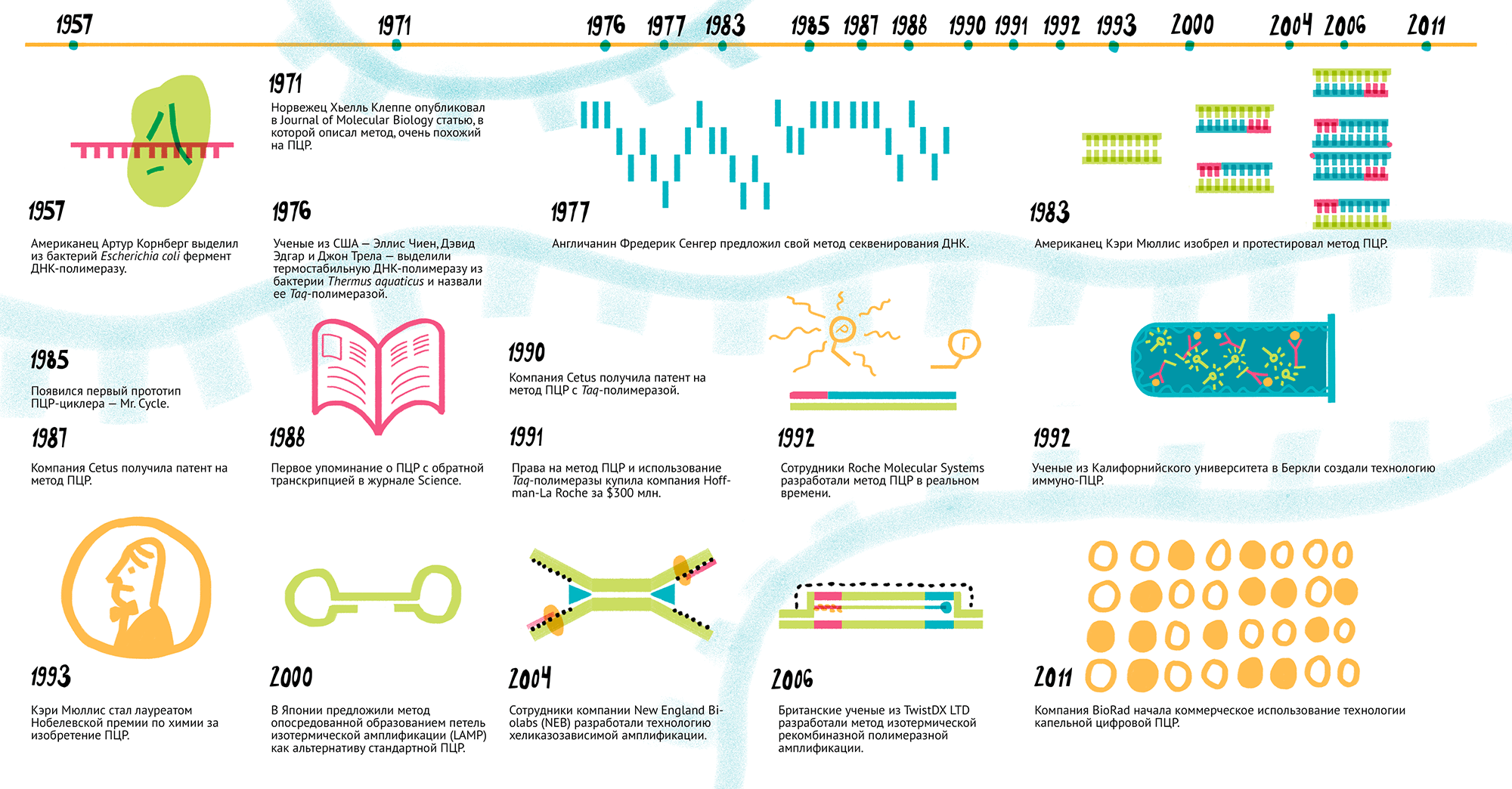
Рисунок 1. История развития метода ПЦР. 1957 г. Американец Артур Корнберг выделил из бактерий Escherichia coli фермент ДНК-полимеразу. 1971 г. Норвежец Хьелль Клеппе опубликовал в Journal of Molecular Biology статью, в которой описал метод, очень похожий на ПЦР. 1976 г. Ученые из США — Эллис Чиен, Дэвид Эдгар и Джон Трела — выделили термостабильную ДНК-полимеразу из бактерии Thermus aquaticus и назвали ее Taq-полимеразой. 1977 г. Англичанин Фредерик Сенгер предложил свой метод секвенирования ДНК. 1983 г. Американец Кэри Мюллис изобрел и протестировал метод ПЦР. 1985 г. Появился первый прототип ПЦР-циклера — Mr. Cycle. 1987 г. Компания Cetus получила патент на метод ПЦР. 1988 г. Первое упоминание о ПЦР с обратной транскрипцией в журнале Science. 1990 г. Компания Cetus получила патент на метод ПЦР с Taq-полимеразой. 1991 г. Права на метод ПЦР и использование Taq-полимеразы купила компания Hoffman-La Roche за $300 млн. 1992 г. Сотрудники Roche Molecular Systems разработали метод ПЦР в реальном времени. 1992 г. Ученые из Калифорнийского университета в Беркли создали технологию иммуно-ПЦР. 1993 г. Кэри Мюллис стал лауреатом Нобелевской премии по химии за изобретение ПЦР. 2000 г. В Японии предложили метод опосредованной образованием петель изотермической амплификации (LAMP) как альтернативу стандартной ПЦР. 2004 г. Сотрудники компании New England Biolabs (NEB) разработали технологию хеликазозависимой амплификации. 2006 г. Британские ученые из TwistDX LTD разработали метод изотермической рекомбиназной полимеразной амплификации. 2011 г. Компания BioRad начала коммерческое использование технологии капельной цифровой ПЦР.
Чтобы увидеть рисунок в полном размере, нажмите на него.
1957 г. Американец Артур Корнберг впервые выделил из бактерий Escherichia coli фермент, который назвал ДНК-полимеразой [1]. Статьи с описанием работы он отправил в Journal of Biological Chemistry, где их отвергли… из-за названия фермента: рецензенты считали, что нужно использовать более точный термин «полидезоксирибонуклеотидполимераза» и что вообще «ДНК» в названии указывает на «генетическую активность» (сущность, составляющую?) фермента, а раз ее нет, то и называть фермент так нельзя [2]. Однако в 1958 году в журнале сменился главный редактор, и статьи наконец увидели свет [3]. А уже в 1959 году Артура Корнберга удостоили Нобелевской премии по физиологии и медицине.
1971 г. Норвежский биохимик Хьелль Клеппе (рис. 2) опубликовал в Journal of Molecular Biology статью, в которой описал метод, очень похожий на ПЦР [4]. С 1968 по 1970 годы Клеппе работал постдоком в Университете Висконсина, в лаборатории Хара Гобинда Кораны — нобелевского лауреата 1968 года за расшифровку генетического кода. Именно в лаборатории знаменитого индийца чуть раньше разработали методики синтеза олигонуклеотидных праймеров — «затравок», необходимых для работы ДНК-полимеразы.
Рисунок 2. Хьелль Клеппе.
Статья, написанная Клеппе в соавторстве с Кораной и посвященная репарационной репликации с помощью ДНК-полимеразы, содержала такие строки: «Можно ожидать, что после охлаждения получатся две структуры, каждая из которых содержит полноразмерную матричную цепь, подобающим образом связанную с праймером. Для завершения процесса репаративной репликации нужно будет добавить ДНК-полимеразу. В результате получатся уже две молекулы исходного дуплекса. Цикл можно повторять, каждый раз добавляя свежую порцию фермента».
К сожалению, эта гипотеза так гипотезой и осталась. Может, Клеппе даже и проводил какие-то эксперименты, но результаты не публиковал.
1976 г. Ученые из США, Эллис Чиен, Дэвид Эдгар и Джон Трела, выделили термостабильную ДНК-полимеразу из бактерии Thermus aquaticus и назвали ее Taq-полимеразой [5]. Этот фермент сохранял активность даже при температурах выше 75 °С.
1977 г. Фредерик Сенгер, английский биохимик и лауреат Нобелевской премии 1958 года за работы по структуре белков [6], предложил метод секвенирования ДНК, сейчас известный как метод Сенгера [7], [8]. Этим он заработал еще одну нобелевскую медаль, в 1980-м, и стал единственным ученым в истории, получившим две «химических» премии [9].
1983 г. Руководитель лаборатории синтеза ДНК в Cetus Corporation (США) Кэри Мюллис (рис. 3) апрельской ночью ехал вдоль побережья из Сан-Франциско в Мендосино, в свой загородный дом. Долгой трехчасовой дорогой он обдумывал отнюдь не проведение выходных, а предстоящий эксперимент по секвенированию ДНК. И тут (по словам Мюллиса) его озарило: он ясно представил процесс амплификации (преумножения) генов, который позже получит название полимеразной цепной реакции.
До работы в Cetus Кэри Мюллис изучал химию в Технологическом институте Джорджии, затем биохимию в Калифорнийском университете в Беркли, а после работал постдоком в Калифорнийском университете Сан-Франциско по направлению «фармацевтическая химия». В 1979 году его пригласили в Cetus синтезировать праймеры для секвенирования, а уже через два года Мюллис возглавил лабораторию синтеза ДНК и автоматизировал производство олигонуклеотидов [10].
Рисунок 3. Кэри Мюллис.
В 1983 году Мюллис участвовал в проекте по изучению серповидноклеточной анемии. Чтобы проанализировать мутации, биологи проводили секвенирование по Сэнгеру, где используется один праймер для синтеза по одной из цепей ДНК. На серпантине по пути в Мендосино Мюллис предположил, что данные будут точнее, если использовать два праймера — для синтеза одновременно по двум цепям. Тогда можно будет сравнить получившиеся фрагменты и исключить неточности. И вот тут-то неожиданное прозрение заставило его вздрогнуть: если повторить цикл несколько раз, то можно получить множество копий нужного фрагмента строго определенной длины — она будет ограничена праймерами, от концов которых навстречу друг другу и будут строиться новые цепи ДНК [11]!
Вернувшись в понедельник в Cetus, Кэри Мюллис сразу направился в библиотеку, где попросил одного из сотрудников найти всю литературу о ДНК-полимеразе. В результате он не обнаружил ничего, касающегося амплификации. Это утверждение — самое слабое место во всей истории, так как в собранной библиотекарем стопке статей просто не могло не быть работы Хьелля Клеппе.
За следующие полгода Мюллис провел два эксперимента для проверки своей гипотезы, но безуспешно. Тогда он предположил, что отрицательный результат связан с большим размером ДНК-матрицы, используемой в опытах, и решил продолжить работу с маленьким вектором pBR322, в который вставил намножаемый ген. И 16 декабря 1983 года Мюллис впервые увидел вожделенные, хоть и слабые, полосы в геле для детекции. Однако другие сотрудники и руководство Cetus не разделили радости Мюллиса: их всё это попросту не интересовало [10].
1984 г. На ежегодной конференции корпорации Cetus в калифорнийском Монтерее Кэри Мюллис представил плакат, рассказывающий об амплификации гена β-глобина. К удивлению автора, и на этот раз его работу обошли вниманием [10].
Чуть позже Мюллису удалось кое-как убедить корпоративных боссов в важности его экспериментов: Cetus, как и многие начинающие компании, вкладывала ресурсы только в те проекты, что сулили прибыль в краткосрочной перспективе. Его освободили от обязанностей главы лаборатории и дали год на исследования ПЦР. И эти эксперименты завершились успешно [10].
1985 г. Мюллис и его группа разработчиков подали заявку на патент, который утвердили 28 июля 1987 года. В том же 1985-м в Cetus начали использовать для ПЦР термостабильную Taq-полимеразу, что значительно упростило работу: раньше перед каждым новым синтетическим циклом в смесь надо было добавлять новую порцию фермента, потому что он быстро выходил из строя от высоких температур. В декабре 1985 года журнал Science опубликовал первую статью Кэри Мюллиса о ПЦР [12].
Тогда же открылось совместное предприятие PerkinElmer Cetus Instruments (PECI), которое выпустило первый прототип ПЦР-циклера — Mr. Cycle (рис. 4). И только в 1987 году в продажу поступил первый общедоступный прибор, PCR-1000 Thermal Cycler.
Рисунок 4. Mr. Cycle — первый прототип ПЦР-амплификатора.
1986 г. Корпорация Cetus выплатила Кэри Мюллису премию $10 000. Остальные члены его группы получили по символическому доллару. Это обострило и так напряженные отношения в коллективе. Осенью Мюллис покинул компанию [13].
После ухода из Cetus он два года возглавлял молекулярно-биологический отдел в Xytronyx, а в 1992-м открыл компанию по продаже ювелирных изделий с амплифицированной ДНК знаменитостей — Элвиса Пресли, Мэрилин Монро и т.п. [14].
В 1993 году Кэри Мюллис стал лауреатом Нобелевской премии по химии за изобретение ПЦР. Его награждение — до сих пор больной вопрос для норвежского научного сообщества, где первооткрывателем метода считают Хьелля Клеппе.
Сейчас Мюллису 72 года, он работает научным сотрудником Научно-исследовательского института детской больницы Окленда и с 2011 года возглавляет предприятие Altermune LLC, занимающееся изучением иммунитета [14].
Кэри Мюллис нередко выступает на конференциях, рассказывает о своей жизни, работе и, конечно, своем открытии (см. видео 1). Он — прекрасный рассказчик, его всегда интересно слушать.
Видео 1. Выступление Кэри Мюллиса на конференции TED2002
Время от времени Мюллис принимает ЛСД. Однажды он рассказал о ночной встрече со светящимся зеленым енотом в лесу рядом со своим загородным домом. А Альберт Хоффман («отец» ЛСД) утверждал, что, по словам Мюллиса, ЛСД помог ему развить идею ПЦР [14].
В 1998 году вышла книга Кэри Мюллиса «Танец обнаженного разума» (Dancing naked in the mind field), где в обрамлении автобиографических историй ученый высказывает своё мнение о глобальном потеплении, СПИДе и других волнующих общество вопросах. Мюллис верит в астрологию и считает, что значительного изменения климата не происходит, между ВИЧ и СПИДом нет никакой связи, а все исследования, говорящие об обратном, — плоды заговора ученых-карьеристов с правительствами их стран.
1987 г. Компания Cetus подала патентную заявку на метод ПЦР с Taq-полимеразой, и ее одобрили в октябре 1990 года.
1989 г. Журнал Science объявил Taq-полимеразу молекулой года, а статья сотрудников Cetus о ПЦР с ее использованием [15] несколько лет поддерживала статус самой цитируемой биологической публикации [16].
В августе химический гигант DuPont подал против Cetus иск, в котором утверждал, что патенты на ПЦР получены неправомерно, поскольку этот процесс еще в 1970-х описал Хьелль Клеппе. В ответ на иск Ведомство по патентам и товарным знакам США (USPTO) решило переосвидетельствовать патенты. Но через год объявило, что они останутся действительными: комиссия нашла метод, описанный в работе Клеппе, слишком «неопределенным и сомнительным». К тому же там не упоминалась возможность экспоненциальной репликации — отличительной черты ПЦР. В суде представители DuPont так и не смогли доказать вторичность изобретения Мюллиса. 28 февраля 1991 года, после двух дней работы, суд вынес решение в пользу Cetus [10].
1991 г. Выигранный суд не помог корпорации Cetus: к ‘91-му году ее убытки превысили $60 млн, и в июле было объявлено о слиянии с биотехнологической компанией Chiron. А права на метод ПЦР и использование Taq-полимеразы в декабре продали компании Hoffman-La Roche за $300 млн [10]. С этой сделки Cetus выплатила Кэри Мюллису неоправданно малую сумму, фактически ограбив его.
С тех пор Hoffman-La Roche и ее «дочка» Roche Molecular Systems развивают метод полимеразной цепной реакции: у них уже более 1000 связанных с ПЦР патентов и заявок.
Принцип метода
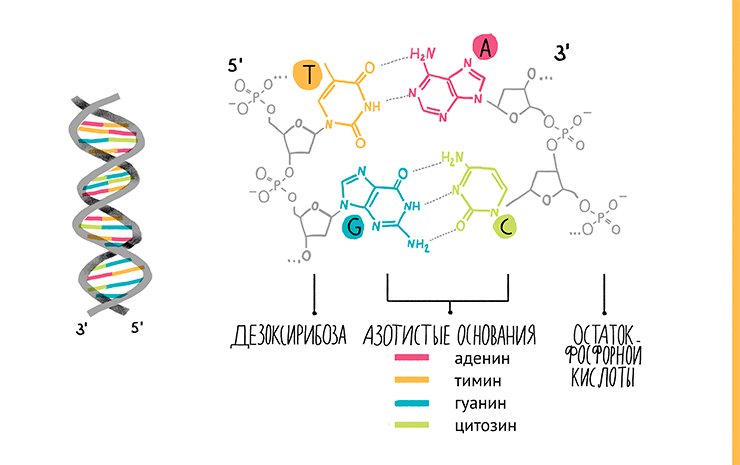
Все мы знаем, что ДНК — это двухцепочечная молекула, где каждая цепочка состоит из звеньев-нуклеотидов. Нуклеотиды составлены из трех молекул: остатка фосфорной кислоты, сахара и азотистого основания. Если сахар и фосфат одинаковы у всех нуклеотидов в ДНК (в РНК сахар другой), то азотистых оснований четыре (если не считать редкие модификации): аденин, тимин, цитозин и гуанин, обозначаемые А, Т, Ц и Г соответственно. В молекулах РНК тимин заменен урацилом. Нуклеотиды соединяются в цепочку, образуя связи между фосфатной группой одного нуклеотида и гидроксильной — другого. В результате на одном конце каждой цепи ДНК «висит» фосфатная группа (5ˊ-конец), а на другом — гидроксильная (3ˊ-конец). Две цепи нуклеотидов расположены в молекуле ДНК антипараллельно, то есть напротив 3ˊ-конца одной находится 5ˊ-конец другой. Чтобы молекула была стабильной, цепочки должны как-то взаимодействовать друг с другом. Это обеспечивают водородные связи, образующиеся между азотистыми основаниями противоположных цепей по принципу комплементарности: А соединяется только с Т (или У в РНК), а Г — с Ц (рис. 5, видео 2). И поэтому, имея одну цепь ДНК, в соответствии с этим правилом легко построить ее пару. Собственно, на этом и основана ПЦР.
Рисунок 5. Строение ДНК.
Видео 2. Строение ДНК.
Типичная реакционная смесь
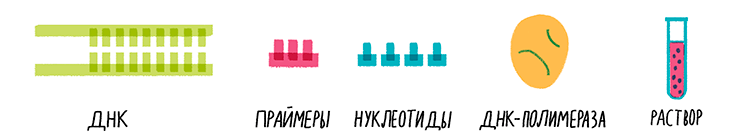
- Анализируемая ДНК. Это может быть как отдельный кусочек молекулы, так и плазмида, хромосома или геном клетки полностью. Для грубой оценки сойдет даже суспензия клеток. ДНК служит матрицей для многократного копирования нужного участка.
- Праймеры.Праймер — это искусственно синтезированная короткая цепочка нуклеотидов (15–30 штук), комплементарная выбранному участку одной из цепей анализируемой ДНК. Один из праймеров обычно соответствует началу амплифицируемого отрезка, другой — его концу, но на противоположной цепи. У праймеров, как и у любого олиго- или полинуклеотида, есть 3ˊ- и 5ˊ-концы.
- Нуклеотиды. А точнее, дезоксинуклеотидтрифосфаты — четыре вида «кирпичиков» для строительства цепей ДНК: дАТФ, дТТФ, дЦТФ и дГТФ.
- ДНК-полимераза. Фермент, строящий комплементарную матричной цепь ДНК. Он может начинать синтез только от 3ˊ-конца праймера. Обычно используют термостабильные полимеразы, изначально выделенные из термофильных бактерий и архей: Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза) и Pyrococcus woesei (Pwo-полимераза). Первая — самая производительная, а две другие — более точные.
- Буфер. Раствор, содержащий различные ионы для поддержания нужного рН, соли магния, необходимые для работы полимеразы, и неионный детергент Tween-20 в сочетании с BSA (бычьим сывороточным альбумином) для предотвращения налипания компонентов реакции на стенки пробирки. В случае ГЦ-богатых матриц в смесь часто добавляют энхансер — ДМСО (диметилсульфоксид), предотвращающий нежелательные взаимодействия между комплементарными участками матрицы.
Рисунок 6. Состав смеси для ПЦР.
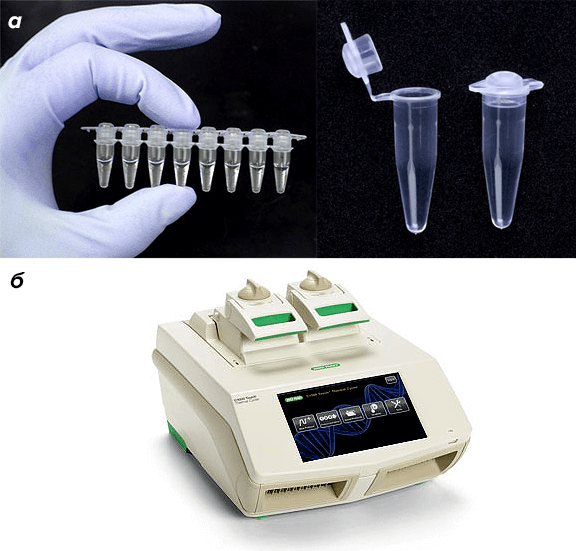
Все компоненты смешивают в нужном объеме деионизованной воды в специальных пробирках для ПЦР и помещают в амплификатор (или ПЦР-циклер) (рис. 7, видео 3).
Рисунок 7. Расходные материалы и оборудование для ПЦР. а — ПЦР-пробирки. б — Амплификатор C1000 Touch™ производства Bio-Rad.
Видео 3. Приготовление смеси для ПЦР.
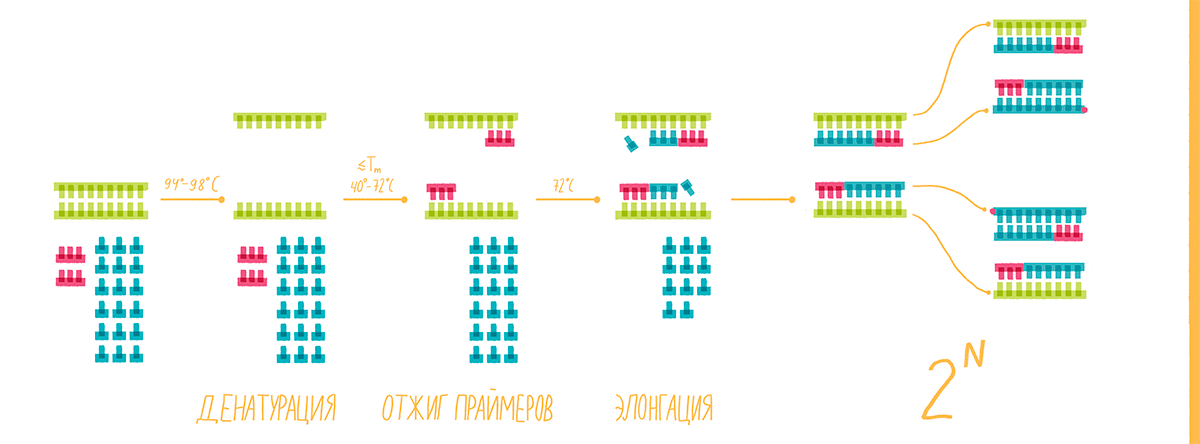
Этапы реакции
Цель ПЦР — получить множество одинаковых двухцепочечных кусочков ДНК строго определенной длины (обычно не более 2–3 тысяч пар нуклеотидов, т.п.н.). Для этого проводят 20–30 циклов реакции. Каждый цикл состоит из трех этапов.
1. Денатурация
Чтобы полимераза могла работать, две цепи ДНК-матрицы нужно разъединить. Для этого реакционную смесь нагревают до 94–98 °С. В таких условиях разрушаются водородные связи между азотистыми основаниями параллельных цепей.
2. Отжиг праймеров
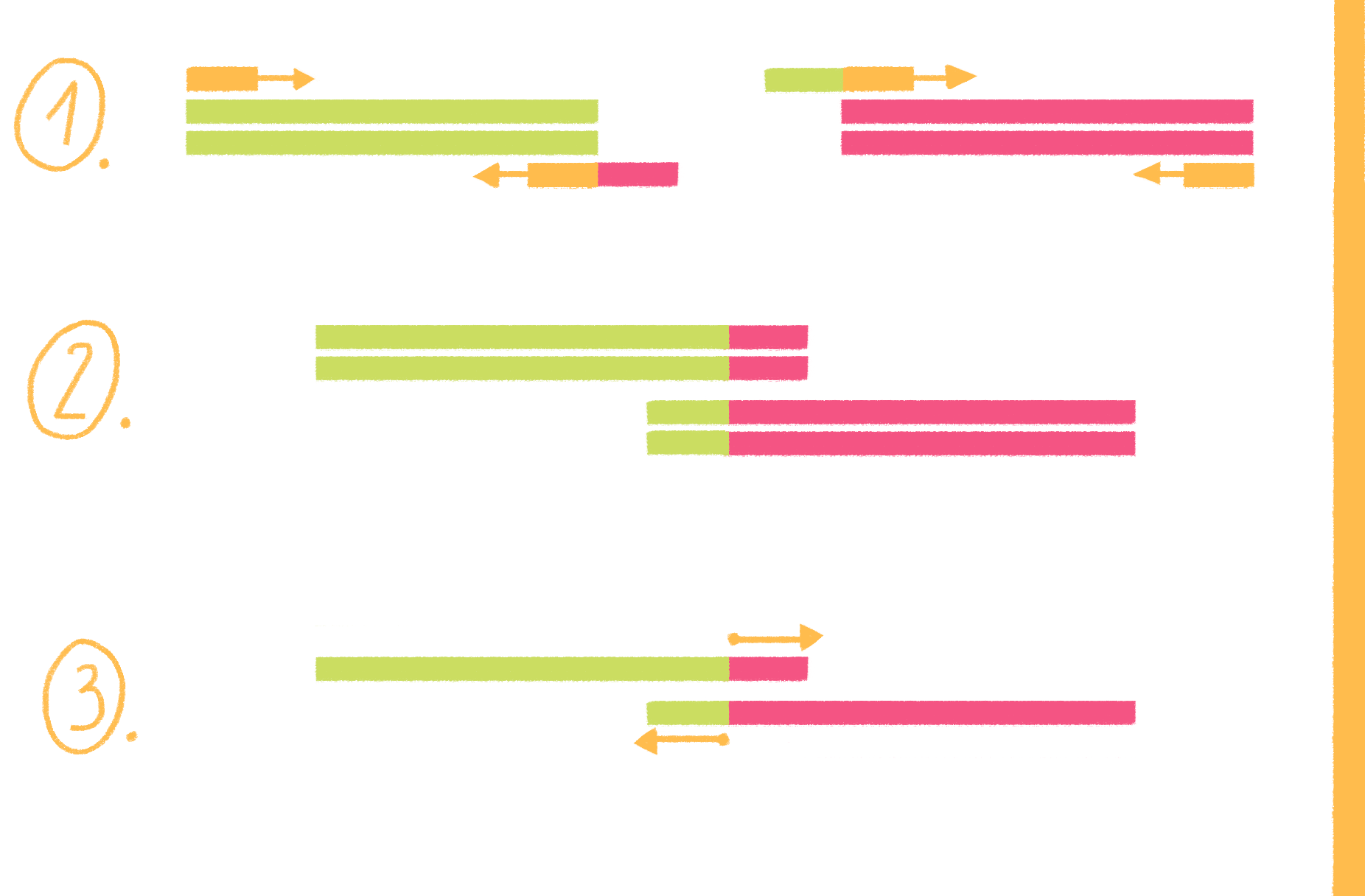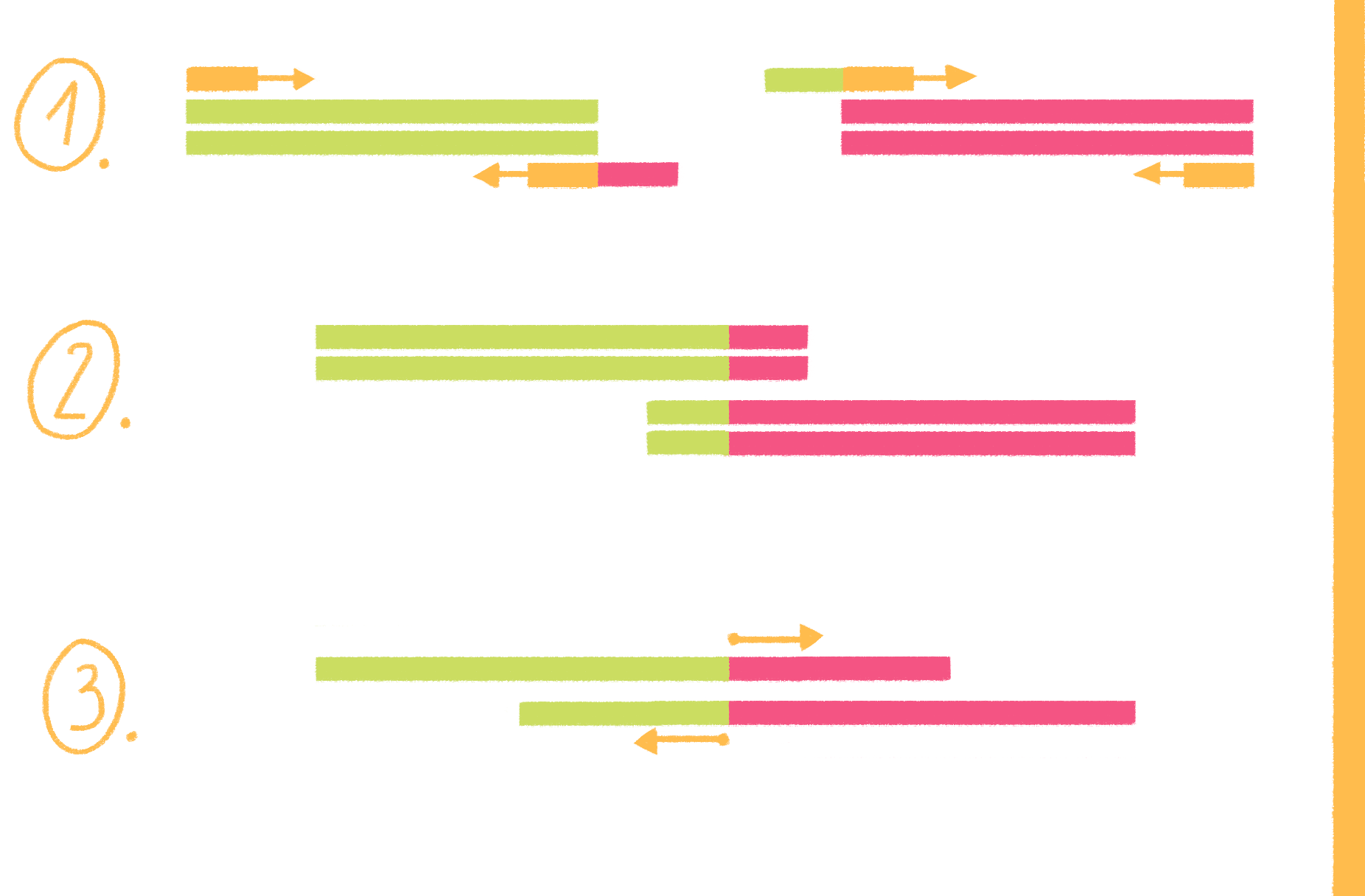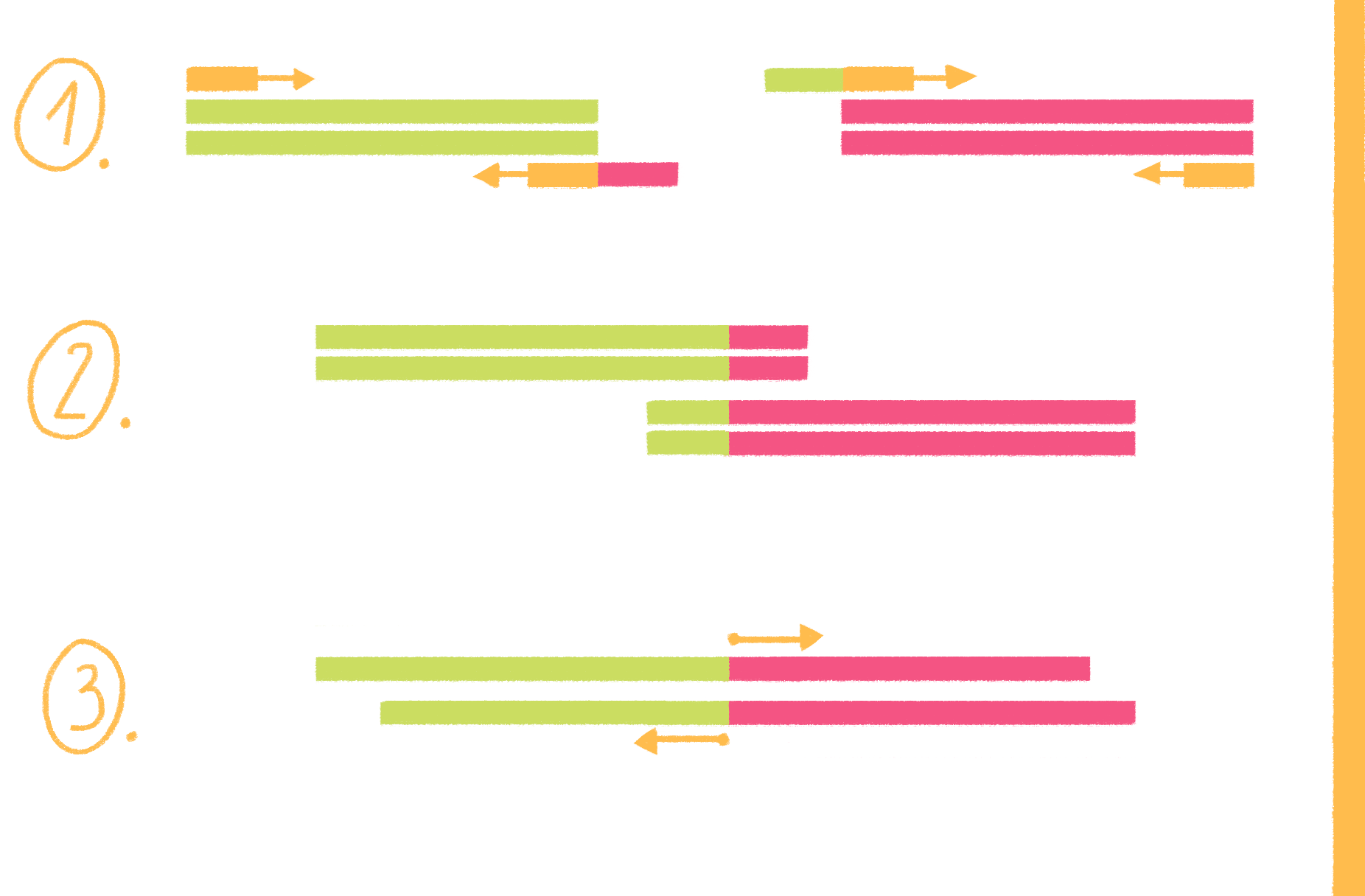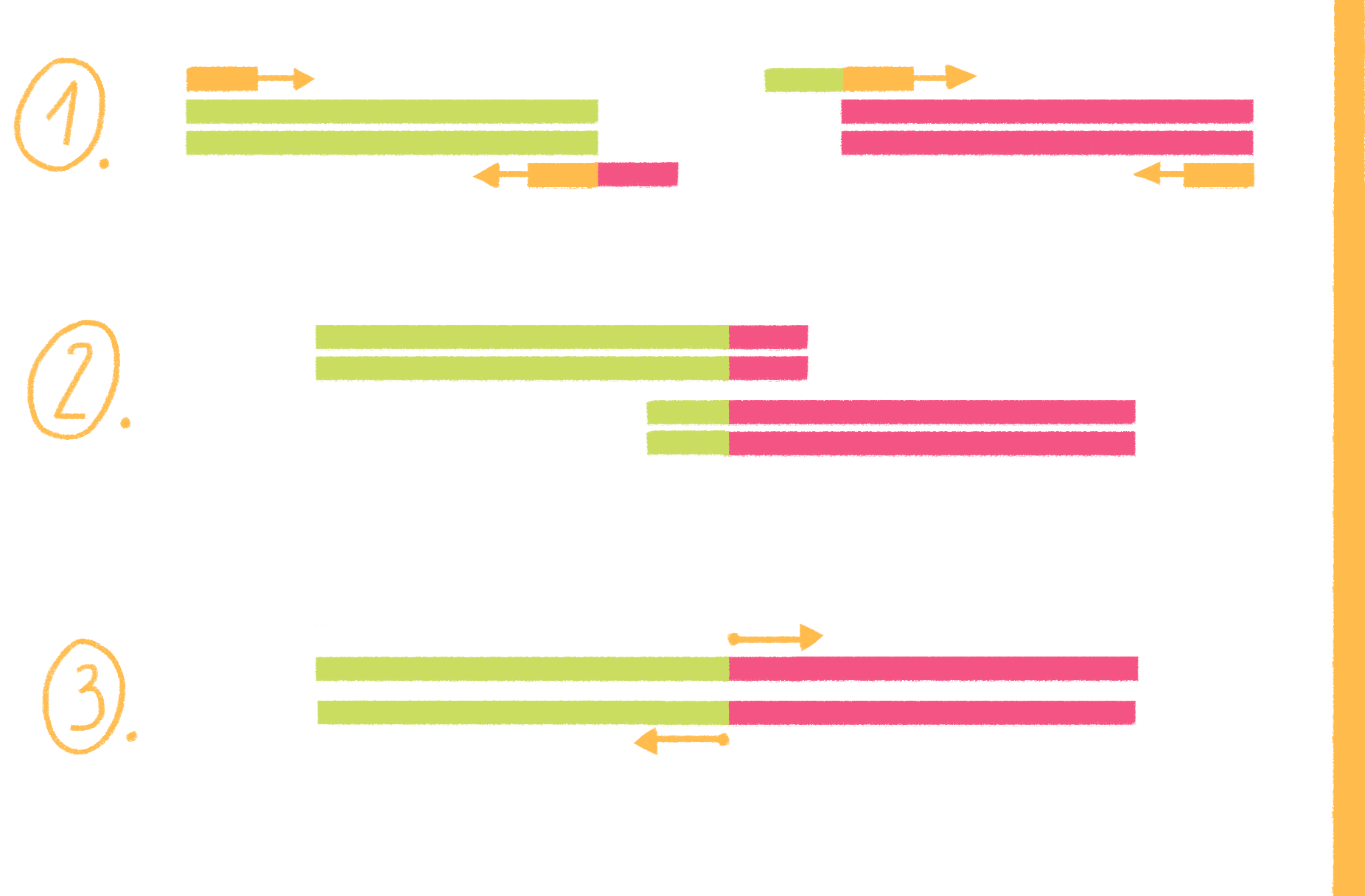
На этом этапе праймеры специфично присоединяются к освободившимся цепям ДНК-матрицы с разных сторон копируемого участка 3ˊ-концами друг к другу (рис. 8, видео 4). Чтобы праймеры могли комплементарно связаться (отжечься) только с нужными участками, при их конструировании необходимо учитывать такую важную характеристику, как температура плавления (Тm). Это расчетная температура, при которой половина праймеров присоединяется к целевому участку ДНК. Отжиг проводят при температуре на 1–5 °С ниже Tm, но не выше оптимальной температуры работы полимеразы, то есть в пределах 40–72 °С [17].
Рисунок 8. Полимеразная цепная реакция. На стадии денатурации цепи ДНК разъединяются, на следующем этапе (отжиг) к ним присоединяются праймеры, а далее полимераза начинает свою работу — синтез новых цепей ДНК (элонгация). И такой цикл повторяется многократно.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Видео 4. Полимеразная цепная реакция.
В идеале праймеры должны соответствовать следующим критериям:
- температуры плавления двух праймеров не должны различаться более чем на 5 °С;
- ГЦ-состав их должен уложиться в интервал 40–60%;
- в структуре олигонуклеотидов не должно быть шпилек (участков, комплементарных друг другу);
- праймеры не должны образовывать дуплексы (спариваться) друг с другом.
Еще лучше, если на 3ˊ-конце праймера будет гуанин или цитозин: они образуют с комплементарными основаниями три водородные связи (между А и Т образуются две), что делает комплекс праймер—матрица более стабильным.
В реальности редко получается соблюсти все условия из-за множества причин. Однако чем больше критериев соблюдено при создании праймеров, тем выше вероятность правильной их работы.
Чтобы разработать эффективные праймеры, необходимо знать последовательность ДНК у концов целевого участка, и, руководствуясь упомянутыми критериями, выбрать подходящие фрагменты, которым будут комплементарны будущие праймеры. Всё это удобно делать в специальных компьютерных программах — например, PrimerSelect: они и Тm рассчитают, и всякие спаривания изобразят, и вообще вынесут вердикт, удачная это пара праймеров или нет.
3. Элонгация, или синтез ДНК
Однажды ведущий ПЦР-специалист одного ветеринарного диагностического центра, показывая студентам постановку реакции, объяснила, что она потому называется полимеразной, потому что ее результаты наблюдают в полимерном геле. Возможно, есть и другие приверженцы этой гипотезы, однако сразу отметим, что она не верна. Полимеразная эта реакция от того, что в ее ходе фермент ДНК-полимераза последовательно выстраивает цепь ДНК (полимер) из нуклеотидов (мономеров), то есть полимеризует их. И делает она это на третьем этапе ПЦР.
Этот этап чаще проводят при температуре 72 °С — оптимальной для работы Taq-полимеразы. Фермент присоединяется к комплексам праймер—матрица и, выхватывая из раствора нуклеотиды, начинает по принципу комплементарности прилаживать их к 3ˊ-концу праймера (рис. 7). Удлинение, или элонгация, новой цепи ДНК идет с максимальной скоростью 50–60 нуклеотидов в секунду (то есть около 3000 в минуту). Однако при программировании ПЦР-циклера задают время с запасом: по минуте на каждую тысячу пар нуклеотидов.
Каждая вновь синтезированная цепочка ДНК становится, наравне со старой, матрицей для синтеза в следующем цикле. Таким образом, количество нужного продукта в процессе реакции возрастает экспоненциально. После прохождения всех циклов в реакционной смеси образуется столько специфических двухцепочечных продуктов, что их «массив» можно увидеть невооруженным глазом — проведя гель-электрофорез, о котором расскажем ниже.
К сожалению, экспоненциальная амплификация не может длиться вечно. Через 25–30 циклов количество функциональных молекул полимеразы в реакционной смеси истощается. Но чтобы добиться еще большего выхода продукта, содержимое пробирки можно разбавить, например, в 1000 раз и снова использовать для амплификации с уже новыми рабочими компонентами [18].
Визуализация продуктов ПЦР
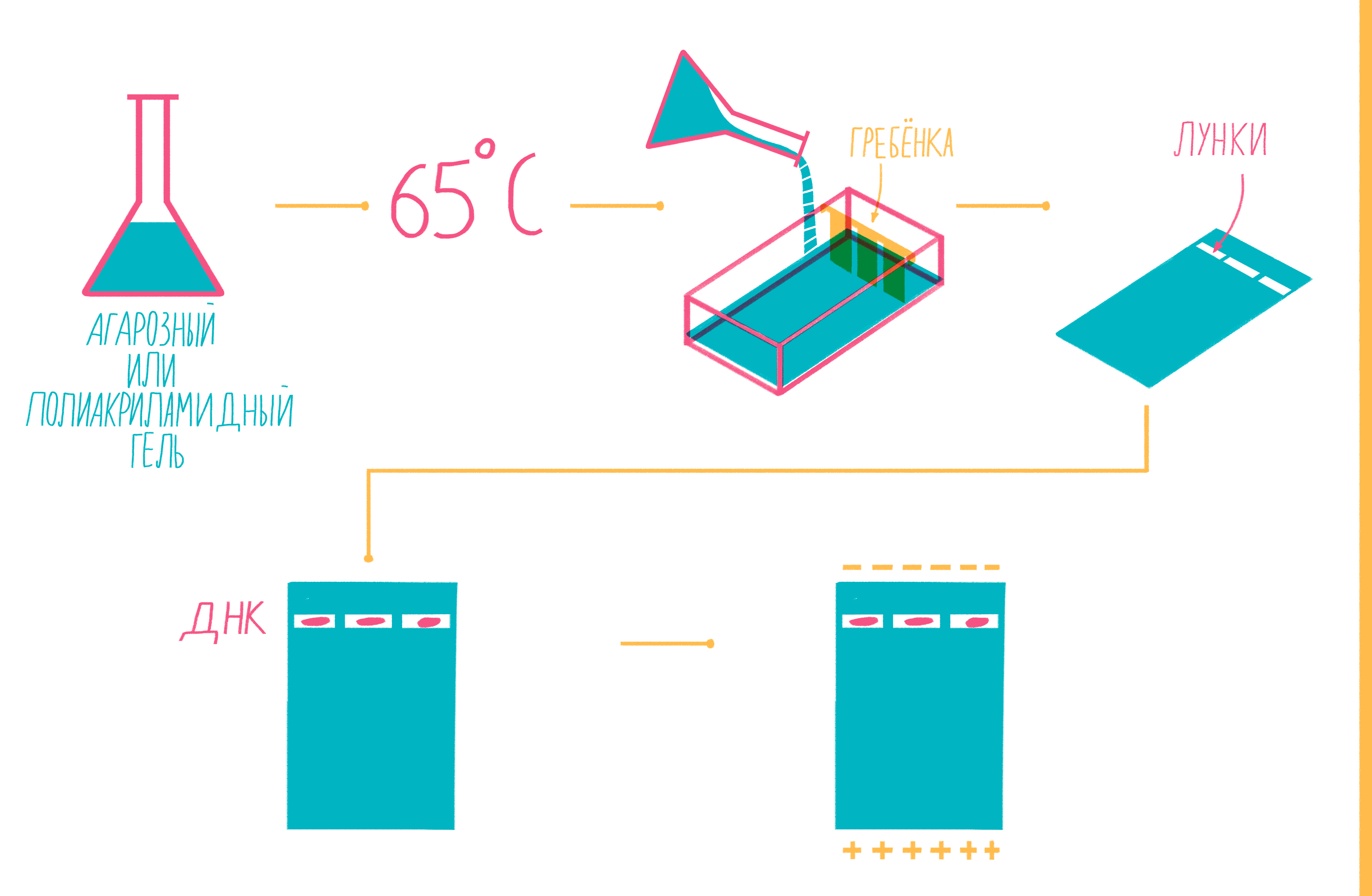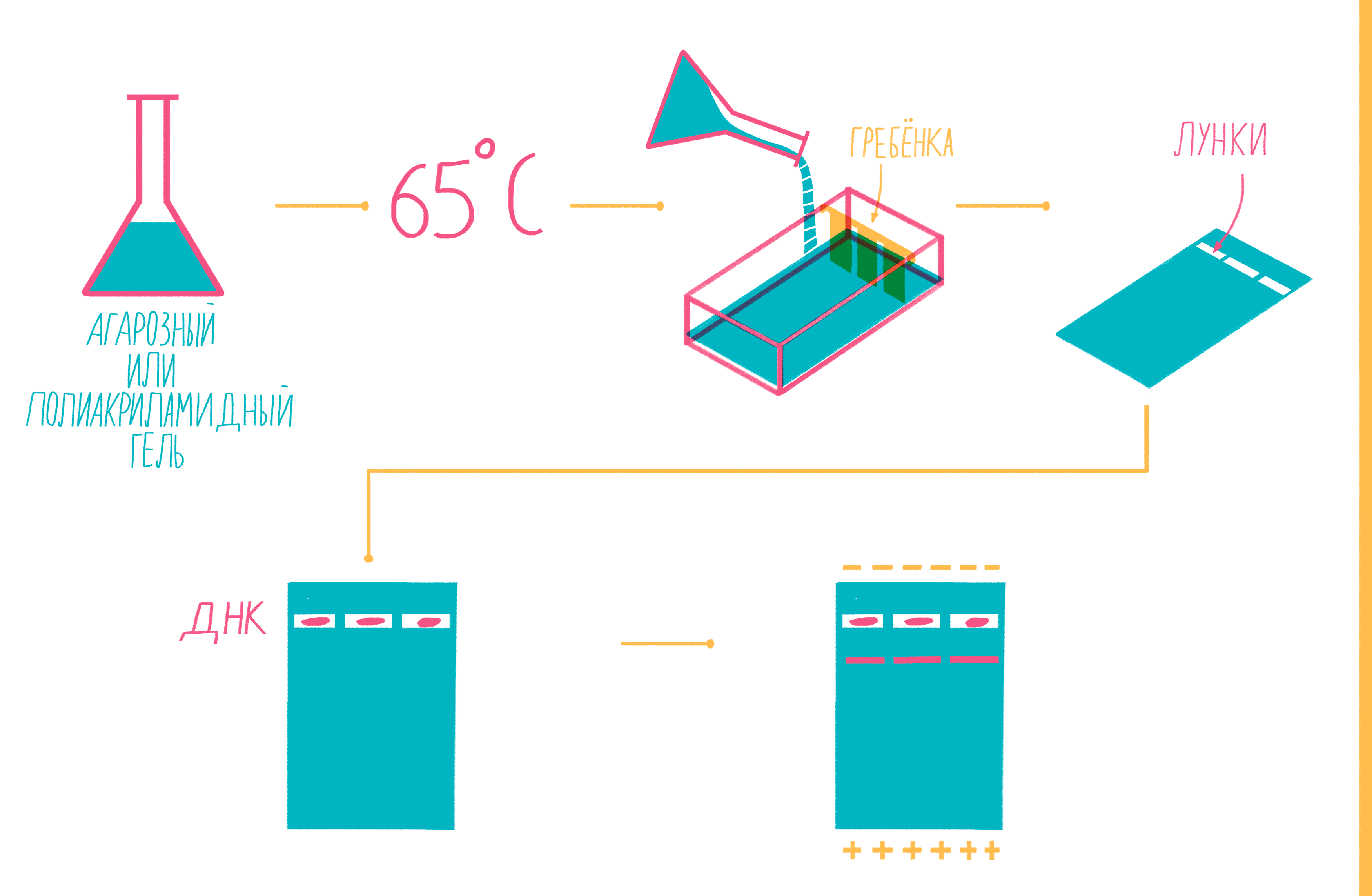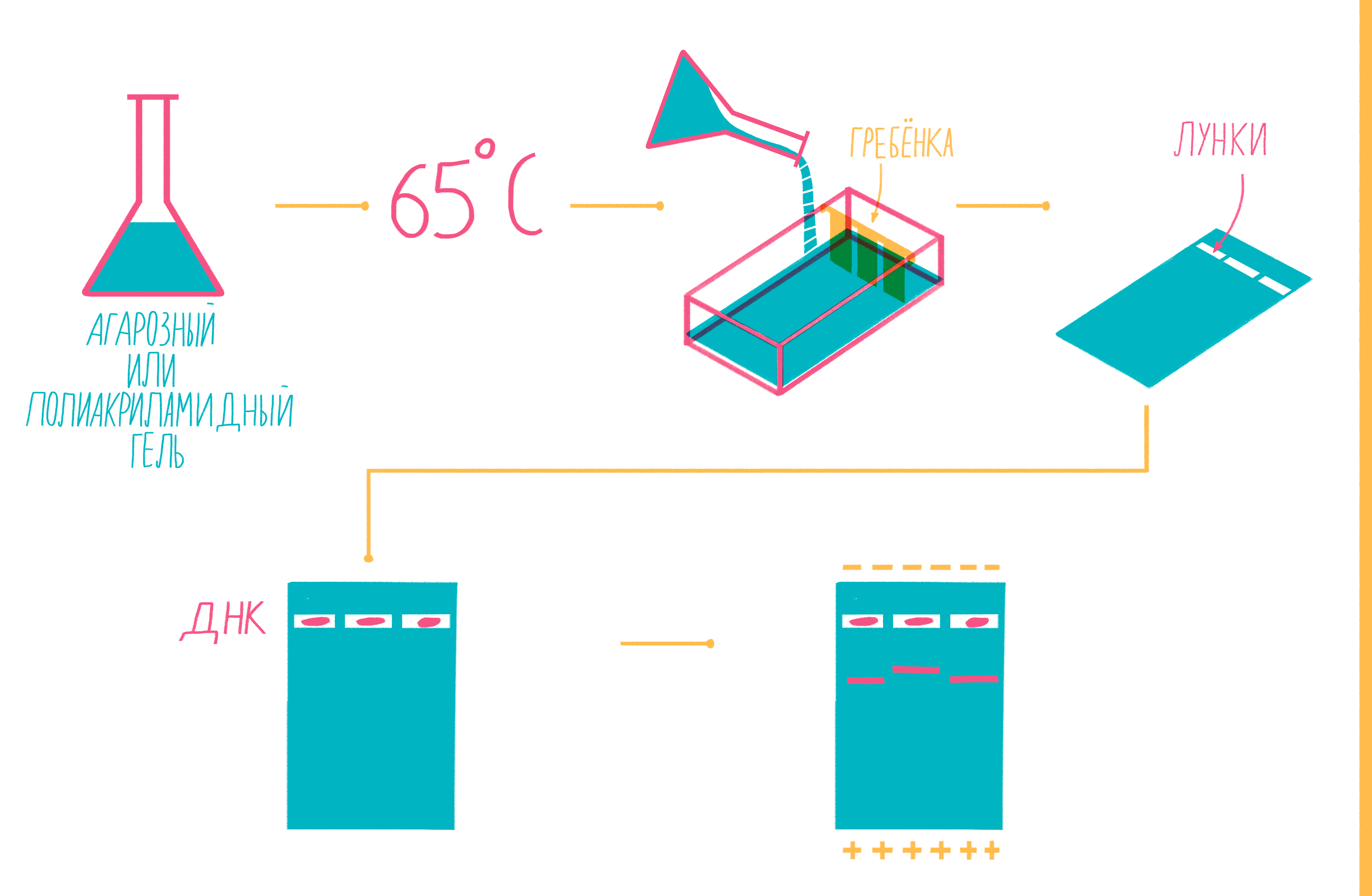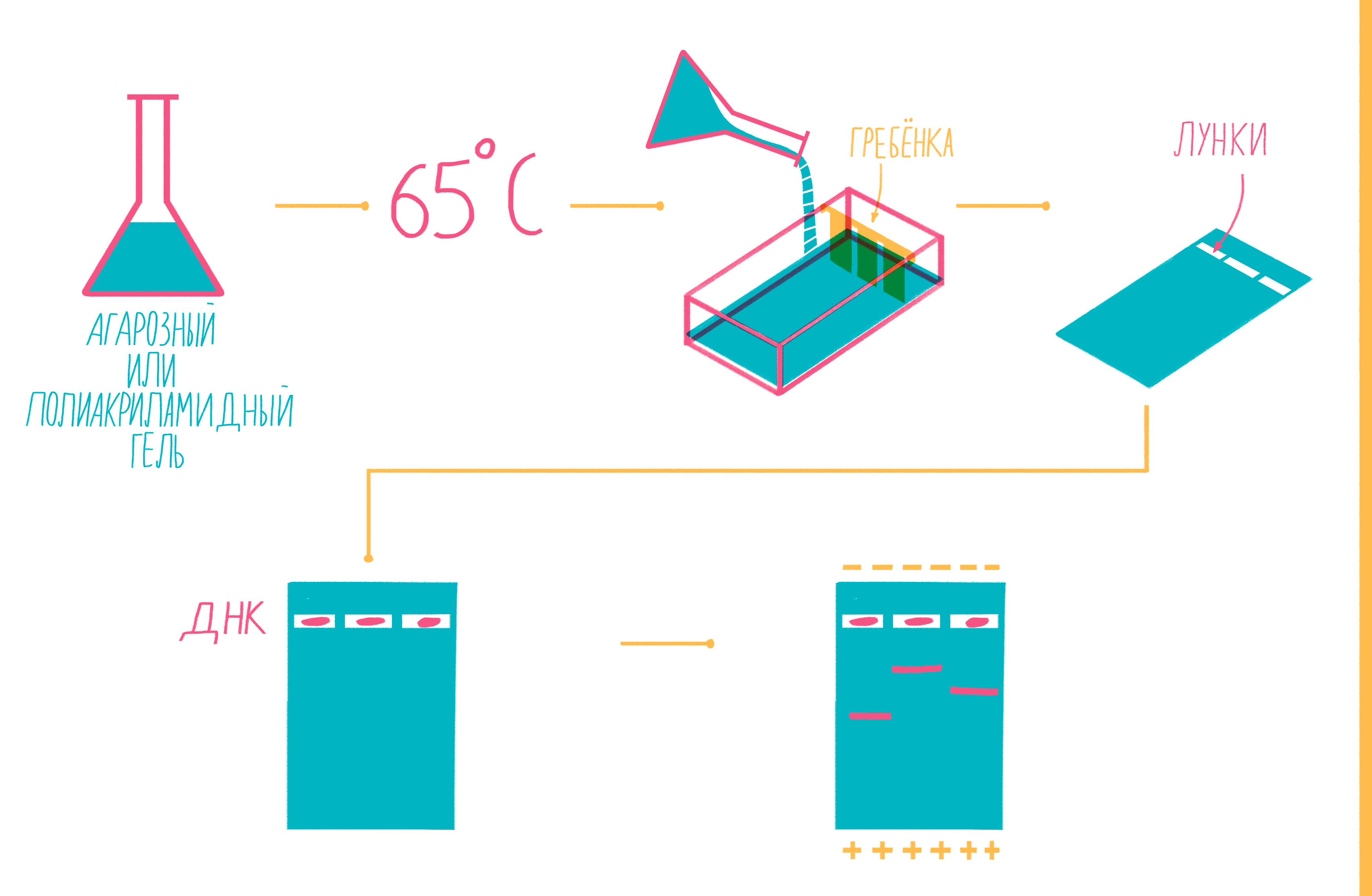
Чтобы увидеть, намножились ли нужные участки ДНК, после окончания ПЦР содержимое пробирок подвергают электрофорезу в агарозном или полиакриламидном геле с последующим окрашиванием — так молекулы ДНК разной длины разделяются пространственно и становятся видны невооруженным глазом [19]. Полиакриламидный гель намного плотнее, поэтому больше подходит для разделения очень коротких фрагментов (несколько десятков пар нуклеотидов), при этом можно увидеть разницу даже в один нуклеотид!
Расплавленный при 65 °С гель заливают в специальную форму (плашку) с установленной в ней гребенкой, формирующей лунки (рис. 9). Когда гель застывает, гребенку вынимают, ставят форму в камеру для электрофореза и заливают специальным буфером. Затем в лунки микропипеткой вносят раствор из ПЦР-пробирок, смешанный с краской — чаще бромфеноловым синим. Чтобы потом определять размеры амплифицированных фрагментов, в отдельную лунку вносят маркер молекулярных масс (ladder), содержащий набор кусочков ДНК известных размеров. Камеру подключают к источнику питания и наблюдают за бегущими от электродов волшебными пузырьками. Десятки минут или несколько часов, зависит от размера фрагментов ДНК, плотности геля и приложенного напряжения (видео 5).
Рисунок 9. Подготовка геля для горизонтального электрофореза.
Видео 5. Электрофорез в агарозном геле.
Благодаря отрицательно заряженному сахарофосфатному остову ДНК, фрагменты движутся в геле под действием электрического поля от отрицательного катода к положительному аноду. Более короткие молекулы делают это быстрее, чем длинные. Бромфеноловый синий нужен для того, чтобы следить за продвижением фронта проб в геле и не допустить их выхода за его пределы.
После окончания электрофореза гель вынимают из плашки и, чтобы увидеть расположение фрагментов, вымачивают в растворе флюоресцентного красителя, прочно связывающегося с ДНК. Иногда его вводят в гель еще до залития плашки. Если красителем служит бромистый этидий, внедряющийся между нуклеотидами ДНК, визуализацию проводят под ультрафиолетом (рис. 10).
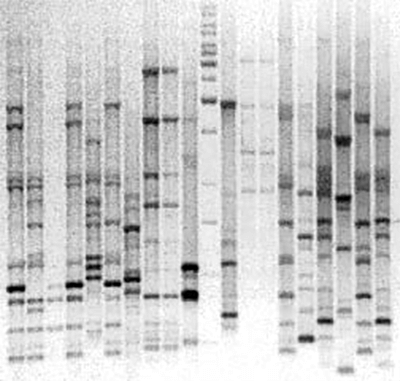
Рисунок 10. Амплифицированные участки ДНК в агарозном геле после электрофореза. Показаны результаты BOX-PCR — варианта rep-PCR (repetitive extragenic palindromic PCR), в котором с праймером BOX-A1R намножаются повторяющиеся внегенные палиндромы (BOX-мотивы) бактерий. Метод BOX-ПЦР — один из видов геномной дактилоскопии. Он обладает высокой разрешающей способностью, позволяя различать бактерии на уровне штаммов: картина распределения амплифицированных фрагментов в геле уникальна для каждого штамма. Вертикальные дорожки — отдельные пробы, соответствующие разным бактериальным штаммам; горизонтальные полоски на каждой дорожке — фрагменты ДНК разной длины.
фото автора статьи
Если экспериментатор преследовал цель просто понять, есть ли нужная последовательность нуклеотидов в ДНК-матрице, то после визуализации гель выбрасывают. Но нужные фрагменты несложно из геля выделить для дальнейшей работы: чтобы резать их на кусочки для сравнения с другими фрагментами, вставлять в плазмиды для дальнейшего изучения, секвенировать и т.д.
Типы ПЦР
Мы описали типичную качественную ПЦР, позволяющую узнать, есть нужная последовательность в анализируемом образце или нет. В качестве матрицы мы всегда упоминали ДНК, но бывают случаи, когда в распоряжении экспериментатора есть лишь РНК (при исследовании РНК-вирусов) или только она может дать необходимую информацию (при определении уровня экспрессии генов). Тогда используют ПЦР с обратной транскрипцией, или ОТ-ПЦР (RT-PCR; не путать с real-time PCR!).
Помимо качественной, существует количественная ПЦР — для определения количества исходной матрицы в образце. Это ПЦР в реальном времени, или real-time PCR. Ее тоже можно проводить в двух вариантах: с ДНК-матрицей и РНК-матрицей.
ПЦР с обратной транскрипцией
Полимеразная цепная реакция может идти исключительно на матрице ДНК, поэтому если у экспериментатора есть мРНК (матричная РНК, на основе которой строятся клеточные белки), то сначала ее надо как-то «переписать» в ДНК. Для этого применяют реакцию обратной транскрипции, в которой фермент обратная транскриптаза по матрице РНК строит комплементарную ДНК (кДНК) [20]. А потом с этой ДНК проводят обычную ПЦР, как описано выше (рис. 11).
Рисунок 11. Схема ОТ-ПЦР. К одноцепочечной РНК-матрице присоединяется праймер, и обратная транскриптаза синтезирует цепь ДНК, которая потом сама уже служит матрицей для синтеза ДНК в процессе обычной ПЦР.
Впервые ОТ-ПЦР упомянули в 1988 году в журнале Science, в статье о синтезе факторов роста макрофагами [21].
Эту реакцию обычно осуществляют с помощью двух ферментов — обратной транскриптазы и ДНК-полимеразы — либо в двух пробирках (в первой при 37 °С по матрице РНК синтезируют кДНК, затем во второй проводят стандартную ПЦР), либо в одной (все реагенты смешивают вместе, дают отстояться 1 час при 37 °С и помещают в циклер). У каждого из подходов есть свои недостатки и достоинства. В первом случае высока вероятность ошибок при пипетировании и загрязнения образца при переносе во вторую пробирку. Но при этом, однажды проведя обратную транскрипцию, полученную кДНК можно использовать в нескольких экспериментах с разными целями. Во втором случае в ПЦР участвует вся синтезированная кДНК, и повторить реакцию уже невозможно. Однако время проведения эксперимента существенно сокращается. Первый вариант применяют для исследования некоторого набора генов, а второй — при большом количестве образцов, но малом количестве изучаемых генов.
Но ОТ-ПЦР можно проводить и с одним ферментом — Tth-полимеразой. Эту термостабильную полимеразу выделили в 1985 году из бактерии Thermus thermophilus HB-8 [22]. Фермент обладает двойной активностью: в присутствии ионов магния — полимеразной, а в присутствии ионов марганца — обратнотранскриптазной. Причем обе реакции могут идти при 70 °С, что очень важно в случае ГЦ-богатых РНК, которые охотно образуют «шпильки»: высокая температура поддерживает матрицу в денатурированном состоянии, повышает специфичность отжига праймеров и позволяет эффективно копировать сложные молекулы [17].
Однако здесь есть и проблема: в присутствии марганца точность полимеразы сильно снижается, и кДНК содержит множество ошибок. Чтобы этого избежать, после реакции обратной транскрипции в пробирку вносят EDTA, которая образует с марганцем устойчивый комплекс, тем самым выводя его из реакции. Затем добавляют магний и проводят ПЦР [17].
ОТ-ПЦР незаменима при работе с вирусами, геном которых представлен молекулой РНК, в диагностике некоторых видов рака по специфическим транскриптам опухолевых клеток, а также в генной инженерии, если нужно экспрессировать эукариотический ген в бактериальных клетках.
ПЦР (и ОТ-ПЦР) в реальном времени
Этот метод еще называют qPCR (quantitative PCR, или количественная ПЦР), поскольку он позволяет не только обнаружить в пробе целевую нуклеотидную последовательность, но и измерить количество ее копий, а значит, и рассчитать, сколько же было исходной матрицы. Этой матрицей может быть как ДНК (qPCR), так и РНК (RT-qPCR). Понятно, что в последнем случае первой стадией будет обратная транскрипция.
ПЦР в реальном времени разработали в 1992 году в Калифорнии сотрудники Roche Molecular Systems [23]. Они добавили в смесь для ПЦР флуоресцентный краситель бромистый этидий (EtBr) и запустили реакцию под ультрафиолетовым светом, который заставлял EtBr светиться. Весь процесс, а следовательно, и усиление свечения при накоплении копий ДНК, исследователи записали на видеокамеру. Затем они смогли подсчитать исходное число копий целевого фрагмента в реакционной смеси.
Метод real-time PCR не требует визуализации продуктов реакции с помощью гель-электрофореза — их накопление фиксируют в реальном времени оптические датчики, вмонтированные в амплификатор и настроенные на определенную длину волны, испускаемую флуоресцирующими метками (рис. 12). При этом используют два типа меток: интеркалирующие агенты («коллеги» EtBr) и зонды с флуорофорами [24].
Рисунок 12. Амплификатор для qPCR CFX384 Touch™ от Bio-Rad.
Самый популярный интеркалирующий агент — SYBR Green, флуорофор, резко увеличивающий флуоресценцию (в 1000 раз) после связывания с двухцепочечной ДНК (рис. 13). Таким образом, увеличение флуоресценции будет пропорционально увеличению количества ДНК в каждом цикле ПЦР. К сожалению, интеркалирующие агенты обладают низкой специфичностью: они могут связываться и с «побочными» продуктами реакции, и с димерами праймеров. Однако тщательный подбор праймеров и условий ПЦР минимизируют этот недостаток [24].
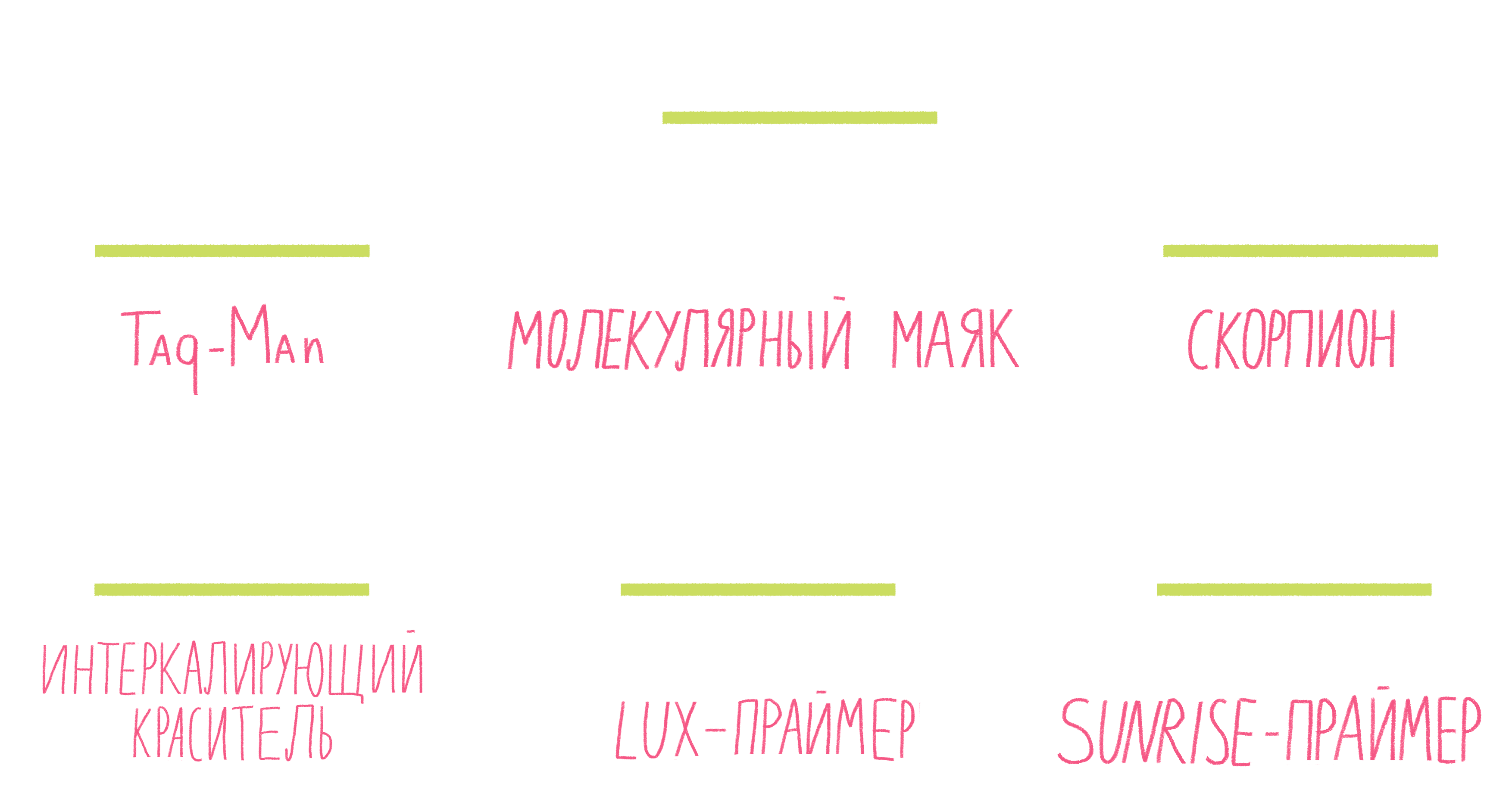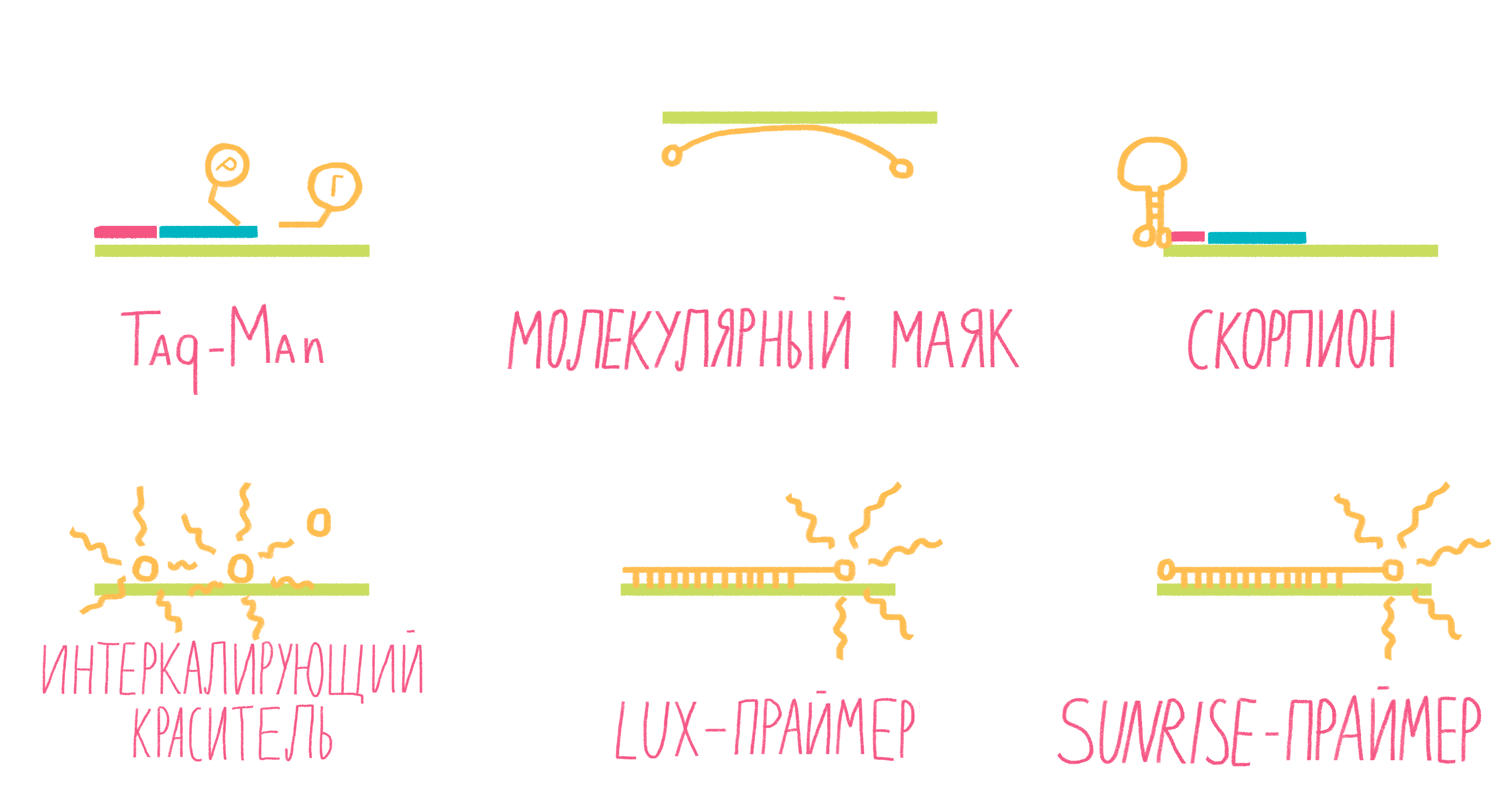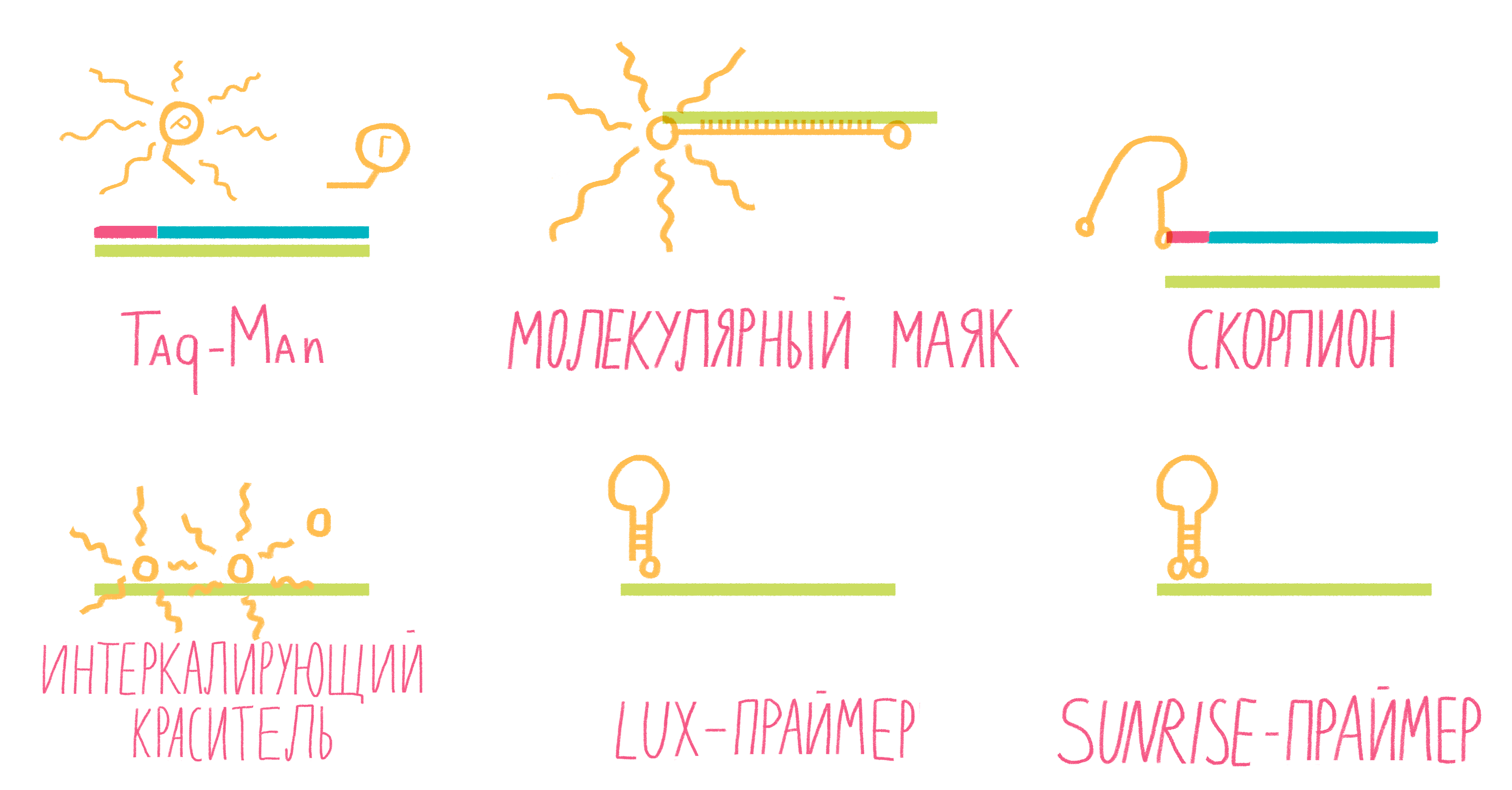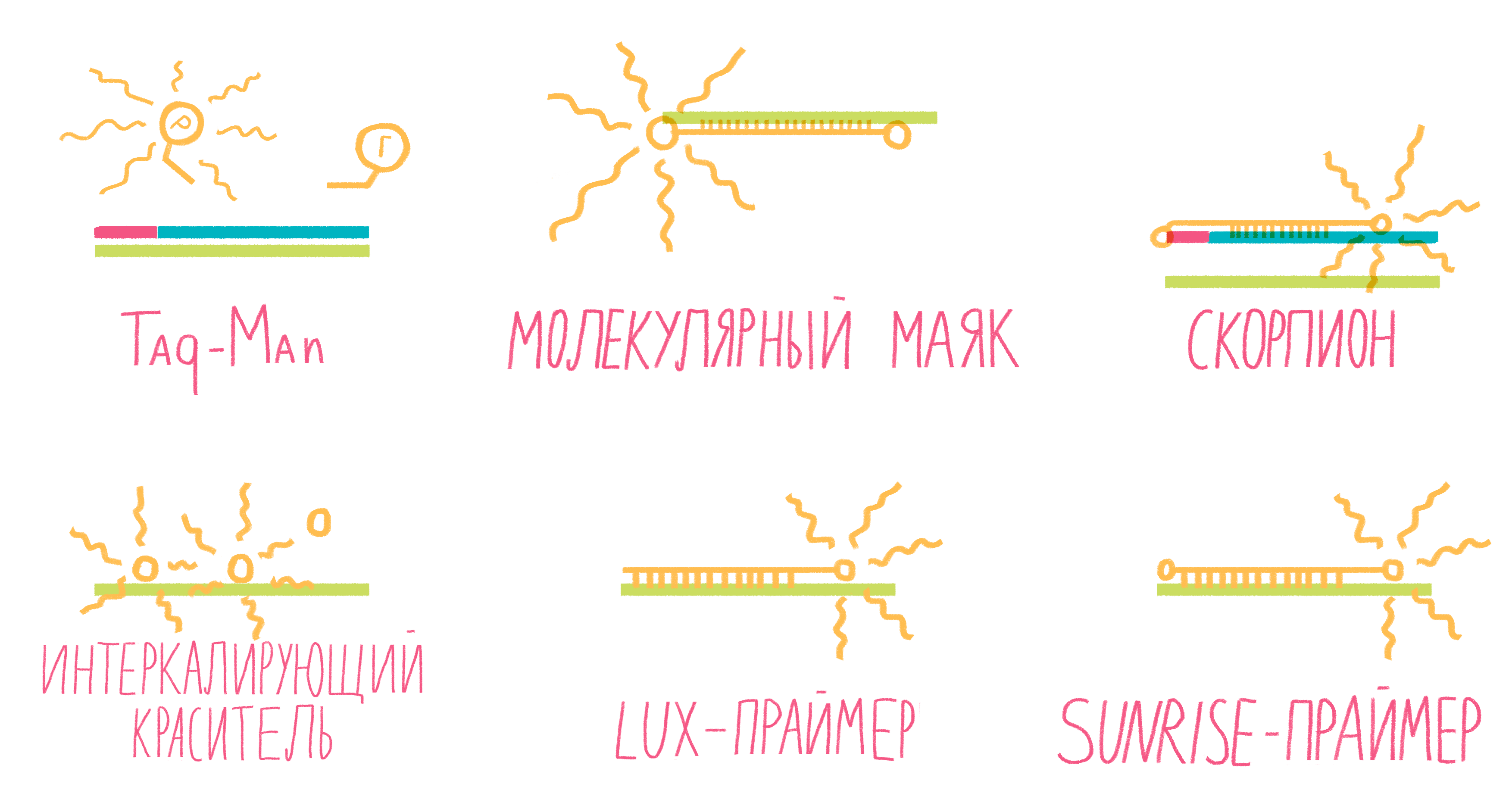
Рисунок 13. Некоторые виды меток для ПЦР в реальном времени.
Систем зондов с флуорофорами достаточно много (рис. 13). Подробно разберем лишь три самых распространенных.
- TaqMan. Этот небольшой олигонуклеотид, комплементарный внутреннему участку амплифицируемого фрагмента ДНК, содержит два флуорофора: репортер и гаситель. Когда они находятся на одном зонде, то есть близко друг к другу, гаситель поглощает сигнал от репортера. Во время амплификации движущаяся по ДНК полимераза разрушает зонд, репортер и гаситель отдаляются друг от друга, и флуоресценция репортера становится заметной [25].
- Молекулярные маяки. Если в вышеописанном случае детекция свечения происходит на стадии элонгации, то здесь свечение фиксируют на этапе отжига праймеров. Молекулярные маяки — это короткие одноцепочечные фрагменты ДНК, образующие петлю со шпилькой, на концах которой «пришиты» репортер и гаситель (рис. 13). Пока шпилька существует, гаситель находится рядом с репортером, подавляя его свечение. Как только зонд соединяется петлей с комплементарным участком ДНК, репортер и гаситель оказываются достаточно далеко друг от друга, чтобы началась флуоресценция [25].
- Скорпионы. Это структуры, подобные молекулярным маякам, только на 3ˊ-конце после гасителя к ним пришит праймер, с которого и начинается амплификация ДНК. Сигнал от репортера фиксируют в следующем цикле реакции: двухцепочечная ДНК денатурирует, на этапе отжига праймеров раскрывается шпилька зонда, и он, изгибаясь как хвост скорпиона, комплементарно соединяется с цепочкой ДНК, синтезированной как продолжение его праймера (рис. 13). Таким образом репортер с гасителем разносятся в пространстве, и появляется свечение [24].
Применяют ПЦР в реальном времени для анализа экспрессии генов, одиночных нуклеотидных полиморфизмов (SNP) и хромосомных аберраций, для обнаружения конкретных патогенов и, в последние годы, белков (иммуно-ПЦР в реальном времени) [26].
Иммуно-ПЦР в реальном времени
Рисунок 14. Схема иммуно-ПЦР в реальном времени.
ПЦР служит для качественного и количественного определения в пробе нуклеиновых кислот. Но во многих случаях необходимо детектировать ферменты, гормоны, токсины, антитела и другие молекулы. В большинстве случаев для этого используют метод ИФА (иммуноферментный анализ). Чувствительность метода позволяет определять даже несколько нанограммов антигена в пробе, однако отдельные молекулы ИФА выявить не в состоянии [27].
Чтобы устранить такой недостаток, ученые решили попробовать соединить ИФА и ПЦР. Технологию иммуно-ПЦР (иПЦР, IPCR) разработали сотрудники Калифорнийского университета в Беркли в 1992 году [28]. Сначала для визуализации результатов использовали гель-электрофорез, но сегодня в большинстве случаев применяют ПЦР в реальном времени.
Суть метода заключается в следующем. Пробы, где ищут нужную молекулу (гормон, токсин и т.п.), помещают в специальные пробирки, материал которых обладает высокой антигенсвязывающей способностью и термостойкостью. Далее к пробам добавляют специфические антитела с «пришитыми» к ним ДНК-метками длиной 150–300 п.н. (существует множество вариантов таких систем, но здесь разберем самый простой). Когда антитела присоединятся к искомым молекулам (антигенам), иммобилизованным на стенках пробирок, производят многократную промывку, чтобы удалить непрореагировавшие меченые антитела (рис. 14). Затем в эти же пробирки заливают смесь для qPCR (с интеркалирующим агентом или зондом), помещают их в циклер и проводят реакцию, во время которой амплифицируются ДНК-метки на антителах, связанных с антигенами. Так получают сведения не только о наличии антигенов в пробе, но и об их количестве [29], [30].
Иммуно-ПЦР по разрешающей способности превосходит ИФА на 2–5 порядков и выявляет антиген даже когда невозможно сконцентрировать пробу либо на ранних стадиях бактериальной или вирусной инфекции. Не менее полезно и то, что иПЦР позволяет одновременно обнаруживать много разных антигенов, так как к антителам «пришиты» разные ДНК, амплифицируемые с уникальными праймерами, для которых можно использовать зонды разных конструкций [27], [30].
Применяют иммуно-ПЦР для поиска в пробах вирусных антигенов (например, ВИЧ), опухолеассоциированных антигенов (например, фактора роста эндотелия сосудов), прионов, бактериальных белков, токсинов (в том числе и небелковых, например, диэтилфталата) и других веществ [31].
Варианты проведения реакции
Сегодня существуют десятки вариантов проведения ПЦР для разных целей, для повышения специфичности и эффективности. Разберем лишь несколько наиболее популярных и интересных.
ПЦР с горячим стартом
Известно, что Taq-полимераза может проявлять небольшую активность при комнатной температуре и даже когда пробирка с реакционной смесью находится во льду. Поэтому фермент всегда добавляют в смесь непосредственно перед запуском реакции. Но если, например, проб много, то какие-то из них некоторое время будут стоять уже с полимеразой, пока экспериментатор внесет ее во все пробирки. В этом случае есть вероятность получения неспецифически амплифицированных фрагментов.
Чтобы избежать такой неприятности, используют ПЦР с горячим стартом (hot start PCR), где в смесь добавляют полимеразу в комплексе с антителами, блокирующими ее активность. На первой стадии ПЦР (при 95 °С) антитела денатурируют, полимераза освобождается и только тогда начинает работу.
Ступенчатая ПЦР
При оптимальной температуре отжига праймеры иногда могут связываться и с не идеально комплементарными им участками, а вот если эту температуру немного повысить (например, до 72 °С), то специфичность гибридизации праймеров с матрицей можно существенно увеличить. На этом и основана ступенчатая ПЦР (touchdown PCR): первые циклы проводят при повышенной температуре отжига, постепенно снижая ее до оптимальной в следующих циклах. В результате поначалу вероятность неспецифичной амплификации снижается до минимума, а далее уже размноженные копии нужного фрагмента будут успешно конкурировать за праймеры с не полностью комплементарными им участками ДНК-матрицы.
«Холодная» ПЦР
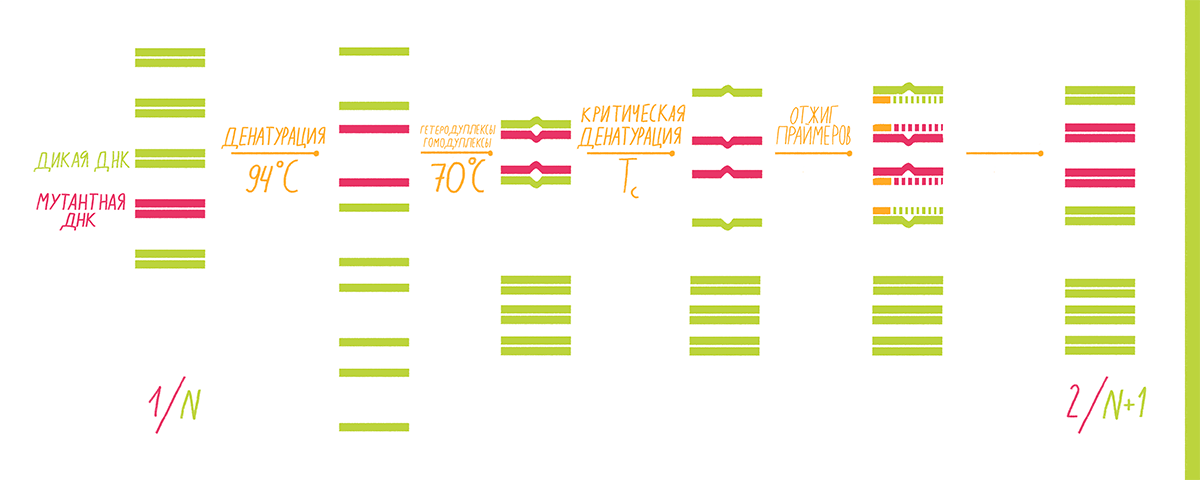
COLD-PCR (CO-amplification at Lower Denaturation temperature-PCR) используют, когда необходимо выявить, например, однонуклеотидную мутацию гена, но при этом проба содержит ДНК-матрицу как с мутантным геном, так и с геном «дикого типа». Такая смесь типична для биоптатов или образцов крови онкологических больных, и потому этот анализ востребован в медицине для ранней диагностики рака или его рецидивов, а также для назначения индивидуальной терапии на основе молекулярного профилирования. Если делать стандартную ПЦР, то амплифицируются и мутантные, и немутантные аллели интересующего гена, причем последних будет значительно больше, и выявить мутацию будет очень трудно.
Принцип «холодной» ПЦР основан на том, что замена даже одного нуклеотида в одной из цепей ДНК-фрагмента приводит к изменению его температуры плавления, то есть температуры, при которой две цепи ДНК отсоединяются друг от друга. Это изменение составляет обычно 0,2–1,5 °С для фрагментов длиной до 200 п.н. Такая пониженная температура называется критической температурой денатурации (Тс): при ней эффективность ПЦР резко падает из-за малого числа денатурированных матриц [32]. То есть при Тс матрицы «дикого типа» денатурировать уже не будут, но будут те, в которых одна из цепей содержит нуклеотидную замену, отчего их Tm снижается до значения Тс. Для получения таких коротких диагностических матриц интересующий фрагмент вначале выделяют из тотальной ДНК биоматериала с помощью стандартной ПЦР. Мутантные формы среди этих фрагментов ищут уже с помощью COLD-PCR, которая проходит в несколько этапов (рис. 15):
- Стандартная денатурация при 94 °С.
- Гибридизация при 70 °С, во время которой образуются гомодуплексы (обе цепи ДНК «дикого типа» или же обе мутантных, что маловероятно из-за их низкого содержания в исходной пробе) и гетеродуплексы целевых фрагментов (одна цепь «дикого типа», вторая — мутантная). В гетеродуплексе как минимум один нуклеотид (измененный) не может образовать водородных связей со своим «правильным» визави, что выражается в понижении температуры плавления такого дуплекса.
- Критическая денатурация при Тс. Денатурируют лишь гетеродуплексы; гомодуплексы остаются в двухцепочечном состоянии.
- Отжиг праймеров. Может идти только на разошедшихся цепях гетеродуплекса.
- Элонгация.
После окончания всех циклов реакции полученные копии интересующего фрагмента секвенируют, чтобы точно установить место и тип мутации.
Рисунок 15. Схема «холодной» ПЦР.
Чтобы увидеть рисунок в полном размере, нажмите на него.
ПЦР длинных фрагментов
Применяют, когда нужно амплифицировать очень длинные фрагменты — более 5 т.п.н. В long-range PCR часто используют две полимеразы: Taq и Pfu. Первая может за один проход синтезировать длинную цепь ДНК, но при этом «застревает», совершив ошибку, потому что не умеет вырезать только что вставленные нуклеотиды. Вторая полимераза менее процессивна, зато способна исправлять ошибки. Так они друг другу и помогают: Taq ошибается, а Pfu исправляет, давая возможность «подружке» закончить синтез.
Мультиплексная ПЦР
Бывают случаи, когда в одной пробе необходимо выявить сразу несколько последовательностей. Например, при инфекции несколькими патогенами, при диагностике комплекса заболеваний или при выявлении мутаций (рис. 16). И чтобы не проводить много реакций, экономят время и реактивы — применяют мультиплексную ПЦР (multiplex PCR), то есть ПЦР со множеством праймеров. Суть ее в том, что в одну пробирку с ДНК-матрицей добавляют целый набор праймеров для одновременной амплификации нескольких интересующих фрагментов [24], [33].
Рисунок 16. Результаты мультиплексной ПЦР ДНК пациента с миодистрофией Дюшенна. К дистрофии приводят различные мутации экзонов гена белка дистрофина. На дорожке 7 нет полосы, соответствующей экзону 48 (длиной 506 п.н.) этого гена.
Однако при этом надо соблюдать такие условия:
- температуры отжига праймеров не должны сильно разниться (то есть длина каждого праймера должна быть 18–28 нуклеотидов, а ГЦ-состав — 45–60%);
- каждый набор праймеров должен давать фрагмент, отличный от других по размеру, чтобы после электрофореза в геле полосы не совпадали.
RAPD
Это ПЦР случайных полиморфных фрагментов ДНК — Random Amplification of Polymorphic DNA. К RAPD прибегают, когда нужно различить сходные геномы: виды бактерий, сорта растений, породы собак и т.д. Используют небольшой праймер (до 10 н.), который может гибридизоваться со многими случайными участками генома. Если правильно подобрать последовательность праймера и условия реакции, то в геле после электрофореза пробы будут отличаться друг от друга количеством и (или) расположением полос.
При всей схожести метода с rep-PCR, описанной под рисунком 10, последнюю всё-таки считают независимой техникой, отличающейся от RAPD своими характеристиками [34]. Так, RAPD менее специфична и хуже воспроизводится: любая мутация в комплементарном праймеру участке матрицы приводит к тому, что короткий праймер не гибридизуется с ним, и соответствующей полосы в геле не будет. Удлинение праймеров в rep-PCR до 20–22 н. сильно повышает воспроизводимость результатов.
Асимметричная ПЦР
Асимметричную реакцию (asymmetric PCR) проводят при желании получить амплифицированную копию участка только одной из цепей ДНК — например, для последующей гибридизации. В таком случае в реакционной смеси концентрация одного праймера должна быть намного выше, чем другого, и тогда на выходе будут превалировать фрагменты нужной цепи.
Метилспецифичная ПЦР
Геномная ДНК живых организмов, как правило, метилирована: после синтеза ДНК к небольшому проценту цитозинов и аденинов фермент ДНК-метилтрансфераза присоединяет метильную группу. Цели метилирования разнообразны: от регуляции экспрессии отдельных генов до регуляции целых процессов, таких как старение или канцерогенез.
Это свойство геномной ДНК эксплуатирует метилспецифичная ПЦР (methylation-specific PCR). Такой вариант ПЦР применяют, чтобы понять, метилирован ли определенный участок ДНК по цитозину.
Перед постановкой реакции ДНК-матрицу обрабатывают бисульфитом. Он преобразует неметилированные цитозины в урацилы, которые распознаются праймерами и полимеразой как тимины, а метилированные цитозины не трогает. Затем проводят две реакции с разными праймерами: в одну пробирку вносят праймеры, специфичные к последовательности с цитозинами, а в другую — к последовательности с урацилами. Если амплификация прошла в первой пробирке, значит ДНК на этом участке метилирована, если во второй — не метилирована.
ПЦР со вложенной парой праймеров
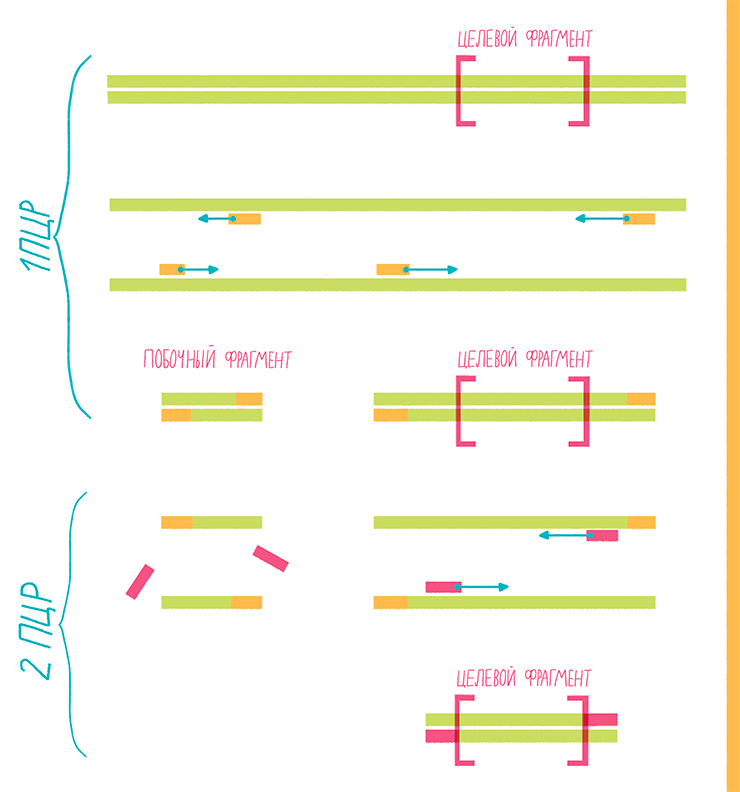
Она же — вложенная или гнездовая ПЦР (nested PCR). Полезна для уменьшения вероятности амплификации неспецифических фрагментов. Если, например, какие-то из праймеров «сядут» на незапланированные участки, после электрофореза в геле можно получить несколько полос — целевого фрагмента и побочных. Чтобы повысить специфичность реакции, используют два набора праймеров: первый — для амплификации более длинного фрагмента, второй — для амплификации внутреннего участка этого фрагмента (рис. 17). Несколько раундов ПЦР проводят с первым набором, а затем добавляют второй. Чтобы избежать продолжения амплификации с первыми праймерами, оба набора разрабатывают для отжига при разных температурах [24].
Рисунок 17. Схема вложенной ПЦР.
Инвертированная ПЦР
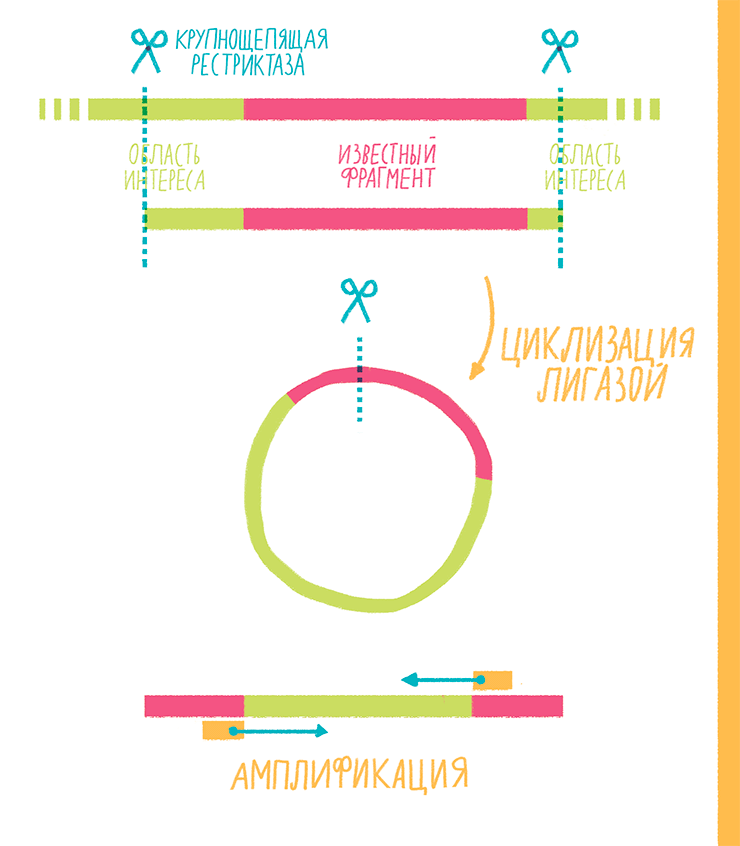
Этот вариант используют, когда известна последовательность (сиквенс) какого-то участка ДНК, но нужно амплифицировать вовсе не его, а то неизвестное, что его окружает. Например, необходимо узнать, в какое место генома встроился вирус с известным сиквенсом. Тогда-то и приходит на помощь инвертированная ПЦР (inverse PCR), которая состоит из нескольких этапов (рис. 18):
- ДНК, где есть участок с известной последовательностью, разрезают крупнощепящей рестриктазой. Такие эндонуклеазы распознают сайты длиной 6–8 нуклеотидов, а поскольку таких мест в геноме не может быть слишком много, ДНК режется на крупные куски — фрагменты длиной несколько т.п.н. Важно учесть, чтобы сайта узнавания выбранной рестриктазы не было внутри известного нам участка: он должен войти целиком в один из крупных рестрикционных фрагментов.
- Ферментом лигазой полученные фрагменты закольцовывают.
- Используя праймеры к известной последовательности, но ориентированные кнаружи от нее, амплифицируют ту самую, неизвестную, которую потом можно, например, секвенировать.
Рисунок 18. Схема инвертированной ПЦР.
ПЦР с перекрывающимися праймерами
Чаще всего для соединения двух фрагментов двухцепочечной ДНК используют метод рестрикции/лигирования, когда края этих фрагментов разрезают одинаковыми эндонуклеазами с образованием «липких» концов, а потом соединяют их с помощью лигазы. Однако с этой целью можно применять и метод ПЦР.
ПЦР с перекрывающимися праймерами, или продлением перекрывания (overlap extension PCR), выполняется в несколько этапов (рис. 19):
- Для каждого фрагмента ДНК-матрицы конструируют два праймера: один обычный, а второй (гибридизующийся со стороны будущей сшивки фрагментов) на 5ˊ-конце несет небольшую последовательность, соответствующую концу другого фрагмента, того, что будут пришивать.
- Проводят две раздельные ПЦР — для каждого из фрагментов. В результате последовательность, содержащаяся на 5ˊ-концах «стыковочных» праймеров, уже входит в состав новообразованных амплифицированных фрагментов.
- Содержимое обеих пробирок смешивают и используют уже только два праймера — для дальних (внешних) концов. Поскольку оба фрагмента содержат на одном конце последовательности, комплементарные друг другу, во время отжига праймеров фрагменты гибридизуются, а их перекрывающиеся 3ˊ-концы служат праймерами. Таким образом получаются длинные молекулы, состоящие из двух фрагментов.
Этот же вариант ПЦР, но с небольшими модификациями, используют и для внесения мутаций, например, если из длинного фрагмента ДНК надо удалить какой-то участок.
Рисунок 19. Схема ПЦР с перекрывающимися праймерами.
Сборочная ПЦР
Этот вариант похож на предыдущий. Его используют для сборки синтетических молекул ДНК из отдельных фрагментов, например, чтобы получить синтетические гены или даже целые геномы.
В сборочной ПЦР (assembly PCR) используют одноцепочечные олигонуклеотиды длиной до 50 н., одна часть которых предназначена для образования одной цепи ДНК, а другая — для образования другой (рис. 20). Важно, чтобы эти олигонуклеотиды частично перекрывались концами (примерно на 20 нуклеотидов) с «соседями» на будущей противоположной цепи, поскольку они сами будут работать и праймерами, и матрицей. Во время первых 30 циклов ПЦР концы олигонуклеотидов удлиняются по матрице фрагментов противоположной цепи. К концу процесса каждый олигонуклеотид удлинится настолько, что превратится в отдельную цепочку будущей синтетической ДНК. Тогда в реакцию добавляют пару праймеров, комплементарных концам этой ДНК, и проводят дополнительные 23 цикла, получая на выходе множество копий синтетической ДНК.
Рисунок 20. Схема сборочной ПЦР.
Рисунок 21. Схема твердофазной ПЦР.
Твердофазная ПЦР
Ее применяют, например, для получения ДНК-микрочипов или при секвенировании на платформе Illumina. К твердой поверхности 5ˊ-концами пришивают праймеры, добавляют реакционную смесь и проводят твердофазную ПЦР (solid phase PCR, рис. 21). В первом цикле удлиняется некоторое количество праймеров, затем проводят промывку, чтобы удалить свободно плавающие в растворе ДНК-матрицы, добавляют новый раствор (но уже без матриц) и продолжают ПЦР. Одноцепочечные ДНК, торчащие над поверхностью, на этапе отжига изгибаются и гибридизуются с какими-то из соседних праймеров, становясь матрицами для удлинения этих праймеров. На этапе денатурации обе цепи расходятся, но всё равно остаются прикрепленными к поверхности, так как представляют собой продолжения праймеров [35].
In situ ПЦР
Это реакция, которую проводят непосредственно в клетках или тканях, например, для изучения внутриклеточного развития вирусов. Сначала клетки или ткань фиксируют на предметном стекле и обрабатывают протеазой, чтобы расщепить белки и освободить ДНК (или РНК, если собираются проводить ОТ-ПЦР). Затем прямо на стекло добавляют смесь для ПЦР и ставят препарат в амплификатор. Выявляют получившиеся фрагменты либо ДНК-гибридизацией, либо иммунологическими методами.
Капельная цифровая ПЦР
Цифровая ПЦР (digital PCR) — более точный и воспроизводимый метод количественного определения ДНК, чем ПЦР в реальном времени. Стандартная ПЦР проходит во всём объеме образца, а при цифровой пробу делят на большое количество маленьких субъединиц (компартментов) и проводят ПЦР в каждой из них отдельно. Методы разделения на компартменты в различных технологиях цифровой ПЦР отличаются друг от друга (используют масляную эмульсию, капилляры и т.д.), а реакцию проводят в планшетах с микролунками. Результаты визуализируют чаще всего с помощью системы TaqMan, но иногда применяют и интеркалирующие агенты, например, зеленую флуоресцирующую краску EvaGreen.
Метод цПЦР разработали австралийцы Алек Морли и Памела Сайкс в 1992 году, когда исследовали больных лейкемией [36]. В последующие годы разные исследовательские группы разрабатывали свои варианты, в том числе и варианты компартментализации. К сожалению, все они имели существенный недостаток — высокую трудоемкость: пробу надо было разделять на сотни (а то и тысячи) реакций объемом по нескольку микролитров каждая или проводить дополнительные реакции (например, иммобилизацию праймеров на магнитных шариках и гибридизацию продуктов ПЦР с флуоресцентными пробами, как в технологии BEAMing), а затем отдельно анализировать результаты.
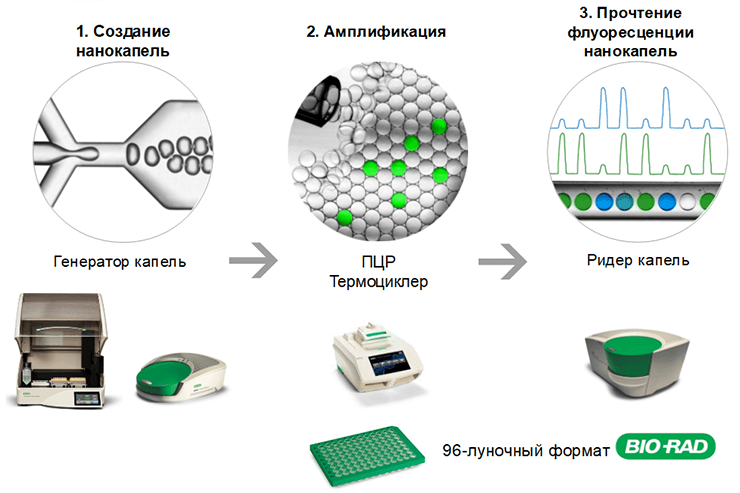
От этих проблем экспериментаторов избавила капельная цифровая ПЦР (кцПЦР), или по-английски droplet digital PCR (ddPCR). Общепризнанным лидером в этой области является система цифровой капельной ПЦР — QX200 производства компании Bio-Rad. Эту методику разработала компания QuantaLife, а в 2011 году Bio-Rad приобрела права на технологию [37]. На рынке существует еще несколько систем капельной цифровой ПЦР: QuantStudio 3D и QuantStudio 12K Flex (обе производства Thermo Fisher Scientific), Biomark HD (от Fluidigm), а также RainDrop Plus (от RainDance Technologies), недавно купленный компанией Bio-Rad, но QX200 явно доминирует — за последние несколько лет систему упоминали в более чем 600 публикациях.
В ddPCR из 20 мкл образца, в котором требуется определить количество исследуемой ДНК, создают водно-маслянную эмульсию. Реакционную смесь разделяют на приблизительно 20 000 капель-реакций объемом около 1 нл каждая с помощью автоматического генератора капель (рис. 22). При этом генетический материал распределяется по каплям случайным образом: в них попадают как ДНК-мишени, так и фоновая ДНК. Процесс распределения целевой ДНК по каплям чисто случайный и подчиняется закону распределения малых чисел Пуассона. Перед разделением образца на капли не обязательно разводить его до концентрации, чтобы в каждой капле было либо 0, либо 1 копия ДНК-мишени: при анализе результатов учитываются ситуации, когда в одной капле находится более одной копии мишени.
Рисунок 22. Схема цифровой ПЦР с использованием системы QX200™ от Bio-Rad.
Капли вносят в 96-луночный планшет для ПЦР и помещают в циклер. Реакция проходит независимо в каждой капле (подробное руководство по капельной цифровой ПЦР на английском языке доступно на сайте Bio-Rad: Droplet DigitalTM PCR Applications Guide). В тех каплях, куда попала ДНК-мишень, образуется ПЦР-продукт, что приводит к увеличению уровня флуоресцентного сигнала от флуоресцентной метки: либо TaqMan-зондов, либо интеркалирующего красителя. После ПЦР капли независимо друг от друга проверяют в специальном устройстве (ридере) на наличие или отсутствие в них флуоресцентного сигнала (рис. 23). Количество капель с положительным и отрицательным сигналами подсчитывают для каждого образца, а программное обеспечение выдает концентрацию ДНК-мишени в виде числа копий в микролитре. Анализ продукта проходит в конечной точке после проведения ПЦР [38].
Рисунок 23. Автоматическая шприц-пипетка ридера капель извлекает капли из каждой лунки планшета для ПЦР.
В кцПЦР определение количества ДНК-мишени проводят не относительно, используя калибровочную кривую, как в случае с ПЦР в реальном времени, а прямым подсчетом капель с наличием или отсутствием в них ДНК-мишени. Это существенно увеличивает стабильность системы и ее устойчивость к ингибиторам ПЦР.
При наличии только двух флуоресцентных каналов (FAM и HEX/VIC) система позволяет запускать 4–5-плексные реакции за счет использования смеси зондов с одной нуклеотидной последовательностью, но меченных красителями FAM и HEX/VIC в различных пропорциях. Возможно также проводить 2–3-плексные реакции с интеркалирующим красителем EvaGreen, используя различную «емкость» разноразмерных ПЦР-продуктов для интеркалятора, что позволяет независимо подсчитать количество этих продуктов по разнице уровня их флуоресценции.
С помощью капельной цифровой ПЦР можно определять:
- количество интересующих молекул ДНК в образце;
- до 0,01% минорного, например мутантного, генома в присутствии генома нормальной ткани;
- вариации числа копий гена (copy namber variation, CNV);
- уровень экспрессии генов и микроРНК, включая детекцию небольших (до 10%) изменений уровня экспрессии;
- различия в геномном контенте и экспрессии между единичными клетками.
Метод активно используют в различных областях, но наиболее часто при:
- проведении онкоисследований, включая анализ свободной циркулирующей ДНК и образцов жидкой биопсии (EGFR, BRAF, KRAS и т.д.);
- детекции нужных вариантов в экспериментах по геномному редактированию (CRISPR/Cas9, ZFN, TALEN);
- изучении геномики единичных клеток (single cell).
Несмотря на сходство применения цифровой ПЦР и ПЦР в реальном времени, скорее всего, в будущем ddPCR будет постепенно вытеснять real-time PCR как основной ПЦР-метод количественного определения ДНК.
Альтернативы ПЦР
В этой главе опишем наиболее интересные и перспективные методы изотермической амплификации, которые могут составить конкуренцию стандартной ПЦР, если нужно узнать, есть ли в пробе та или иная последовательность. Эти методы особенно полезны для медицины и сельского хозяйства в полевых условиях, когда нужно обнаружить патогены в образцах растительного или животного происхождения. Если же перед экспериментатором стоят генно-инженерные цели, например, клонирование генов, то здесь, конечно, ПЦР вне конкуренции.
Опосредованная образованием петель изотермическая амплификация
Метод описали японские ученые в 2000 году [39]. LAMP (loop-mediated isothermal amplification) использует Bst-полимеразу из Geobacillus stearothermophilus, совмещающую полимеразную и хеликазную активности, что дает возможность исключить фазу денатурации и проводить реакцию при 60–65 °С. Подробно о методе написано в статье «Поиск иголки в стоге сена за 10 минут — подсвети себе LAMPой» [40].
LAMP, в отличие от обычной ПЦР, использует не два, а четыре или шесть праймеров, что увеличивает специфичность реакции, но в то же время повышает вероятность артефактов и эффекта множественности полос в электрофорезном геле. Однако это, по сути, не недостаток, так как метод рассчитан на детектирование результата невооруженным глазом («позитив»/«негатив») без электрофореза.
Хеликазозависимая амплификация
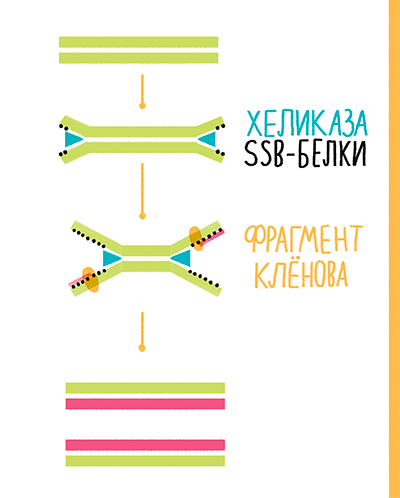
В 2004 году сотрудники компании New England Biolabs (NEB) предложили свою альтернативу полимеразной цепной реакции — хеликазозависимую амплификацию (helicase-dependent amplification, HDA). В реакции авторы предложили использовать хеликазу UvrD Escherichia coli, SSB-белки gp32 фага Т4 и фрагмент Клёнова exo− (рис. 24). Хеликаза раскручивает ДНК, SSB-белки стабилизируют цепи в разделенном состоянии, а фрагмент Клёнова синтезирует новую ДНК от 3ˊ-конца праймеров. Реакция проходит при 37 °С. Однако если перед ее постановкой провести денатурацию ДНК при 95 °С, эффективность повышается в 1,5–2 раза [41], [42]. Коммерческие наборы, выпускаемые сейчас NEB, вместо фрагмента Клёнова содержат Bst-полимеразу, а вместо UvrD E. coli — термостабильную хеликазу UvrD Thermoanaerobacter tengcongensis (Tte-UvrD), что позволяет проводить реакцию при 65 °С [43].
Рисунок 24. Схема хеликазозависимой амплификации.
К сожалению, у этого метода есть и недостатки. Для получения результатов, сравнимых с результатами стандартной ПЦР, всё-таки необходимо провести предварительную денатурацию образца. К тому же максимальный размер амплифицируемого фрагмента не превышает 120 п.н. Однако по некоторым данным, HDA улавливает в пробе меньшую концентрацию целевой ДНК, чем LAMP [44]. А если использовать хелимеразу (особым образом сшитые Tte-UvrD и Bst-полимеразу), созданную компанией BioHelix, то размер амплифицируемого фрагмента увеличивается до 1,5 т.п.н. [45].
Рекомбиназная полимеразная амплификация
В 2006 году британские ученые из биотехнологической компании TwistDX LTD разработали метод изотермической рекомбиназной полимеразной амплификации (РПА), который может составить сильную конкуренцию как обычной ПЦР, так и ПЦР в реальном времени [46].
Главное отличие РПА от обычной ПЦР в том, что реакция может проходить при комнатной температуре (25 °С), а оптимально — при 37–40 °С. В РПА используют большой фрагмент Bsu-полимеразы, SSB-белки gp32 фага Т4 и его же рекомбиназу uvsX. Часть молекул рекомбиназы связывают с одним праймером, часть — с другим. После внесения в реакционную смесь такие молекулы сканируют ДНК в поисках комплементарных праймеру участков и, найдя их, инициируют процесс расплетения двухцепочечной молекулы и присоединения праймера (рис. 25). Расплетенную ДНК стабилизируют SSB-белки, а полимераза начинает синтез. Процесс АТФ-зависимый, поскольку энергия нужна для освобождения 3ˊ-конца праймера от молекул рекомбиназы. Размер амплифицируемого фрагмента ограничивается тысячей пар нуклеотидов, а минимальная длина праймера должна быть 30 н. для повышения его специфичности [46].
Рисунок 25. Схема рекомбиназной полимеразной амплификации.
Процесс может длиться 15–30 минут, включая экстракцию образцов, что намного быстрее стандартной ПЦР [47]. Этот метод амплификации лишен значительных недостатков (кроме требования строгого соблюдения условий реакции) и может легко модифицироваться в РПА с обратной транскрипцией и РПА в реальном времени — как с интеркалирующими агентами, так и с флуоресцентными зондами.
Весной 2017 года американские ученые предложили на основе рекомбиназной полимеразной амплификации в сочетании с технологией CRISPR-Cas новый метод диагностики — SHERLOCK. О нем «Биомолекула» уже рассказывала в статье «SHERLOCK — молекулярный сыщик спешит на помощь!» [48].
Применение ПЦР
1. Клиническая медицина
- Анализ клинических образцов на наличие инфекционных агентов бактериальной и вирусной природы: ВИЧ, вирусов гепатита и герпеса, хламидий, хеликобактера, туберкулезных микобактерий и т.д.
- Диагностика лейкемии, лимфомы и других видов неоплазий, которые можно определить по мутациям в определенных генах. Мониторинг опухолевых заболеваний после терапии.
- Диагностика наследственных заболеваний, причина которых — мутации отдельных генов: серповидноклеточной анемии, бокового амиотрофического склероза, фенилкетонурии, муковисцидоза, мышечной дистрофии и т.п.
- Персонализированная медицина. Далеко не все лекарства одинаково действуют на всех людей. Одно и то же вещество может помогать одному пациенту и быть токсичным или аллергенным для другого из-за особенностей метаболических процессов у разных людей. Поэтому наиболее эффективны индивидуально подобранные дозировки индивидуально подобранных препаратов. Различия метаболизма обычно обусловлены генетически. Сделав пациенту своеобразный «генетический паспорт» таких особенностей, можно на его основе подбирать правильное лечение [49].
- Тканевая типизация перед трансплантацией органов.
- Обнаружение хромосомных кроссинговеров, делеций, инсерций, транслокаций и инверсий в отдельных сперматозоидах до оплодотворения.
2. Криминалистика и судебная медицина
- Установление личности преступников и жертв по ДНК из капель крови, волос и спермы с места преступления.
- Установление отцовства и иного родства.
- Расследование причин необъяснимой смерти («молекулярная аутопсия») — в комплексе с морфологическими и физиологическими данными [24].
3. Генная инженерия
- Клонирование ДНК для исследования функций генов, их взаимодействия, создания синтетических ДНК, генетически модифицированных организмов и пр. [50].
- Секвенирование ДНК [8], основанное на ПЦР, в ходе которой в синтезируемую цепь включается меченный флуоресцентной меткой или радиоактивным изотопом дидезоксинуклеотид, что приводит к терминации синтеза и позволяет определить положение конкретных нуклеотидов после разделения в геле (то есть пошагово прочитать их последовательность).
- Мутагенез, основанный на внесении изменений в ДНК посредством ПЦР.
- Создание гибридизационных зондов для различных видов блоттинга.
- Анализ экспрессии генов в тканях и отдельных клетках в разных условиях.
4. Антропология, палеонтология
- Изучение взаимосвязей между видами в эволюционной биологии.
- Исследование миграции людей и связи различных этносов, национальностей и рас.
- Изучение вымерших животных и предков человека.
- Исследование ДНК исторических личностей, например, Николая II [51], английского короля Ричарда III [52], египетских фараонов [53] и т.д.
5. Сельское хозяйство
- Обнаружение патогенов (бактерий, грибов, вирусов) у растений и животных.
- Диагностика наследственных заболеваний домашних и сельскохозяйственных животных.
- Анализ пищевых продуктов на содержание генетических модификаций.
- Обнаружение Х-хромосомы у животных, пол которых трудно определить невооруженным глазом: например, рыб, рептилий, попугаев.
Полимеразная цепная реакция — один из самых мощных и дешевых лабораторных методов. Его появление привело к воистину революционным изменениям в науке и медицине. И если сейчас для генетических экспресс-анализов появляются альтернативные техники, не требующие сложной аппаратуры, то в генетической инженерии ПЦР по-прежнему просто незаменима. Пожалуй, самые ценные свойства этого метода — совместимость с другими техниками и невероятная пластичность: они позволяют биологам и врачам с минимальными усилиями решать совершенно разные задачи. А главное, метод пока не исчерпал свой потенциал: до сих пор появляются всё новые его варианты, и, возможно, нас еще не раз удивят остроумные и неожиданные протоколы экспериментов, основанных на ПЦР.
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет февраль.
- Артур Корнберг (1918–2007);
- Peter M. Burgers. (2007). Arthur Kornberg (1918–2007). Molecular Cell. 28, 530-532;
- Lehman I.R., Bessman M.J., Simms E.S., Kornberg A. (1958). Enzymatic synthesis of deoxyribonucleic acid. I. Preparation of substrates and partial purification of an enzyme from Escherichia coli. J. Biol. Chem. 233, 163–170;
- K. Kleppe, E. Ohtsuka, R. Kleppe, I. Molineux, H.G. Khorana. (1971). Studies on polynucleotides. Journal of Molecular Biology. 56, 341-361;
- Chien A., Edgar D.B., Trela J.M. (1976). Deoxyribonucleic acid polymerase from the extreme thermophile Thermus aquaticus. J. Bacteriol. 127, 1550–1557;
- The Nobel Prize in Chemistry 1958. (2014). Nobelprize.org;
- Sanger F., Nicklen S., Coulson A.R. (1977). DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sci. USA. 74, 5463–5467;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- The Nobel Prize in Chemistry 1980. (2014). Nobelprize.org;
- Fore J.Jr., Wiechers I.R., Cook-Deegan R. (2006). The effects of business practices, licensing, and intellectual property on development and dissemination of the polymerase chain reaction: case study. J. Biomed. Discov. Collab. 1, 7;
- Mullis K.B. (1990). The unusual origin of the polymerase chain reaction. Scientific American. 4, 56–61;
- R. Saiki, S Scharf, F Faloona, K. Mullis, G. Horn, et. al.. (1985). Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. Science. 230, 1350-1354;
- Bartlett J.M. and Stirling D. (2003). A short history of the polymerase chain reaction. Methods Mol. Biol. 226, 3–6;
- Википедия: Kary Mullis (англ.);
- R. Saiki, D. Gelfand, S Stoffel, S. Scharf, R Higuchi, et. al.. (1988). Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science. 239, 487-491;
- Википедия: History of polymerase chain reaction (англ.);
- M. J. McPherson and S. G. Moller. PCR (The dasics). 2nd edition. NY: Taylor & Francis Group, 2006. — 292 p.;
- Vondrejs V. a Storchová Z. Genové inženýrsrví I. Praha: Nakladatelství University Karlovy, 1997;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Мода на ретро. Где встречается обратная транскрипция, и как она эволюционировала;
- D. Rappolee, D Mark, M. Banda, Z Werb. (1988). Wound macrophages express TGF-alpha and other growth factors in vivo: analysis by mRNA phenotyping. Science. 241, 708-712;
- Carmen RUTTIMANN, Milena COTORAS, Josefina ZALDIA, Rafael VICUNA. (1985). DNA polymerases from the extremely thermophilic bacterium Thermus thermophilus HB-8. Eur J Biochem. 149, 41-46;
- Russell Higuchi, Gavin Dollinger, P. Sean Walsh, Robert Griffith. (1992). Simultaneous Amplification and Detection of Specific DNA Sequences. Nat Biotechnol. 10, 413-417;
- Hernandez-Rodriguez P. and Ramirez A.G. Polymerase chain reaction: types, utilities and limitations. In: Polymerase chain reaction / ed. by Hernandez-Rodriguez P. Rijeka, Croatia: InTech, 2012. — 566 p.;
- Seifi M., Ghasemi A., Heidarzadeh S., Khosravi M., Namipashaki A., Soofiany V.M. et al. Overview of real-time PCR principles. In: Polymerase chain reaction / ed. by Hernandez-Rodriguez P. Rijeka, Croatia: InTech, 2012. — 566 p.;
- Mikael Kubista, José Manuel Andrade, Martin Bengtsson, Amin Forootan, Jiri Jonák, et. al.. (2006). The real-time polymerase chain reaction. Molecular Aspects of Medicine. 27, 95-125;
- Маерле А.В., Сергеев И.В., Алексеев Л.П. (2014). Метод иммуно-ПЦР: перспективы использования. Иммунология. 1, 44–48;
- T Sano, C. Smith, C. Cantor. (1992). Immuno-PCR: very sensitive antigen detection by means of specific antibody-DNA conjugates. Science. 258, 120-122;
- Рязанцев Д.Ю., Воронина Д.В., Завриев С.К. (2016). Иммуно-ПЦР: достижения и перспективы. Успехи биологической химии. 56, 377–410;
- Michael Adler, Ron Wacker, Christof M. Niemeyer. (2003). A real-time immuno-PCR assay for routine ultrasensitive quantification of proteins. Biochemical and Biophysical Research Communications. 308, 240-250;
- Christof M. Niemeyer, Michael Adler, Ron Wacker. (2005). Immuno-PCR: high sensitivity detection of proteins by nucleic acid amplification. Trends in Biotechnology. 23, 208-216;
- Coren A Milbury, Jin Li, Pingfang Liu, G Mike Makrigiorgos. (2011). COLD-PCR: improving the sensitivity of molecular diagnostics assays. Expert Review of Molecular Diagnostics. 11, 159-169;
- P. Markoulatos, N. Siafakas, M. Moncany. (2002). Multiplex polymerase chain reaction: A practical approach. J. Clin. Lab. Anal.. 16, 47-51;
- Baldy-Chudzik K. (2001). Rep-PCR — a variant to RAPD or an independent technique of bacteria genotyping? A comparison of the typing properties of rep-PCR with other recognised methods of genotyping of microorganisms. Acta Microbiol. Pol. 50, 189–204;
- Jean-Francois Mercier, Gary W. Slater, Pascal Mayer. (2003). Solid Phase DNA Amplification: A Simple Monte Carlo Lattice Model. Biophysical Journal. 85, 2075-2086;
- Sykes P.J., Neoh S.H., Brisco M.J., Hughes E., Condon J., Morley A.A. (1992). Quantitation of targets for PCR by use of limiting dilution. Biotechniques. 13, 444–449;
- Benjamin J. Hindson, Kevin D. Ness, Donald A. Masquelier, Phillip Belgrader, Nicholas J. Heredia, et. al.. (2011). High-Throughput Droplet Digital PCR System for Absolute Quantitation of DNA Copy Number. Anal. Chem.. 83, 8604-8610;
- Киселева Я.Ю., Птицин К.Г., Радько С.П., Згода В.Г., Арчаков А.И. (2016). Цифровая капельная ПЦР — перспективный технологический подход к количественному профилированию микроРНК. Биомедицинская химия. 4, 403–410;
- Notomi T., Okayama H., Masubuchi H., Yonekawa T., Watanabe K., Amino N., Hase T. (2000). Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 28, e63;
- Поиск иголки в стоге сена за 10 минут — подсвети себе LAMPой;
- Myriam Vincent, Yan Xu, Huimin Kong. (2004). Helicase-dependent isothermal DNA amplification. EMBO Rep. 5, 795-800;
- Lei Yan, Jie Zhou, Yue Zheng, Adam S. Gamson, Benjamin T. Roembke, et. al.. (2014). Isothermal amplified detection of DNA and RNA. Mol. BioSyst.. 10, 970;
- Fei Ma, Meng Liu, Bo Tang, Chun-yang Zhang. (2017). Sensitive Quantification of MicroRNAs by Isothermal Helicase-Dependent Amplification. Anal. Chem.. 89, 6182-6187;
- Celine Zahradnik, Claudia Kolm, Roland Martzy, Robert L. Mach, Rudolf Krska, et. al.. (2014). Detection of the 35S promoter in transgenic maize via various isothermal amplification techniques: a practical approach. Anal Bioanal Chem. 406, 6835-6842;
- Aurélie Motré, Ying Li, Huimin Kong. (2008). Enhancing helicase-dependent amplification by fusing the helicase with the DNA polymerase. Gene. 420, 17-22;
- Olaf Piepenburg, Colin H Williams, Derek L Stemple, Niall A Armes. (2006). DNA Detection Using Recombination Proteins. PLoS Biol. 4, e204;
- Binoy Babu, Brian K. Washburn, Tülin Sarigül Ertek, Steven H. Miller, Charles B. Riddle, et. al.. (2017). A field based detection method for Rose rosette virus using isothermal probe-based Reverse transcription-recombinase polymerase amplification assay. Journal of Virological Methods. 247, 81-90;
- SHERLOCK — молекулярный сыщик спешит на помощь!;
- От медицины для всех — к медицине для каждого!;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Фишман Р. (2016). Как идентифицировали останки Николая II и его семьи по ДНК. «Популярная механика»;
- Антонов Е. (2014). «Дело» короля Ричарда III «закрыли» спустя 529 лет. «Наука и жизнь»;
- Власова Е. (2017). Палеогенетики секвенировали ДНК древних египтян. N+1.
Что такое ПЦР
Полимеразная цепная реакция — высокоточный метод молекулярной биологии, который позволяет обнаружить в биоматериале ДНК и РНК патогенов. Отличается чувствительностью и специфичностью, а также скоростью получения результата.
В последнее время метод часто используется для диагностики новой коронавирусной инфекции COVID-19.
Полимеразную цепную реакцию изобрёл учёный-биохимик Кэри Муллис в 1983 году. Через 10 лет он получил за это Нобелевскую премию по химии.
Как работает ПЦР
В ходе исследования пробирку с биоматериалом помещают в особые условия, под воздействием которых молекулы нуклеиновой кислоты (двухнитевая ДНК, присутствующая в пробе или синтезированная из однонитевой РНК), кодирующие генетическую информацию определённого патогена, многократно копируются.
Если в исследуемом образце было хотя бы небольшое количество патогенных частиц, то через несколько часов их число увеличится до десятков и даже сотен миллионов. Это позволяет легко обнаружить возбудителя инфекции или генетическую «поломку» при очень низких рисках ложноотрицательного результата.
Молекула ДНК
Разновидности ПЦР
ПЦР — перспективное направление исследований. Учёные постоянно совершенствуют способы проведения реакции и изобретают новые методики, адаптируя ПЦР под разные цели.
В лабораторной диагностике применяются два основных метода — ПЦР в режиме реального времени и ПЦР с обратной транскрипцией.
С помощью ПЦР в режиме реального времени (количественной) можно не только выявить патогенные ДНК-молекулы, но и подсчитать количество их копий. Это позволяет рассчитать степень инфицирования, дозировку лекарств и длительность их приёма.
ПЦР с обратной транскрипцией применяется, если в качестве искомого генетического материала выступает не ДНК, а РНК вируса.
Дело в том, что у некоторых патогенов, например у вируса гепатита C, генетический материал представлен только РНК — однонитевой цепочкой нуклеотидов, в отличие от двухцепочечной ДНК-молекулы. Она тоже несёт в себе генетическую информацию, но не подходит для стандартной ПЦР.
Чтобы провести исследование, РНК-молекуле «восстанавливают» вторую нить с помощью особого фермента — обратной транскриптазы. Так РНК превращается в ДНК-молекулу, готовую к дальнейшему копированию с помощью стандартной ПЦР или ПЦР в режиме реального времени.
Как происходит ПЦР
Что нужно для ПЦР
Для проведения полимеразной цепной реакции используется специальный прибор — амплификатор. Он поддерживает необходимую для каждого этапа температуру и проводит циклы копирования ДНК — амплификацию.
Когда молекул становится достаточно для распознавания, оборудование анализирует их, а затем выдает качественный или количественный результат.
Пробирки с биоматериалом, подготовленным для ПЦР, в амплификаторе
Помимо амплификатора, для ПЦР необходимы определённые компоненты:
- Целевая ДНК — частица ДНК искомого патогена. Она состоит из уникальной последовательности нуклеотидов. Например, при ПЦР-анализе на герпес целью служит та часть ДНК, которая отличает вирус герпеса от других вирусов. Целевую ДНК также называют ДНК-матрицей.
Нити ДНК и РНК состоят из маленьких звеньев — нуклеотидов. Их последовательность образует генетический код, несущий наследственную информацию.
- Два праймера — короткие нити из нуклеотидов, которые подходят к искомым нитям ДНК, как детали пазла. На основе праймеров в ходе ПЦР создаются новые ДНК-молекулы. Если праймеры не подошли, значит, целевой ДНК в биоматериале нет.
- ДНК-полимераза — фермент, который достраивает нить ДНК в ходе ПЦР.
- Дезоксинуклеотидтрифосфаты (дНТФ) — смесь нуклеотидов, строительный материал для копий ДНК-молекул.
- Ионы магния (Mg2+) — поддерживают активность ДНК-полимеразы.
- Буферный раствор — смесь, которая создаёт оптимальные условия для биохимической реакции.
Этапы полимеразной цепной реакции
ПЦР состоит из трёх основных этапов.
Сначала пробу нагревают, и все ДНК-молекулы, которые есть в биоматериале, распадаются на две нити РНК. Этот процесс называется денатурацией.
Если генетический материал патогена — РНК, а не ДНК, то перед денатурацией проводят ПЦР с обратной транскрипцией. Этот метод позволяет превратить РНК в ДНК-молекулу.
Затем температуру снижают. Если в пробе есть целевая ДНК, праймеры присоединяются к концам двух её нитей — так происходит отжиг.
После отжига фермент ДНК-полимераза активируется и начинает достраивать вторую нить ДНК, начиная от праймера. Для восстановления цепи ДНК полимераза использует дНТФ. Заключительный этап называют элонгацией.
При проведении ПЦР выполняют более 30 циклов копирования (амплификации). В результате каждого цикла количество ДНК-цепей удваивается. Так, если на первом цикле было 2 цепи ДНК, на втором их будет уже 4, а на третьем — 8, и так далее.
Какие инфекции позволяет выявить ПЦР
Каждый патоген — бактерия, вирус или гриб — содержит уникальные РНК- или ДНК-молекулы.
По наличию этих молекул в биоматериале можно быстро и точно диагностировать заражение болезнетворными микроорганизмами. Но есть важное условие: у ПЦР-исследования должна быть цель — конкретный патоген, наличие которого нужно подтвердить или опровергнуть. Как правило, цель ПЦР определяет врач на основании осмотра, инструментального обследования и жалоб пациента.
Вирусные инфекции
У любых вирусов есть ДНК- или РНК-молекулы. ПЦР позволяет обнаружить их в организме, а ПЦР в реальном времени — ещё и подсчитать количество амплифицированных копий. Результат ПЦР может помочь врачу поставить диагноз, определить стадию болезни, подобрать дозировку лекарств и определить длительность курса лечения.
Бактериальные инфекции
Как и у вирусов, у всех бактерий есть ДНК-молекулы, которые можно выявить с помощью ПЦР.
Но не все бактерии, в отличие от вирусов, вредны. Например, условно-патогенные бактерии в небольших количествах приносят пользу организму. Однако, если по каким-либо причинам их становится слишком много, возникает бактериальный дисбаланс — дисбактериоз. Это состояние вредит здоровью.
Чаще всего условно-патогенные бактерии становятся причиной кожных, кишечных и гинекологических заболеваний. Для их диагностики используют качественную ПЦР и ПЦР в режиме реального времени — она позволяет выявить, превысило ли количество бактерий норму, и если да, то насколько сильно.
Опираясь на результат такого анализа, врач может рассчитать дозировку и длительность применения лекарств, оптимальную для восстановления нормальной микрофлоры.
Грибковые инфекции
В большинстве случаев для диагностики грибковых инфекций используется микроскопия: визуально обнаружить грибок не составляет труда, особенно при наличии выраженных симптомов.
Однако в некоторых случаях, например при кандидозе (молочнице), широко применяется ПЦР. Это связано с двумя основными факторами.
Во-первых, возбудитель кандидоза(кандида) — условно-патогенный грибок. Она становится болезнетворной, только если её слишком много.
ПЦР в режиме реального времени позволяет уточнить, насколько сильно «разрослась» кандида, и подобрать оптимальную дозировку препарата, чтобы сократить её количество.
Во-вторых, слизистые оболочки урогенитального тракта, влагалища и рта густо населены различными микроорганизмами. ПЦР в таком случае — более точный метод диагностики благодаря своей прицельности.
Где ещё применяют ПЦР
Поскольку генетический код есть у всех живых существ, ПЦР-метод применяется везде, где может понадобиться многократное увеличение числа ДНК- и РНК-молекул. Например, для получения пригодного для дальнейших исследований генетического материала с места преступления или поиска конкретных генетических мутаций.
ПЦР в установлении родства
Если биоматериала недостаточно для определения родства, перед основным анализом может потребоваться амплификация молекул ДНК. Большое количество биоматериала позволит провести более точное исследование. Например, установить пол, вид или родство как живых, так и мёртвых существ.
ПЦР в диагностике предрасположенностей
С помощью ПЦР можно выявить определённые гены, которые отвечают за предрасположенность человека к различным состояниям (например, к избыточному весу) или болезням.
Подобные исследования назначаются, если пациенту нужен план профилактики развития заболеваний.
ПЦР в диагностике генетических мутаций
Ещё полимеразная цепная реакция позволяет обнаруживать в генах мутации, которые могут влиять на эффективность лечения различных заболеваний. Например, в случае бронхиальной астмы или сердечной недостаточности результат исследования на ген бета-2-адренорецептора ADRB2 может помочь врачу подобрать лекарства.
Кроме того, некоторые мутации в генах могут служить маркерами онкологических заболеваний. Их обнаружение позволяет специалистам подобрать наиболее эффективную терапию и спрогнозировать дальнейшее развитие патологий.
ПЦР в судебно-медицинской экспертизе и криминалистике
Более узкая сфера для применения генетических ПЦР-тестов — расследования.
Почти 99,9% ДНК разных людей идентичны. Однако оставшаяся 0,1% — это уникальная часть генетического кода, которая отличает людей друг от друга. Выделение и сравнение этих уникальных частей позволяет идентифицировать преступника или жертву.
ПЦР может применяться в тех случаях, когда генетического материала слишком мало для точного исследования. Например, если были найдены разложившиеся останки тела или оно сильно обгорело, и опознать его невозможно.
В случае поиска преступника генетический материал может помочь доказать вину подозреваемого. ПЦР позволяет выделить ДНК из любых биологических «следов», которые злоумышленник мог оставить. Подойдут кровь, слюна, моча, волосы, семенная жидкость, частицы кожи под ногтями жертвы. Выделить ДНК можно даже из отпечатка пальца.
Отпечаток пальца содержит около 10 нанограмм ДНК. Для исследования достаточно 0,1 нанограмма.
ПЦР в ветеринарии
Ветеринары используют ПЦР так же, как и врачи: для диагностики у животных различных инфекционных заболеваний, а также оценки эффективности лечения.
У диких и бродячих животных ПЦР помогает выявить патогены, которые передаются людям и вызывают опасные для жизни заболевания. Например, бешенство, бубонную чуму, некоторые виды гриппа, оспу и другие.
ПЦР в растениеводстве
Для выявления фитопатологий — заболеваний растений — полимеразная цепная реакция тоже применяется. Она позволяет обнаружить вирусы, бактерии и грибы, которые могут привести к частичной или полной гибели урожая.
Проблемой применения ПЦР в растениеводстве служит только стоимость оборудования, которое не все хозяйства могут себе позволить, а также высокая чувствительность метода. Дело в том, что если образец загрязнён незначительным количеством патогена, результат анализа будет положительным.
Эта особенность требует более тщательной подготовки растительного материала к исследованию, а также стерильных условий в лаборатории и дополнительных проверочных тестов.
ПЦР в контроле потребительских продуктов
ПЦР может использоваться для контроля применения генно-модифицированных организмов (ГМО), которые часто присутствуют в продуктах питания и различных кормах.
Генно-модифицированные организмы создаются с помощью генной инженерии — «редактирования» исходного генетического кода организма и «прививания» ему полезных свойств. Это позволяет приспособить растения к неблагоприятному климату, вредителям или химикатам, а также заставить их быстрее расти или приносить больше плодов.
ПЦР позволяет многократно копировать удачную ДНК-молекулу, выявлять ГМО, а также создавать миллионы образцов для дальнейшего применения или для новых экспериментов и разработок.
Преимущества ПЦР
Полимеразная цепная реакция считается одним из самых эффективных способов выявить инфицирование. Метод точен — он позволяет обнаружить искомый патоген, даже если его концентрация в пробе крайне мала.
Кроме того, результат ПЦР не зависит от иммунной реакции организма, культивационных особенностей патогена или стадии инфицирования.
Точность
Точность ПЦР складывается из двух критериев — чувствительности и специфичности.
Чем ниже вероятность ложноотрицательного результата, тем выше чувствительность метода.
Чувствительность ПЦР составляет 90–100% — с такой вероятностью анализ выявит патоген, если он действительно есть в пробе.
По сравнению с полимеразной цепной реакцией, другие методы менее чувствительны. Так, например, чувствительность иммуноферментного анализа составляет 50–70%, а культурального исследования — 60–80%.
Чем ниже вероятность ложноположительного результата, тем выше специфичность метода.
Специфичность ПЦР достигает 100%. Если в биоматериале нет подходящей РНК или ДНК, реакция не произойдёт.
Высокой специфичностью обладает и культуральный метод, однако он менее чувствителен, и это снижает его общую точность.
Иммуноферментный анализ, в отличие от ПЦР и культурального метода, выявляет не патоген, а антитела — особые белки, которые иммунная система вырабатывает для борьбы с ним.
После болезни антитела могут давать перекрёстную реакцию с другими антителами. Например, при анализе на болезнь Лайма положительный результат могут дать антитела к возбудителю инфекционного мононуклеоза и другим герпес-вирусам. В обоих случаях результат может быть ложным, так как фактически пациент не заражён искомым патогеном и/или заражён чем-то другим.
Таким образом, высокая чувствительность и специфичность полимеразной цепной реакции делают её одним из самых точных методов лабораторной диагностики.
Скорость
В большинстве случаев результат ПЦР можно получить через один день.
Срок готовности посева (культуральный метод) — в среднем от двух-трёх дней.
Готовность результата иммуноферментного анализа — в среднем около двух дней.
Независимость от особенностей патогена
По сравнению с другими методами лабораторной диагностики, на успех ПЦР не влияют некоторые характеристики патогенов.
Так, например, суть культурального метода (посева) заключается в выращивании бактерий и грибов на комфортной для них питательной среде.
Если в пробе были микроорганизмы, со временем их численность увеличится и станет заметна даже без микроскопа.
Однако некоторые бактерии культивировать сложно. Например, боррелии и бледная трепонема настолько требовательны к условиям питательной среды и посева, что этот метод невозможно применять в лабораторной диагностике болезни Лайма и сифилиса.
Риккетсии и хламидии — внутриклеточные паразиты, они в целом не выращиваются в лабораторных условиях, а шигеллы и сальмонеллы не всегда активны и в определённых фазах не размножаются.
На эффективность ПЦР особенности выращивания грибов и бактерий не влияют. Более того, с помощью ПЦР можно проводить исследование ещё и на вирусы.
Колонии бактерий, выращенные культуральным методом
Независимость от иммунной реакции и наличия симптомов
Серологические исследования опираются на наличие у больного антител к патогенам. Если заражение произошло недавно, инфекция протекает в скрытой форме или у пациента есть иммунные нарушения, результат серологического исследования может быть ложным.
Так, например, первые антитела к возбудителю гепатита B появляются только через 1–3 месяца. Соответственно, ранняя диагностика болезни с помощью анализа на антитела будет неэффективна.
Кроме того, иммунная система некоторых пациентов вообще не вырабатывает антитела при подтверждённой ПЦР инфекции. Такое бывает, например, при клещевом энцефалите.
ПЦР, напротив, не зависит от иммунной реакции, и с её помощью можно диагностировать заболевание в самом начале — до появления антител и первых симптомов.
Около 50% серологических исследований на гепатит B в инкубационном и начальном периоде дают ложноотрицательный результат при положительной ПЦР.
Как и при многих других инфекционных заболеваниях, при гепатите ранняя диагностика играет важную роль. Она позволяет сразу начать лечение, минимизировать последствия болезни и предотвратить дальнейшее распространение возбудителя. В таких случаях ПЦР — предпочтительный метод исследования.
Недостатки ПЦР
Точечное применение
ПЦР должна иметь одну определённую цель — патоген, генетический материал которого будет копироваться.
Если у пациента микст-инфекция (заражение сразу несколькими патогенами), ПЦР-исследование обнаружит только тот патоген, на который ориентирован анализ. Обнаружить дополнительные вирусы или бактерии заодно с целевым инфекционным агентом не получится.
Чувствительность оборудования
Оборудование для ПЦР очень чувствительное и требует стерильности как в процедурном кабинете, так и в самой лаборатории.
До 70% ошибочных результатов ПЦР связаны с нарушением правил подготовки проб.
Если проба случайно загрязнится в процессе взятия, транспортировки или добавления реагентов, результат исследования может быть ложным.
Как подготовиться к сдаче анализа методом ПЦР
Основная задача при взятии биоматериала для ПЦР — не загрязнить его. Для этого нужно строго соблюдать правила подготовки.
Подготовка к ПЦР-анализу крови
- Кровь следует сдавать натощак, с 8 до 11 часов утра. В течение дня показатели крови могут существенно меняться, результат утреннего анализа — самый достоверный.
- За 24 часа до теста следует исключить алкоголь и воздержаться от интенсивных физических нагрузок.
- За 8 часов до взятия крови не следует есть, а также пить соки, молоко или другие напитки. Можно пить негазированную воду. Накануне исследования лучше поужинать лёгкой, нежирной пищей.
- За 1–2 часа до анализа желательно не курить, избегать стресса и физического напряжения (бег, быстрый подъём по лестнице).
- За 15 минут до взятия крови желательно немного отдохнуть: посидеть в лабораторном отделении, отдышаться, успокоиться.
- За 1–2 дня до исследования исключить из рациона продукты с высоким содержанием жиров. За 2 дня до сдачи крови на вирусные гепатиты исключить из рациона цитрусовые, оранжевые фрукты и овощи.
Правила взятия крови у детей:
- младенцы до 1 года
- дети до 7 лет
Для контроля показателей в динамике следует сдавать анализ в одинаковых условиях: в той же лаборатории, в то же время суток.
Лекарства и медицинские процедуры могут повлиять на результат анализа.
Не следует сдавать кровь сразу после физиотерапевтических процедур, инструментального обследования, рентгенологического или ультразвукового исследования, массажа.
Лучше всего выполнять исследование крови до начала приёма лекарственных препаратов или через 10–14 дней после их отмены. О принимаемых лекарствах следует предупредить медсестру, а также врача, который выполняет диагностику или назначает лечение.
Исследования для оценки эффективности лечения, как правило, проводят через 1–2 недели после последнего приёма препарата.
Подготовка к ПЦР-анализу мочи
За 24 часа до анализа следует исключить из рациона продукты, меняющие цвет и химический состав мочи: алкогольные напитки, «красящие» овощи — свёклу и морковь, а также специи и соль. По согласованию с врачом лучше отказаться от приёма мочегонных препаратов.
Перед взятием биоматериала необходимо тщательно вымыть наружные половые органы.
Женщинам рекомендуется обработать половые губы ватными тампонами: сначала — смоченными в тёплой воде с мылом, затем — смоченными в чистой воде.
Движения тампона должны быть направлены от лобка к заднему проходу. Лишнюю влагу удалить чистой салфеткой.
Мужчинам следует тщательно вымыть отверстие мочеиспускательного канала тёплой водой с мылом, оттянув кожную складку, промыть водой и промокнуть чистой салфеткой.
Биоматериал следует собрать в одноразовый стерильный контейнер. Его можно бесплатно получить в любом лабораторном отделении Гемотест.
Инструкция по использованию контейнера
- Открутите крышку контейнера и положите её, не касаясь внутренней части крышки.
- Соберите первую порцию мочи в контейнер.
- Если мочу на анализ берут у ребёнка, можно использовать мочеприёмник.
- Закройте контейнер крышкой и плотно закрутите её.
- Доставьте контейнер в лабораторное отделение в течение 2 часов после взятия биоматериала.
Подготовка к ПЦР-анализу кала
Кал следует сдавать до приёма антибиотиков или не ранее, чем через 12 часов после приёма препарата.
За 72 часа до исследования откажитесь от использования ректальных свечей и масел, слабительных средств и клизм, а также прекратите приём препаратов, оказывающих влияние на работу кишечника и окраску кала.
Соберите образец кала после естественного опорожнения кишечника без применения клизм или слабительных средств.
Позаботьтесь о том, чтобы в биоматериал не попали посторонние примеси: вода, моча, выделения половых органов, дезинфицирующие средства и химические вещества, содержащиеся в подгузниках:
- перед дефекацией вымойте и высушите промежность;
- соберите кал с чистой и не впитывающей влагу поверхности: это может быть чистый пакет из полиэтилена, клеёнка, чистое судно или горшок.
Собирать кал из унитаза, пелёнок или подгузников — нельзя!
Поместите 1–2 чайные ложки биоматериала в герметичный контейнер. Если нужно выполнить несколько анализов, подготовьте для каждого исследования отдельную порцию биоматериала в отдельном контейнере.
Доставьте контейнер в лабораторное отделение в течение 2 часов после сбора. Чтобы сохранить температуру контейнера, можно поместить его в термос с кубиком льда или в пакет с хладоэлементами.
Если отслеживаете показатели в динамике, сдавайте каждый анализ при одинаковых условиях: в том же лабораторном отделении, тем же методом.
Исследования для оценки эффективности лечения, как правило, проводят через 2–4 недели после приёма антибактериальных препаратов.
Подготовка к ПЦР-анализу слюны
За 24 часа до исследования по предварительному согласованию с лечащим врачом следует отказаться от терапии полости рта какими-либо лекарственными препаратами.
За 3 часа до исследования рекомендуется отказаться от курения, употребления пищи и гигиены полости рта (полоскание, чистка зубов, применение освежителей для рта, употребление леденцов, жевательной резинки).
Подготовка к ПЦР-анализу мокроты
- За 2 недели до исследования по согласованию с лечащим врачом следует прекратить приём противомикробных препаратов и иммуномодуляторов.
- Мокроту следует собирать утром, сразу после пробуждения. Предварительно нужно почистить зубы и прополоскать рот, нельзя есть до взятия биоматериала.
- Важно собирать не слюну или носоглоточную слизь, а мокроту. Сделайте несколько глубоких вдохов, чтобы вызвать «мокрый» кашель. Необходимо откашлять содержимое глубоких дыхательных путей.
- Сплюньте мокроту в заранее подготовленный стерильный контейнер с плотно закрывающейся крышкой. Минимальный объём мокроты — 1 мл.
- Доставьте контейнер в лабораторное отделение в день взятия биоматериала.
Подготовка к соскобу из зева
За 24 часа до исследования по предварительному согласованию с лечащим врачом следует отказаться от терапии полости рта какими-либо лекарственными препаратами.
За 3 часа до исследования рекомендуется отказаться от курения, употребления пищи и гигиены полости рта (полоскание, чистка зубов, применение освежителей для рта, употребление леденцов, жевательной резинки).
Подготовка к соскобу из влагалища или урогенитального тракта
За 30 дней до исследования следует прекратить применение антибиотиков по согласованию с лечащим врачом.
За 24 часа до исследования не следует проводить спринцевание, внутривагинальную терапию (свечи, тампоны), не использовать антисептические средства (в том числе мирамистин), исключить половой контакт.
В день исследования запрещается проводить туалет половых органов.
Женщинам рекомендуется сдавать анализ до менструации или через 5 дней после её окончания.
Мужчинам рекомендуется не мочиться в течение 3 часов (15–20 минут в случае обильных уретральных выделений) до взятия материала.
Удаление
родинок, папиллом
Выгода до 50%
Быстро!
Безболезненно!
Без реабилитации!

СКИДКА 25%
Диагностика у гинеколога*
Все за один день — всего за 8 200 руб.
*подробности у администратора

Скидка до 25%
Диагностика у уролога
Чек-апп от 5 350 руб.
Обследование за один день

Скидка 50%
на прием ЛОР-врача

СКИДКА 50%
прием врача-терапевта

Интимное омоложение
Скидка 20%*
Эффект от первой процедуры!
Сохрани чувствительность!
Совершенно не больно

Лабораторное проведение ПЦР-анализа: основные этапы
Анализ ПЦР (полимеразная цепная реакция) – метод диагностики высокой точности, который позволяет выявлять разные виды инфекции. Для этого в лабораторных условиях проводится исследование генетического материала (слюны, мокроты, крови, выделений из половых органов и других биологических материалов).
На первоначальном этапе проведения ПЦР-анализа производится забор материала для исследования. При этом должны быть соблюдены правила: обеспечение полной стерильности, использование исключительно одноразовых материалов.
После забора биоматериал при помощи щеточки помещается в контейнер с физраствором. Лабораторное исследование взятых проб должно быть выполнено как можно быстрее после забора.
ПЦР-анализ ДНК в лаборатории включает три этапа:
- выделение;
- ампликация фрагментов;
- детекция продуктов ампликации.
Когда врач выполнил забор биоматериала у пациента и провел его специальную обработку, двойная спираль ДНК расщепляется на отдельные нити. При добавлении специальной жидкости в биоматериал, растворяются органические вещества, которые мешают «чистоте» реакции. Как следствие, после устранения липидов, аминокислот, пептидов, углеводов, белков, полисахаридов, образуются ДНК либо РНК.
Время, которое требуется на выделение ДНК, зависит от вида возбудителя инфекции, а также биоматериала, который используется для проведения анализа. Так, к примеру, если будет исследоваться кровь, подготовительный этап занимает до двух часов.
Для ампликации ДНК применяются специальные матрицы. Чтобы провести данный этап, вполне достаточно небольшого кусочка ДНК, который характерный только для конкретной инфекции.
Ампликация ДНК – это многократное увеличение количества копий ДНК, которые характерны только для определенного организма. Всю цепь не обязательно достраивать, чтобы увидеть, что является возбудителем инфекции. Требуется только участок, который является характерным для конкретной бактерии.
Чтобы провести ПЦР-диагностику, используется специальное программируемое оборудование, которое автоматически меняет температуру. При проведении амплификации задается программа, которая соответствует определенной инфекции. Занимает данный этап приблизительно 2-3 часа.
Детекция продуктов асплификации подразумевает разделение смеси продуктов амплификации, которая была получена. Для этого добавляются специальные растворы, чтобы фрагменты ДНК отражались светящимися полосами оранжево-красного цвета. Это свечение показывает наличие ДНК вирусов, бактерий и микроорганизмом в биоматериале пациента, точно определяя их конкретный вид.
читать далее
свернуть
АНАЛИЗЫ, КОТОРЫЕ МОЖНО СДАТЬ У НАС:
-
Covid-19. Анализы на антитела к коронавирусу
-
Анализы на инфекции
-
Анализы Подготовка и расшифровка
-
Анализ кала
-
Анализ крови на RW
-
Анализ крови на сахар
-
Анализ крови на хламидиоз
-
Анализ мочи
-
Анализ мочи по Нечипоренко
-
Анализ мочи при беременности
-
Анализ на АФП
-
Анализ на ВИЧ
-
Анализ на гемоглобин
-
Анализ на гормон ЛГ
-
Анализ на гормоны
-
Анализ на дисбактериоз
-
Анализ на кортизол
-
Анализ на краснуху
-
Анализ на онкомаркеры
-
Анализ на остеопороз
-
Анализ на паразитов
-
Анализ на паракоклюш
-
Анализ на прогестерон
-
Анализ на пролактин
-
Анализ на РАРР-А
-
Анализ на РЭА
-
Анализ на Са-125
-
Анализ на Са-19-9
-
Анализ на совместимость
-
Анализ на тестостерон
-
Анализ на ТТГ
-
Анализ на ФСГ
-
Анализ на эстриол
-
Анализ соскоба на наличие яиц остриц
-
Анализ спермы (Спермограмма)
-
Анализы на грибок
-
Биохимический анализ крови
-
Гемостазиограмма, Коагулограмма
-
ДНК-диагностика
-
Достоинства и недостатки ПЦР-диагностики
-
Метод ПЦР в гинекологии
-
Ошибки в ПЦР-диагностике
-
ПЦР и ИФА-диагностика
-
Современная ДНК-диагностика
-
Строение ДНК
- Этапы полимеразной цепной реакции (ПЦР)
-
-
Общий анализ крови (Клинический анализ крови)
-
Общий мазок
-
Определение беременности. Анализ крови на беременность
-
-
Анализы при бесплодии
-
Анализы при дисфункции яичников
-
Анализы при кистах и опухолях яичников
-
Анализы при нарушениях веса
-
Анализы при подборе гормональной контрацепции
-
Анализы при подготовке к беременности
-
Молекулярно-генетические исследования
-
Обследование молочных желез
-
Обследование при гирсутизме и проблемах с волосами
-
Обследование при задержке менструации
-
Обследование при зуде гениталий
-
Обследование при менопаузе
-
Обследование при невынашивании беременности
-
Обследование при эндометриозе
-
Обследование щитовидной железы
-
Обследования при определении овуляции
-
Полное обследование организма
-
Эрозия шейки матки
Остались вопросы? Мы перезвоним Вам в течении 10 минут
Наши цены
-
Covid-19 метод ПЦР
Наименование услуги Цена, ₽ ПЦР-тест на Covid-19, мазок (ПЦР-тест на коронавирус SARS-CoV-2) 1 990 Экпресс тест ПЦР на Covid-19, мазок (Экспресс-тест, ПЦР, РНК вируса SARS-CoV-2) 3 890 Забор биоматериала 390 -
Covid-19 определение антител IgG
Наименование услуги Цена, ₽ Антитела количественные к спайковому (S) белку SARS-CoV-2, IgG (Anti-SARS-CoV-2, spike (S) protein, IgG, quantitative)
1 490 Антитела качественные к спайковому (S) белку SARS-CoV-2, IgG;. (Аnti-SARS-CoV-2 S (spike) protein antibody, IgG, qualitative). С целью оценить иммунный статус после COVID-19
1 090 Антитела качественные поствакцинальные (ЭпиВакКорона, Вектор) к SARS-CoV-2 (N-, S-белки), SARS-CoV-2-IgG-Вектор, (Post-vaccination (EpiVacCorona Vector) SARS-CoV-2 (N-, S-proteins) antibodies, IgG, qualitative)
2 290 Взятие крови из вены 390 Для проведения исследования в клиниках Москвы необходимо предъявить СНИЛС и документ удостоверяющий личность -
Аллергологические исследования
Наименование услуги Цена, ₽ Панель аллергенов Пищевые №22 (Горбуша, кита, лещ, лосось, речной окунь, сом, скумбрия, навага) 1 490 Панель аллергенов Пищевые №23 (Дорадо, икра красная, лангуст, осьминог, раки, речная форель, рыба сиг, устрицы) 1 490 Панель аллергенов Пищевые № 2 (Арахис, Фундук, Морковь, Треска, Картофель, Кунжут, Миндаль, Краб, Грецкий орех, Сельдерей
3 100 Панель аллергенов № 2 респираторная (RIDA-screen) , IgE (до 5р.д.) 5 490 Респираторная скрининговая панель из смесей аллергенов 7 650 Респираторная панель (Respiratory panel PROTIA Allerqy-Q). Мультиплексный диагностический набор для диагностики аллергии 8 740 Аллерген к эпителиям кошки, IgE (Cat Dander-Epithelium, E1, IgE)
760 Аллерген к перхоти кошки (e1), IgE, ImmunoCAP (Cat dander (e1), IgE) 890 Аллерген к эпителиям собаки (Е2), аллерген-специфические IgG
760 Аллерген к перхоти собаки (е5), IgE, ImmunoCAP (Dog dander (e5), IgE) 890 Аллерген домашняя пыль, Greer (h1), IgE, ImmunoCAP (House dust allergen, Greer (h1), IgE). Используют с целью скрининга на наличие сенсибилизации к распространенным аллергенам домашней пыли. 1 050 Аллерген домашняя пыль Hollister–Stier Lab. (h2), IgE, ImmunoCAP (House dust allergen Hollister –Stier Lab. (h2), IgE). Используют для выявления сенсибилизации к аллергенам домашней пыли.
1 050 Панель наиболее распространённых пищевых аллергенов для скринингового обследования с целью выявления значимых аллергенов при подозрении на пищевую аллергию. Результат выдаётся с указанием концентрации и класса IgE по каждому аллергену в отдельности. Взятие крови из вены 390 -
Аутоимунные заболевания (антитела)
Наименование услуги Цена ,₽ Антитела к кардиолипину (IgG, IgM, IgA) (сумм.) кол. 1 450 Антитела к тиреопероксидазе (АТ- ТПО) 610 Антитела к рецепторам (АТ- ТТГ) 1 790 Антитела к антигенам миокарда 2 790 Антинуклеарные антитела/ ANA-скрининг (антигены ds-DNA, гистоны, рибосомальный Р-протеин
nRNP/Sm, Sm, SS-A, SS-B, Scl-70, Jo-1, центромеры
1 110 Антитела к односпиральной (денатурированной) ДНК (a-ssDNA) 990 Антитела к двухспиральной (нативной) ДНК (a-dsDNA) 990 Антитела к циклическому цитруллиновому пептиду (ССР) 1 590 Антитела к В- 2 гликопротеину IgA/М/G (сумм.) кол. 1 100 Антитела к цитоплазме нейтрофилов, NSCA класса IgG 960 Антитела к цитоплазме нейтрофилов, NSCA класса IgА
1 050 ANCA- профиль (протеиназа 3, МПО, эластаза, катепсин G, BP, лактоферин) IgG полуколич. 2 790 Антитела к ХГЧ IgM 2 200 Антитела к ХГЧ IgG 2 200 Антитела к фосфатидилсерину IgG кол. 1 250 Антитела к фосфатидилсерину IgМ кол. 1 250 Антитела к фосфолипидам IgG кол. 1 250 Антитела к фосфолипидам IgМ кол. 1 250 Антиспермальные антитела 1 320 Антиовариальные антитела 1 290 Антитела IgA к тканевой трансглутаминазе 650 Антитела IgG к тканевой трансглутаминазе 650 Антитела IgA к глиадину 965 Антитела IgG к глиадину 965 Антитела к Saccharomyces cerevisiae (ASCA), IgA 1 630 -
Бактериальные инфекции (кровь)
Наименование услуги Цена, ₽ Урогенитальные инфекции
Хламидии трахоматис IgA 755 Хламидии трахоматис IgG 755 Хламидии трахоматис IgM 755 Микоплазма хоминис IgG 555 Микоплазма хоминис IgА 555 Микоплазма хоминис IgМ 960 Кандидоз IgG 910 Уреаплазма IgG 555 Уреаплазма IgА 555 Гарднереллез Трихомониаз Лактобациллы Другие бактериальные инфекции
Хеликобактер пилори IgG 910 Хеликобактер пилори IgA 910 Сальмонелла (РПГА с диагностикумом, anti-Salmonella A,B,C1,C2,D,E )
770 Антитела суммарные к туберкуллезу 960 -
Бактериологические исследования (посев)
Наименование услуги Цена, ₽ Посев отделяемого половых органов на микрофлору, определение чувствительности к антимикробным препаратам и бактериофагам
1 560 Посев на микрофлору из ЛОР органов с определением чувствительности к антибиотикам, бактериофагам и антимикотикам 1 490 Посев мокроты на микрофлору с определением чувствительности к антибиотикам 2 200 Посев мочи с определением чувствительности к антибиотику 1 380 Посев секрета простаты с определением чувствительности к антибиотику 1 380 Посев спермы с определением чувствительности к антибиотику 1 380 Посев на Mycoplasma hominis с чувствительностью к антибиотику 1 110 Посев на Ureaplasma urealyticum с чувствительностью к антибиотику 1 110 Посев на дифтерию 860 Посев на дрожжеподобные грибы (Candida) с определением чувствительности к антибиотику 850 Посев на листерии с определением чувствительности к антибиотикам 1 210 Посев на трихомонаду с чувствительностью к антибиотику 1 500 Посев на гонорею с чувствительностью к антибиотику 1 500 Взятие мазка/соскоба 390 -
Биохимические исследования крови
Наименование услуги Цена,₽ Аланиновая трансаминаза (АЛТ) 290 Аспарагиновая трансаминаза (АСТ) 290 Альфа амилаза 290 Амилаза панкреатическая 410 Альбумин 350 Аполипопротеин А1 630 Аполипопротеин В 630 Антистрептолизин –О (АСЛ-О) 550 Ангеотензинпревращающий фермент (АПФ) 2 590 Антитела к инсулину 975 Антитела к бета- клеткам поджелудочной железы 1 330 Антитела к глутаматдекарбоксилазе (АТ к GAD) 1 330 Гамма-ГТ (ГГТ) 290 Глюкозотолерантный тест 1 130 Билирубин общий 290 Билирубин прямой 290 Билирубин непрямой 410 Белковые фракции 690 Витамин В-12 925 Витамин В-12 активный (холотранскобаламин) 2 050 Глюкоза 290 Гликированный гемоглобин 750 Гомоцистеин 1 800 Д (ИФА) 1 590 Индекс атерогенности 350 Железо 300 КФК (креатинфосфокиназа) 410 Кислая фосфатаза 290 ЛДГ (лактатдегидрогеназа) 290 Латентная железосвязывающая способность сыворотки 330 Лактат 730 Липаза 455 Липопротеин (а) 970 ЛПВП 290 ЛПНП 290 ЛПОНП 330 Миоглобин 1 090 Креатинин 290 Креатининкиназа МВ (КФК- МВ) 520 Кальций общий 285 Кальций ионизированный 480 Калий/Натрий/Хлор 420 Калий 290 Магний 340 Мочевина 290 Мочевая кислота 290 Медь 410 Натрий 290 Общий белок 290 ОЖСС 300 Риск атеросклероза (скрининг)- триглицериды, холестирин общий, ЛПВП, ЛПНП, коэффициент атерогенности 880 Ревматоидный фактор 550 Уровень сахара в крови 280 Определение уровня сахара в крови (с нагрузкой) 1 130 Трансферрин 650 Тропонин I 1 190 Триглицериды 290 Ферритин 685 Фруктозамин 800 Фосфор 300 Фолиевая кислота 999 Хлор 290 Холестерин общий 290 Холинэстераза 350 Цинк 300 Церулоплазмин 640 Щелочная фосфатаза 290 С- реактивный белок 550 С- реактивный белок ультрачувствительный 610 Эозинофильный катионный белок (ЕСП) 910 Эритропоэтин 1 350 в- Cross laps 1235 -
Вирусные инфекции крови
Наименование услуги Цена, ₽ Краснуха IgG 930 Краснуха IgM 930 Авидность антител к вирусу краснухи 1 050 Корь IgG 865 Коклюш (IgM) 970 Коклюш (IgA) 970 Коклюш (Anti-B pertussis IgG) 970 Вирусный паротит 765 Аденовирус IgG 1050 Аденовирус IgA 1 050 Респираторно-синцитиальный вирус IgG 950 Паракоклюш 520 Токсокар IgG кач 560 Тканевая трансглутаминаза IgA 720 Тканевая трансглутаминаза IgG 720 -
Гемостазиология (кровь)
Наименование услуги Цена, ₽ АЧТВ (Активированное частичное тромбопластиновое время) 350 Антитромбин III 490 Анализ крови на свертываемость 430 Анализ крови на свертываемость+ длит.кровотечения 790 Волчаночный антикоагулянт 990 Инсулино- резистентность 1 020 Коагулограмма (гемостазиограмма) 1 350 Коагулограмма: ААЧТВ; Протромб. время + МНО; Тромб. время; Фибриноген; Антитромбин III; фибринолитическая активность (комплекс) 1 600 Протромбиновый индекс,протромбин по Квику + МНО 390 Протромбиновое время 390 Протеин S 1 560 Протеин C 1 560 Фибриноген 405 РКФМ 320 D- димер 1 390 -
Генетические исследования крови
Наименование услуги Стоимость, ₽ Генетический риск атеросклероза и ИБС, предрасположенность к дислипидемии 7 500 Развернутое генетическое обследование для женщин 12 900 Фармакогенетика Варфарин 3 200 Синдром Жильбера 3 300 Синдром Жильбера расширенный 3 700 Генетика метаболизма Лактозы 1 550 Prenetix- не инвазивная пренатальная диагностика 28 000 Риск развития сахарного диабета 1 типа 12 700 Риск развития сахарного диабета 2 типа (определение вариантов в генах TCF7L2,PPARG, ADIPOQ.) 7 900 Кардиогенетика Гипертония 4 850 Кардиогенетика Тромбофилия 3 630 Генетика метаболизма Фолатов 3 200 Мужское бесплодие: Определение генетических причин азооспермии 2 500 Женское бесплодие 20 700 Беременность(комплекс) — риск невынашивания 3 700 Преэклампсия. Оценка риска 5 800 HLA генотипирование 2 класса для пары ( цена за 1 человека) 4 700 Аналитическое заключение врача- генетика по одному профилю 2 500 Комплекс «Акне» 28 050 Кариотип (1 пациент) 5 000 Кариотипирование с выявлением аберраций 5 400 Кариотип супружеской пары 9 200 Кариотипирование с выявлением аберраций с фото хромосом 6 500 Кариотип с фото хромосом (1 пациент) 6 500 Кариотип супружеской пары с фото хромосом 9 000 Кариотип с выявлением аббераций хромосом (супружеской пары)- с фотографией 11 000 -
Гормональные исследования крови
Наименование услуги Цена, ₽ Фертильность и репродукция
Антитела к овариальным (текальным) антигенам 1 520 Антимюллеров гормон (АМГ) 1 580 17- ОН прогестерон 760 Бета — ХГЧ 890 Глобулин, связывающий половые гормоны ГСПГ 980 Дигидротестостерон 1 590 Ингибин- А 3 300 Ингибин- В 1 690 Лютеинизирующий гормон (ЛГ) 595 Макропролактин (при концентрации пролактина более 700 мЕд/л) 1 230 Прогестерон 595 Пролактин 595 Свободный тестостерон 1 290 Тестостерон 595 Фолликулостимулирующий гормон (ФСГ) 595 Экстрадиол 595 Экстрадиол свободный 980 Гормоны надпочечников
Анренокортикотропный гормон (АКТГ) 930 Альдостерон 1 050 Андростендион 1 420 ДГЭАС (Дегидроэпиандростерон сульфат) 1 420 Кортизол 595 Адреналин Норадреналин Гормоны щитовидной железы
Т4 общий 595 Т4 свободный 595 Т3 общий 595 Т3 свободный 595 Тиреотропный гормон (ТТГ) 595 ТГ (тиреоглобулин) 870 Тиреоглобулин (ТГ) 950 Другие гормоны
Циклический цитруллиновый пептид (АЦЦП, А-CCР) — ревматоидный артрит 1 430 Глюкозотолерантный тест. Инсулин (ГТТ) (диагностика сахарного диабета) 650 Лептин 1 150 Р1NP (маркер формирования костного матрикса) 1 380 Остеокальцин (неколлагеновый белок костного матрикса) 1 210 Ренин + ангиотензин I 1 090 Ренин (маркер гипокалиемии и гипертонии) 1 390 С- пептид (маркер углеводного обмена) 650 Соматотропный гормон (СТГ) 1 590 Соматомедин С 1 350 -
Забор материала
Наименование услуги Стоимость Забор биологического материала 390 ₽ Забор биологического материала: кровь из вены 390 ₽ Забор биологического материала: кровь из пальца 390 ₽ Забор биологического материала: мазок 390 ₽ Забор биологического материала: секрет простаты 390 ₽ -
Иммунные исследования
Наименование услуги Цена, ₽ Исследования основных параметров клеточного иммунитета: подсчет лейкоцитов, лимфоцитов, нетрофилов, CD3, CD4, CD8, CD16, CD20, CD56, CD4/CD8, CD19
3 800
Расширенное иммунологическое исследование клеточного иммунитета: подсчет лейкоцитов, лимфоцитов, нейрофилов, CD3, CD4, CD8, CD16, CD20, CD38, CD54, CD71, CD95, CD56, CD4/CD8, CD19, CD95
5 900
Иммуноглобулины A, M, G 850 Иммуноглобулины A (IgA) 380 Иммуноглобулины М (IgM) 380 Иммуноглобулины G (IgG) 380 Иммуноглобулины E (IgE) 780 С3 компонент комплемента 870 С4 компонент комплемента 870 Общие циркулирующие имунные комплексы (ЦИК) 1 010 НСТ- тест, латекс- тест (фагоцитоз) 610 -
Иммуногематология (групповая принадлежность крови)
Наименование услуги Цена, ₽ Группа крови, резус-фактор
850
Антитела к резус-фактору (титр)
1 280
Антигены системы Kell (определение группы крови по наличию белка К) 1 090 Фенотипирование эритроцитов по антигенам С, с, E, e, Cw , K, k
1 610 -
Интерфероновый статус
Наименование услуги Цена, ₽ Интерфероновый статус без определения чувствительности лейкоцитов к препаратам 3 400 Роферон 630 Амиксин 630 Неовир 630 Циклоферон 630 Галавит 630 Гепон 630 Иммуномакс 630 Ликопид 630 Полиоксидоний 630 Ридостин 630 Кагоцел 630 Имунофан 630 Арбидол 630 Глутоксим 630 Тактивин 630 Тимоген 630 Иммунал 630 Имунорикс 630 -
Исследование кала
Наименование услуги Стоимость, ₽ Анализ кала общий (копрограмма) 620 Анализ кала на определение панкреатической эластазы 2 350 Анализ кала биохимический на дисбактериоз 1 910 Исследования микробиома человека толстой кишки (просветная кишка) методом ГХ – МС (по Осипову) 4 700 Анализ кала на простейшие и яйца гельминтов 440 Анализ кала на простейшие и яйца гельминтов ПАРАСЕП 920 Кальпротектин в кале 2 900 Анализ на энтеробиоз 430 Анализ кала на скрытую кровь 440 Токсины А и В Clostridium difficile 1 100 Ar Helic.pylori в кале 850 Исследования микробиома человека толстой кишки (просветная микробиота) ГХ — МС (по Осипову ) 4 700 -
Исследования мочи
Наименование услуги Цена, ₽ Биохимия мочи
Амилаза (суточная моча) 310 Альбумин (микроальбуминурия) 450 Белок общий 320 Глюкоза (суточная моча) 330 Креатинин 270 Микроальбумин (разовая моча) 500 Микроальбумин 760 Мочевая кислота 330 Мочевина 330 Органические кислоты в моче 5 700 Гормоны в суточной моче
17-кетостероиды (17-КС) 1 800 Кортизол (суточная моча) 1 120 Свободный кортизол (моча) 1 990 Тест на беременность по моче 240 Катехоламины мочи
Адреналин 650 Метанефрины (суточная моча) 3 350 Норметанефрины (суточная моча) 1 700 Норадреналин 650 Катехоламины: адреналин, норадреналин, дофамин (суточная моча) 1 850 Метаболиты катехоламинов и серотонина (ГВК, ВМК, 5-ОИУК ) 1 800 Промежуточные метаболиты катехоламинов (метанефрин и норметанефрин ) 2 100 Нейромедиаторы в суточной моче
5-оксииндолуксусная кислота (моча) 1 200 Ванилилминдальная кислота (моча) 1 200 Гистамин (моча) 1 200 Дофамин (моча) 650 Серотонин (моча) 1 200 Клинические исследования мочи
Общий анализ мочи — срок изготовления 1 день 410 Общий анализ мочи — (срочно) в день обращения 490 2-х стаканная проба мочи 630 Анализ мочи по Нечипоренко — срок изготовления 1 день 450 Анализ мочи по Нечипоренко — (срочно) в день обращения 550 Патологические маркеры мочи
UBC (специфический антиген рака мочевого пузыря) (моча) 1 400 Альфа-амилаза панкреатическая (моча) 330 ДПИД (дезоксипиридинолин) (моча) 1 570 Тест на протеинурию (альбумин/креатинин) в разовой порции мочи 450 Микроэлементы в моче
13 микроэлементов в моче (Se; Zn; Co; Mn; Mg; Cu; Fe; Ca; Hg; As; Pb; Cd; Al) 4 500 6 микроэлементов в моче ( Hg; Cd; As; Li; Pb; Al) 2 500 Аминокислоты (32) в моче 6 590 Калий/Натрий/Хлор 350 Кальций 230 Магний 330 Фосфор 330 -
Клинические исследования крови
Наименование услуги Цена, ₽ Общий анализ крови без лейкоцитарной формулы (капилярная кровь) 400 Общий анализ крови буз лейкоцитарной формулы (венозная кровь) 400 Клинический анализ крови 3 (гемоглобин, лейкоциты, СОЭ) 730 Клинический анализ крови (развёрнутый) 730 Клинический анализ крови (развёрнутый+ тромбоциты) 730 -
Общеклиническое исследование отделяемого
Наименование услуги Цена, ₽ Посткоитальный тест 640 Мазок на флору 600 Мазок из носа на эозинофилы 400 Общеклиническое исследование назального секрета (риноцитограмма) 850 Соскоб шейки матки и/или цервикального канала по Лейшману-1препарат 670 Исследование пунктатов молочной железы и кожи 670 Исследование отделяемого молочной железы 670 Исследование пунктатов щитовидной железы 670 Анализ спермограммы с исследованием антиспермальных антител IgA\ IgG ( MAR — тест) 3 920 Жидкостная цитология 2 200 Определение онкомаркера в жидкостной цитологии 5 100 Биопсия исследование 1 фрагмента (гисталогия) 3 870 Соскоб с кожи на грибы 750 Соскоб с ногтевых пластинок на грибы 750 Соскоб на демодекс 750 Соскоб с кожи на чесоточного клеща 750 Соскоб на трепонему 750 Анализ спермограммы 1 990 Общеклиническое исследование сока предстательной железы 600 -
Онкомаркеры
Наименование услуги Цена, ₽ АФП (Альфа-фетопротеин). Оценка патологии плода при беременности, гепатоцеллюлярного рака печени, опухолей яичек или яичников 1 600 Антитела к митохондриям (Антимитохондриальные IgG, маркер первичного билиарного цирроза печени) 1 430 Гастрин-17 (диагностика атрофическиого гастрита, маркер рака и язвенной болезни желудка) 1 870 Индекс ROMA — оценка риска рака яичников у женщин (CA-125 и HE 4) 2 560 Исследование полеморфизов в гене ТР53 (рак молочной железы) 4 500 Инсулин (маркер гормоносекретирующей опухоли бета-клеток поджелудочной железы) 650 Проинсулин 1 280 Кальцитонин (диагностика остеопороза, маркер опухоли щитовидной железы)
990 ПСА (простатический специфический антиген) общий 690 ПСА общий/свободный (простатический специфический антиген общий, маркер рака предстательной железы) 1 390 Оценка здоровья простаты (включает три маркера: ПСА общего, ПСА свободного и про-ПСА) 3 600 РЭА (раковоэмбриональный антиген) 700 Рак молочной железы 4 300 Рак молочной железы и яичников (расширенный комплекс) 21 990 CA 153 (маркер рака молочной железы) 1 030 CA-125 (маркёр рака яичников) 1 010 CA 19-9 (маркёр рака кишечника, желудка, поджелудочной железы, желчного пузыря) 1 020 CA-242 (маркёр рака поджелудочной железы, толстого кишечника, прямой кишки, колоректального рака) 2 100 Cyfra-21-1 (маркер немелкоклеточного рака легких) 1 530 HE-4 (маркёр для комплексной диагностики эпителиального рака яичников) 1 480 SCC (Антиген плоскоклеточного рака) 1 400 Тиреоглобулин (маркер щитовидной железы) Паратиреоидный гормон (ПТГ) (маркер гиперпаратиреоза) 930 -
ПЦР диагностика. ПЦР NASBA (соскоб)
Наименование услуги Цена, ₽ ПЦР 10 2 950 ДНК Listeria monocytogenes (ПЦР) 850 ДНК Listeria monocytogenes (кровь) 450 Бакретиальный вагиноз колич. 650 Вирус простого герпеса 6 типа (HHV), количественно ДНК 400 ВРИ микоплазма / хламидии кач. 550 ВПЧ от 420 Вирус Варицелла-Зостер 420 Гонорея кач. 420 Гарднерелла кач. ДНК 420 Гарднерелла колич. ДНК 610 Герпес 1/2 (HSV)- кач. ДНК 420 Кандидоз кач. ДНК 420 Микоплазма genitalium- кол. ДНК 650 Микоплазма hominis – кол.ДНК 650 Микоплазма hominis- кач. ДНК 420 Микоплазма genitalium- кач. ДНК 420 Стрептококк группы В 1 280 Стрептококк группы А кач. 900 Соскоб с гортани на Mycoplasma / Chlamidia (pneumoniac) 610 Трихомонада 420 Уреаплазма кач. ДНК 420 Уреаплазма колич. 650 Хламидия кач. ДНК 420 Хламидия кол. 650 Флороценоз микоплазмы 740 Флороценоз 1 690 Флороценоз и Микроскопия 1 880 Флороценоз и NCMT 1 980 Флороценоз и NCMT и Микроскопия 2 610 Цитомегаловирус кач. 420 ЦМВ / ВЭБ /ВПГ 6 типа кач. 850 Цитомегаловирус, количественно, ДНК 300 Эпштейна-Барр, количественно, ДНК 350 ПЦР NASBA. Ранняя диагностика ЗППП (соскоб)
900 ANCA – цитоплазма IgG полуколичественный 1 760 NASBA chlamidia trachomatis 2 370 NASBA neisseria gonorrhoeae 2 370 NASBA trichomonas vaginalis 2 370 -
Ранняя диагностика заболеваний ЭЛИ-ТЕСТ
Наименование услуги Стоимость «ЭЛИ-Висцеро-Тест-24» (ранняя диагностика, полная панель) нервной системы, миокарда, печени, почек, надпочечников лёгких, стенок желудка, кишечника, щитовидной железы, поджелудочной железы, простаты, тромбоцитов, эндотелия сосудов, а также к антигенам, характеризующие состояние иммунной системы. 6 950 ₽ «ЭЛИ-В-Тест -6» (общее состояние иммунной системы при подготовке к вакцинации) 2 000 ₽ «ЭЛИ-Диа-Тест-8» (состояние поджелудочной железы, сахарный диабет; общая терапия и эндокринология; уточняющий диагноз и оценка эффективности лечения) 2 100 ₽ «ЭЛИ-ЖКТ- Тест -12» (состояние органов системы пищеварения; гастроэнтерология; общая терапия; гепатология; эндокринология; уточняющий диагноз и оценка эффективности лечения) 2 600 ₽ «ЭЛИ-П-Комплекс-12» (репродуктивное здоровье женщины) 2 840 ₽ «ЭЛИ- Тест-12» (мужское здоровье ) 2 640 ₽ «ЭЛИ-АФС-ХГЧ Тест» (антифосфолипидный синдром, анти-ХГЧ синдром, состояние иммунной системы; акушерство и общая терапия; уточняющий диагноз и оценка эффективности лечения) 1 850 ₽ Цитотест. Индивидуальный цитотоксический тест на переносимость 21 химического реагента (консерванты, красители, загустители, ароматизаторы) 5 000 ₽ «ЭЛИ-АНКОР-Тест -12» (состояние сердечнососудистой системы)- предназначен для клинического использования в общей терапии, кардиологии и флебологии для оценки выраженности патологических процессов,нарушающих нормальное функционирование сердечно-сосудистой системы. 2 600 ₽ «ЭЛИ-Н-Тест-12» (состояние нервной системы) 2 600 ₽ -
Серологическая диагностика (антитела)
Наименование услуги Цена, ₽ ВИЧ
Антитела к вирусу иммунодефицита человека 1 и 2 типов (ВИЧ) 600 ВИЧ –ДНК (ПЦР), качественное определение 3 630 ВИЧ –определение РНК вируса , кол. 12 150 Гепатит А (HAV):
anti- HAV IgG, ИФА, кач. 720 anti- HAV IgМ, ИФА, кач. 900 Гепатит B (HBV):
ДНК HBV, кровь, кач. ПЦР 360 HbsAg, ИФА, кач. 600 анти- HВsAg, кол. 1 300 anti- HBc ИФА cуммар., кач. 520 anti- HBc IgM, ИФА, кач. 850 HBeAg, ИФА, кач. 720 Гепатит C (HCV):
РНК HCV, кровь, генотипирование (1a, 1b, 2a, 2b, 3a) ПЦР 1 300 anti- HСV IgМ, ИФА, кач. 600 anti- HСV суммарные, ИФА, кач. 400 РНК HСV , кач. 755 РНК HСV , кол. 9 190 Гепатит D (HDV):
anti- HDV IgМ, ИФА, кач. 750 ₽ anti- HDV, ИФА, сумм., кач. 750 ₽ Антимитохондриальные антитела (АМА) 1 450 ₽ Антитела к микросомальной фракции печени и почек (LKM) 1 100 ₽ Гепатит Е
Антитела к вирусу гепатита Е (IgG) 845 Антитела к вирусу гепатита Е (Ig М) 845 Сифилис
RW РПГА 520 Антитела к Treponeme pallidum методом РИФ в сыворотке крови 2 910 Антитела к Treponeme pallidum РИБТ 3 960 Антитела IgG к Treponeme pallidum методом иммуноблокинга (WB) в сыворотке крови 4 100 Антитела IgM к Treponeme pallidum методом иммуноблокинга (WB) в сыворотке крови 4 100 Антитела к Treponeme pallidum в реакции миккропреципитации с кардиолипиновым антигеном (RPR/РМТ) в сыворотке крови 900 Антитела к Treponeme pallidum (IgM) 810 Антитела к Treponeme pallidum (IgG) 810 Герпесвирусы
Антитела IgM к цитомегаловирусу 840 Антитела IgG к цитомегаловирусу 840 Авидность антител IgG к цитомегаловирусу 1 155 Антитела IgG к раннему антигену вируса Эпштейна-Барр
755 ВЭБ IgG (к ядерному антигену) 1 050 ВЭБ количественный, определение ДНК 550 ВЭБ IgG (к капсидному белку) 840 ВЭБ IgМ (к капсидному белку) 840 ВЭБ IgG (к раннему белку) 970 Варицелла-Зостер (Anti- VZV IgG) 880 Варицелла-Зостер (Anti- VZV IgM) 765 Антитела к вирусу простого герпеса 1 и 2 типа (HSV) кач.определение ДНК 465 Антитела IgG к вируса простого герпеса 1 и 2 типа (кол.) 790 Антитела IgМ к вируса простого герпеса 1и 2 типа 790 Антитела IgМ к вируса простого герпеса 1 типа (кол.) 490 Авидность АТ IgG к герпесу 1, 2 типа 1 330 Антитела к вирусу герпеса 6 типа IgM 1 170 ВПГ 1 и 2 тип (кол) IgG 960 ВПГ 1 и 2 тип (кол) IgM 790 Моликуты
Микоплазма пневмонии IgG 600 Микоплазма пневмонии IgA 840 Микоплазма пневмонии IgM 600 Микоплазма хоминис IgA 840 Микоплазма хоминис IgM 840 Микоплазма хоминис IgG 840 Хламидии
Хламидии пневмонии IgA 760 Хламидии пневмонии IgM 760 Хламидии пневмонии IgG 760 Другие вирусные инфекции
Вирус Зика (ПЦР (эякулят) 1 500 Вирус Зика (ПЦР (ЭДТА+ слюна+ моча) 4 200 Антитела к бета- клеткам поджелудочной железы 1 330 Антитела к глутаматдекарбоксилазе (АТ к GAD) 1 450

Индивидуальный подход к лечению каждого пациента
Использование инновационного оборудования и аппаратуры
Лечение эректильной дисфункции (импотенции) ударно-волновым методом
Полный спектр лабораторной и функциональной диагностики
О клинике «евромедпрестиж»
Специально для сохранения и восстановления здоровья людей в 2000 году была основана
многопрофильная клиника «ЕВРОМЕДПРЕСТИЖ», в которой работают лучшие специалисты из 25 областей
медицины. Наши врачи, в совершенстве владеющие своим ремеслом, готовы бороться с любым Вашим недугом!


Мы заботимся о вашем здоровье с вниманием и любовью и поэтому нас рекомендуют друзьям
Васько Наталья Валерьевна, Управляющий партнер клиники «Евромедпрестиж»
Благодарим Вас
за доверие!

- Лабораторные методы обнаружения инфекций
- Этапы диагностики методом ПЦР
- Что может ПЦР
- Чего не может ПЦР
- Выводы
Полимеразная цепная реакция (ПЦР, PCR), открытая американцем Кэрри Муллисом в 1983 году, и метод детекции ДНК, разработанный на ее основе, принесли ученому Нобелевскую премию по химии 1993 года. Сегодня это один из самых точных методов в лабораторной диагностике инфекционных заболеваний. Он позволяет обнаружить то, что до появления ПЦР оставалось скрытым.
Почему же такой замечательный метод не вытеснил другие виды лабораторной диагностики, а применяется наравне с ними, и в чем-то даже проигрывает им?
Лабораторные методы обнаружения инфекций
Существуют разные методы обнаружения инфекций в биологических жидкостях пациентов.
- Микроскопические методы.
Лаборант при помощи микроскопа выискивает патогенные микроорганизмы в специально окрашенном мазке — пробе выделений из мочеиспускательного канала или со стенки слизистой. Дешево, просто, но малоинформативно. Таким образом, удается разглядеть трихомонад, гонококков, хламидий, уреаплазму и гарднерелл. И все.
- Культуральные методы (посевы).
Такой же точно мазок наносят на питательную среду в чашке Петри и смотрят, что вырастет. Все микроорганизмы образуют разные колонии — по цвету, форме, размеру и консистенции. Вот по этим колониям и определяется: кто был в мазке. Тоже, в общем, недорого, но долго, выращивание микроорганизмов может длиться от 3 до 8 недель – за это время состояние пациента может значительно ухудшиться. И еще есть один нюанс: вырастет только то, что было в мазке и в определенном количестве. Если патогенных бактерий было слишком мало, то выявить их не удастся.
- Анализы крови.
Любые возбудители оставляют после контакта с организмом человека свои иммунные следы в его крови: антигены или антитела. Метод не самый дешевый, зато быстрый. Но и тут следует учитывать, что до определенного момента инфекция уже может быть в организме, а антитела и антигены пока еще не выявляются: слишком мало времени прошло или слишком низкая концентрация патогенных микроорганизмов. Кроме того, данный метод не позволяет различать виды отдельных микроорганизмов, которые далеко не всегда опасны для человека.
Итак, у всех методов есть свои недостатки. Среди ключевых можно выделить следующие:
- Низкая чувствительность, то есть необходимо определенное минимальное количество микроорганизмов в пробе, чтобы их можно было обнаружить.
- Низкая специфичность, то есть, если у двух разных видов бактерий (один опасный, другой нет) на поверхности клетки есть одинаковые белки, то не все анализы позволяют узнать, какой именно из этих видов имеется в организме.
Обе этих проблемы позволяет решить метод ПЦР.
Этапы диагностики методом ПЦР
В основе метода лежит факт, что каждый живой организм (микро- или макро-) имеет уникальную ДНК (или РНК – если речь идет о некоторых вирусах). Это лучший маркер присутствия чужеродного микроорганизма в теле человека, какой только можно себе представить. Даже если в пробе присутствуют следовые количества ДНК, значит организм тем или иным способом уже сталкивался с данной инфекцией. А как эти следовые количества «увидеть»? Их нужно для начала «приумножить».
Метод ПЦР состоит из следующих этапов.
- 1 этап. Подготовка пробы, то есть выделение ДНК.
Предположим, что мы ищем в пробе определенную бактерию, например, хламидию (Chlamydia trachomatis – возбудитель хламидиоза). На этом этапе мы не знаем, есть ли в пробе ее ДНК. Проба специальным образом обрабатывается, чтобы сконцентрировать ДНК, если она там есть, в минимальном объёме жидкости для ПЦР.
- 2 этап. Амплификация (умножение) ДНК с помощью ПЦР.
Сначала двухцепочечную ДНК «расплетают» путем повышения температуры и получают одноцепочечные нити. После этого в раствор добавляют специальные короткие фрагменты нуклеиновой кислоты — праймеры. Они будут затравкой для синтеза второй цепочки ДНК на одноцепочечной «базе». Итак, база есть, затравка есть, осталось добавить нуклеотиды, из которых будет достраиваться вторая цепочка, и устройство, которое будет заниматься этим строительством. В роли такого устройства выступает фермент ДНК-полимераза, а процесс достраивания одноцепочечной ДНК до двухцепочечной и является полимеразной цепной реакцией.
В начале цикла у нас было две одноцепочечных ДНК, в конце мы получим две двухцепочечных ДНК. И такой цикл повторяется многократно, пока количество ДНК не окажется достаточным для лабораторного анализа. Для умножения ДНК используют специальные аппараты — амплификаторы. На этом этапе исследователи тоже все еще не знают, что за ДНК они амплифицировали и есть ли в пробе ДНК хламидии.
Следует также добавить, что существует множество разновидностей метода ПЦР, которые применяются в зависимости от поставленной перед исследователем задачи.
- 3 этап. Детекция (определение) ДНК.
На данном этапе как раз и происходит выяснение, есть ли ДНК искомой бактерии в пробе. Раньше для этого использовался метод электрофореза, а позднее ученые стали использовать ДНК-зонды – специальные меченые фрагменты ДНК, которые взаимодействуют только со специфическим участком анализируемой ДНК и позволяют таким образом определять конкретные последовательности нуклеотидов. Наконец, для экспресс-диагностики сейчас используют флуоресцентные маркеры, которые позволяют определять результат ПЦР прямо в реакционной пробирке. Если ДНК хламидии в пробе была – лаборант об этом узнает.
А что делать, если геном вируса представляет собой не ДНК, а РНК? Пример: пандемический коронавирус SARS-CoV-2. В этом случае добавляется еще один этап — обратная транскрипция. Из образца слизи, полученного из носоглотки, выделяют РНК, проводят обратную транскрипцию и получают аналог в виде ДНК. И уже эту ДНК амплифицируют и детектируют. Поэтому говорят, что для определения коронавируса используют полимеразную цепную реакцию с обратной транскрипцией в реальном времени (ОТ-ПЦР в реальном времени).
Что может ПЦР
Метод ПЦР позволяет выявлять патогенные микроорганизмы, а также проводить анализ на предмет их резистентности (устойчивости) к лекарствам. В этом отношении, по сравнению с культуральными и другими методами, ПЦР намного быстрее и точнее. Методы ПЦР находят все более широкое применение в медицинской практике. Например, сейчас с его помощью в некоторых случаях можно определить наличие (или отсутствие) генетических маркеров резистентности.
Преимущества ПЦР:
- Чувствительность.
Для обнаружения присутствия патогенного микроорганизма в теле пациента достаточно даже одной копии его ДНК. 1 микроорганизм на пробу – для ПЦР этого достаточно, подобный подход невозможен для других методов диагностики.
- Специфичность.
Как было сказано ранее, уникальность ДНК каждого вида микроорганизмов позволяет обнаружить их даже при наличии больших объёмов чужой, лишней, мешающей проведению анализа, «балластной» ДНК.
- Скорость проведения анализа.
Весь процесс диагностики методом ПЦР занимает не больше 1 рабочего дня.
- Производительность.
ПЦР-диагностика, на сегодняшний день, полностью автоматизированный процесс.
Чего не может ПЦР
Метод ПЦР — это действительно гениальное изобретение молекулярной биологии XX века. Но иногда он настолько хорош, что непригоден для диагностики.
Недостатки ПЦР:
- Специфичность.
Она потрясающе высокая, но слишком узкая. При посеве в чашке Петри вырастет все, что было в пробе. А при проведении ПЦР можно обнаружить только то, что искали, то, для чего использовали ДНК-зонды. Нельзя проводить ПЦР-анализ на хламидии и случайно обнаружить гепатит.
- Чувствительность.
Существует множество микроорганизмов, которых врачи относят к условно-патогенным. Они являются частью нормальной микрофлоры человека, пока их концентрация не превышает определенных пределов. ПЦР конечно покажет их наличие, но это вовсе не значит, что человек болен. К таким микроорганизмам относятся микоплазма, уреаплазма, гарднерелла и др.
- Проблема контаминации.
Контаминация – это загрязнение пробы образцами ДНК извне. Диагностика методом ПЦР должна проводиться в специально подготовленных лабораториях и в стерильных условиях. Даже одна копия «внешней» ДНК из другой пробы, из воздуха лаборатории или с перчаток лаборанта может привести к ложноположительным результатам – при наличии соответствующих праймеров.
- Влияние на ПЦР других компонентов пробы.
Чувствительность ПЦР может значительно снижаться под воздействием других веществ. Например, некоторые препараты (антикоагулянты) подавляют реакцию амплификации. Для выявления таких ситуаций существуют специальные методы контроля. Но риск получения ложноотрицательных результатов все равно остается.
- Стоимость.
Это дорогостоящий метод. Само оборудование и реактивы для него, а также подготовка лаборантов, умеющих с ними обращаться, обходятся клиникам и лабораториям очень дорого. В России подобное оборудование не производится, а применение отечественных реактивов ухудшает качество анализа.
Выводы
- ПЦР – отличный современный и недешевый метод диагностики возбудителей различных инфекционных заболеваний.
- Не всегда для диагностики требуется метод ПЦР. Если врач не считает нужным направлять вас на анализ – доверьтесь его мнению. При самолечении и самостоятельной сдаче анализов для исследования методом ПЦР в сетевой лаборатории высок риск того, что вы будете годами лечиться от несуществующей болезни.
- Если лаборатория выдала вам результат, в котором вы сомневаетесь, пересдайте анализ в другой лаборатории. Риски ложноположительных и ложноотрицательных результатов никто не отменял – несмотря на всю современность и технологичность метода.
Клиническая лабораторная диагностика: национальное руководство / Под ред. В. В. Долгова, В. В. Меньшикова. – 2012
ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ВЛАГАЛИЩА И СОВРЕМЕННЫЕ ПОДХОДЫ К ИХ ДИАГНОСТИКЕ И ЛЕЧЕНИЮ / Савичева А.М., Шипицына Е.В., Воробьева Н.Е. // Акушерство и гинекология – 2016 – 2
Государственное
образовательное учреждение высшего
профессионального образования «ПЕРМСКАЯ
ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
имени академика Е.А. Вагнера федерального
агентства по здравоохранению
и
социальному развитию»
С.В. Поспелова, м.В. Кузнецова Полимеразная цепная реакция Методические рекомендации
Пермь
2007
УДК 616-078.33
ББК 53.4
Авторы:
С.В.
Поспелова
– канд. мед. наук, доцент кафедры
микробиологии, вирусологии и иммунологии,
М.В.
Кузнецова
– канд. биол. наук, сотрудник ИЭГМ УрО
РАН
Поспелова,
С.В.
Полимеразная
цепная реакция: метод. рекомендации /
С.В. Поспелова,
М.В. Кузнецова; ГОУ
ВПО ПГМА
им. ак. Е.А. Вагнера Росздрава.
– Пермь, 2007. – 35 с.
Предназначены
для самостоятельной работы студентов
всех факультетов: лечебного, педиатрического,
медико-профилактического, стоматологического
и факультета высшего сестринского
образования (ФВСО) медицинской академии.
Рецензент:
зав.
кафедрой биологии, экологии и медицинской
генетики ПГМА, профессор А.Б.
Виноградов
Печатается
по решению центрального координационного
методического совета ГОУ ВПО ПГМА
им. ак. Е.А. Вагнера Росздрава
УДК 616-078.33
ББК 53.4
© Поспелова С.В.,
Кузнецова М.В., 2007
© ГОУ ВПО ПГМА им.
ак. Е.А. Вагнера Росздрава, 2007
Полимеразная цепная реакция в клинической микробиологической диагностике
Современная
медицина успешно использует достижения
естественных наук, интенсивно применяет
новые
технологии для диагностики и лечения
заболеваний. В последнее время к
традиционным микробиологическим и
иммунологическим методам лабораторной
диагностики инфекционных заболеваний
добавились новые, основанные на
использовании молекулярно-генетических
технологий.
Применение этих методов не только в
научных целях, но и в практической
лабораторной
диагностике стало возможным в немалой
степени благодаря созданию в середине
80-х
годов процесса искусственного
многократного копирования ДНК и
дальнейшему стремительному
развитию этой технологии, в настоящее
время известной как полимеразная
цепная реакция
(ПЦР).
Менее чем за 15 лет своего существования
ПЦР сделала рутинным анализ специфических
ДНК-последовательностей многих
патогенных микроорганизмов.
Универсальность,
высокая чувствительность и относительная
простота исполнения сделали метод ПЦР
незаменимым для решения различных задач
клинической диагностики, таких как
прямое обнаружение
и идентификация возбудителей заболеваний,
молекулярное типирование и исследование
свойств патогенных микроорганизмов,
анализ мутаций, связанных с генетическими
заболеваниями
у человека, идентификация личности
человека.
Что такое пцр?
Полимеразная
цепная реакция (ПЦР)
— искусственный процесс многократного
копирования (амплификации)
специфической
последовательности ДНК, осуществляемый
in
vitro
(рис. 1).
Копирование
ДНК при ПЦР осуществляется специальным
ферментом — ДНК-полимеразой,
как
и в клетках
живых организмов. ДНК-полимераза,
двигаясь по одиночной цепи ДНК (матрице),
синтезирует
комплементарную ей последовательность
ДНК. Важно, что ДНК-полимераза не может
начать
синтез цепи ДНК «с нуля», ей необходима
короткая «затравочная» цепь РНК или
ДНК, к которой
она может начать присоединять нуклеотиды.
Основной принцип ПЦР состоит в том, что
реакция
полимеризации (синтеза полимерной цепи
ДНК из мономерных нуклеотидных звеньев)
инициируется
специфическими праймерами
(короткими
фрагментами «затравочной» ДНК) в каждом
из множества повторяющихся циклов.
Специфичность ПЦР определяется
способностью праймеров «узнавать»
строго определенный участок ДНК и
связываться с ним согласно принципу
молекулярной
комплементарности.
В
обычной реакции ПЦР используется пара
праймеров, которые «ограничивают»
амплифицируемый участок
с двух сторон, связываясь с противоположными
цепями ДНК-матрицы. Для многократного
увеличения
количества копий исходной ДНК нужна
цикличность реакции. Как правило, каждый
из последовательно
повторяющихся циклов ПЦР состоит из
трех этапов:
1)
денатурации, или
«плавления» двуцепочечной ДНК: перед
началом реакции ДНК-мишень является
двуцепочечной, при температуре 94-950
С комплиментарные цепи ДНК расходятся
— переходят
в одноцепочечное состояние;
2)
связывания (отжига)
праймеров:
при температуре, оптимальной для
выбранных праймеров, происходит их
связывание с комплиментарным участком
матричной ДНК;
3)
элонгации, или
удлинения цепи: ДНК-полимераза присоединяет
нуклеотиды к праймерам, синтезируя
новые цепи ДНК, которые становятся
мишенью для праймеров в последующих
циклах ПЦР.
Смена
этапов каждого цикла осуществляется
путем изменения температуры реакционной
смеси (см.
рис. 1).
Рис.
1. Основные этапы цикла ПЦР
Сначала
праймеры могут связаться только с
определенной последовательностью
исходной ДНК, но в последующих циклах
они связываются с копиями этой
последовательности, синтезированными
в предыдущих циклах. При этом количество
основного продукта ПЦР (копии
последовательности ДНК, ограниченной
праймерами) теоретически удваивается
в каждом цикле. Если на начальном цикле
в исследуемом материале была только
одна ДНК-мишень, после первого цикла
будет уже две копии, после двух циклов
– 4 копии, результатом третьего цикла
будет 8 копий, а тридцать пятого – уже
68 биллионов копий (рис. 2).
Рис.
2. Процесс многократного копирования
ДНК-мишени в ходе последовательно
сменяющихся циклов
Основным
методом анализа продуктов реакции,
который традиционно применяется во
многих лабораториях для обнаружения
амплифицированной ДНК и определения
ее размера, является метод гель-электрофореза
с
последующим окрашиванием красителем,
специфичным к ДНК, например бромистым
этидием (рис. 3).
Контроль
– различные фрагменты ДНК с известным
количеством составляющих их нуклеотидов.
Известно, что дистанция между различными
фрагментами имеет логарифмическую
зависимость от их размера, массы. Линия
1 – обнаружены ПЦР-фрагменты длиной
приблизительно 1850 оснований. Линия 2 и
4 – фрагменты длиной около 800 оснований.
Рис.
3. Анализ продуктов реакции методом
гель-электрофореза
Линия
3 – не выявлены искомые фрагменты,
отрицательный результат реакции. Линия
5 – множественные линии сформировались
потому, что праймеры оказались
комплиментарны к нескольким фрагментам
ДНК различной длины: около 550, 800 и 1500
оснований.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #