Описание
- Dietary Supplement
Butyric Acid is a scientifically-designed dietary supplement containing nutritionally significant amounts of the 4-carbon fatty acid, butyric acid. Manufacturing methods ensure a steady-release delivery system in the gastro-intestinal tract.
Рекомендация по применению
Take one capsule after meals, or as directed by a physician.
Ингредиенты
Gelatin, hydroxypropyl methycellulose, magnesium stearate, silicon dioxide.
Gluten free, casein free.
Пищевая ценность
| Информация о добавках | ||
| Serving Size: 1 Capsule | ||
| Serving Per Container: 90 | ||
| Amount Per Serving | %Daily Value* | |
| Calcium (from calcium-magnesium butyrate, carbonate) | 42 mg | 3% |
| Magnesium (from calcium-magnesium butyrate) | 21 mg | 5% |
| Butyric Acid | 250 mg | ** |
| *Percent Daily Values are Based on a 2,000 Calorie Diet. **Daily Value Not Established. |
Бутират, 11C (Butirat, 11C) инструкция по применению
📜 Инструкция по применению Бутират, 11C
💊 Состав препарата Бутират, 11C
✅ Применение препарата Бутират, 11C
📅 Условия хранения Бутират, 11C
⏳ Срок годности Бутират, 11C
Описание лекарственного препарата
Бутират, 11C
(Butirat, 11C)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2014 года, дата обновления: 2021.10.01
Владелец регистрационного удостоверения:
Код ATX:
V09
(Диагностические радиофармацевтические средства)
Лекарственная форма
| Бутират, 11C |
Р-р д/в/в введения 300-1600 МБк/мл: 750-4000 МБк фл. рег. №: Р N001367/01 |
Раствор для в/в введения прозрачный, бесцветный.
Вспомогательные вещества: натрия гидрокарбонат — 13 мг, вода д/и до 1 мл.
750 — 4000 МБк — флаконы (1) — контейнеры транспортные для радиоактивных веществ.
Фармакологическое действие
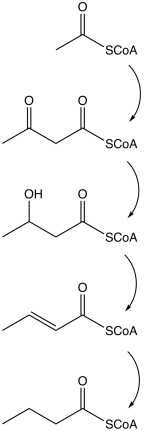
При внутривенном введении препарат Бутират,11С быстро выводится из крови. Максимальный уровень захвата препарата в органах наблюдается на второй минуте и сохраняется еще не менее 20 мни, что достаточно для проведения позитронной эмиссионной томографии. Препарат поступает и распределяется в органах пропорционально уровню перфузии и метаболической активности белков-транспортеров. В клеточных митохондриях происходит β-окисление жирной кислоты с образованием 11C-Ацетил-КоА. В условиях достаточной оксигенации 11C-Ацетил-КоА метаболизируется в цикле Кребса в диоксид углерода, углерод-11 и воду. В условиях гипоксии образуются преимущественно меченые фосфолипиды и триглицериды. Фосфолипиды и триглицериды задерживаются в клетке, причем в условиях гипоксии доля образования фосфолипидов и триглицеридов, по сравнению с диоксидом углерода, возрастает.
С момента введения РФП Бутират,11С наблюдается постепенное выведение ра дионуклидной метки через легкие в виде диоксида углерода, углерод-11. Почками радионуклидная метка не выводится.
Бутират,11С является неспецифическим туморотропным радиофармпрепаратом (РФП). По своим диагностическим свойствам РФП пригоден для проведения позитронной эмиссионной томографии с целью диагностики опухолей.
Наиболее информативно исследование злокачественных и гиперваскулярных доброкачественных опухолей головного мозга, так как в коре головного мозга препарат не накапливается, что не препятствует визуализации новообразований. Следует также отметить возможность визуализации рака предстательной железы, так при внутривенном введении данного препарата радионуклидная метка в мочевой пузырь не поступает.
РФП Бутират,11С является также кардиотропным средством и пригоден для исследования метаболизма жирных кислот в миокарде. В норме при внутривенном введении Бутират,11С равномерно распределяется во всех отделах левого желудочка миокарда пропорционально миокардиальной перфузии. В последующие 30 минут происходит постепенное равномерное выведение радионуклидной метки из миокарда по мере метаболизации препарата, при этом наблюдается повышенное накопление углерода-11 в легких и выдыхаемом воздухе. При значимом снижении миокардиального кровотока, приводящем к гипоксии, уровень захвата и β-оксидация жирных кислот уменьшаются, в результате чего радионуклидная метка задерживается в миоцитах в виде меченых фосфолипидов и триглицеридов. В участках постинфарктного кардиосклероза наблюдается стойкая гипофиксация РФП, что свидетельствует о гипоперфузии и отсутствии метаболизма.
Фармакокинетика
После внутривенного введения РФП Бутират,11С быстро покидает кровяное руста и уже через 1 мин содержание его в крови не превышает 4-5 % от введенного. Током крови препарат доставляется в ткани, где включается в обменные процессы соответственно уровню их перфузии. Максимальный уровень захвата в органах и тканях наблюдается на 1 минуте. РФП накапливается в повышенных количествах в почках (0,12 г%), печени (0,1 г%), селезенке (0,06 г%), миокарде (0,03 г%), поджелудочной железе (0,03 г%). В остальных органах, включая головной мозг, легкие, мышцы, скелет к кожу накопление препарата фоновое. В печени, селезенке и железах метаболизация препарата замедлена. В тоже время из миокарда и почек в норме наблюдается быстрое выведение радионуклидной метки. С момента внутривенного введения РФП отмечается постепенное выведение радионуклидной метки через легкие в виде диоксида углерода, углерод-11.
Площадь под кривой «концентрация/время» (AUC) накопления и выведения РФП Бутират,11С для сердечной мышцы биэкспоненциальная и характеризуется фазой быстрого накопления РФП в миокарде, за которой следует фаза быстрой элиминации радионуклидной метки (отражает процесс β-окисления жирной кислоты), и фаза медленной элиминации радионуклидной метки (отражает процесс образования меченых фосфолипидов и триглицеридов). Время достижения максимальной концентрации (ТCmax) препарата в здоровом миокарде — 1-2 минуты, период полувыведения (T1/2) — 20-22 мин. В норме через 30 минут после введения РФП 60-80 % радионуклидной метки выводится из миокарда в легкие в виде диоксида углерода-11. В условиях гипоксии сердечной мышцы наблюдается замедление скорости накопления и выведения радионуклидной метки из миокарда.
ТCmax) для Бутирата,11С в опухолевых клетках — 2-6 мин. Отношение опухоль/нормальная ткань, достаточное для визуализации злокачественных и гиперваскулярных доброкачественных опухолей, сохраняется еще в течение 20 минут.
Показания препарата
Бутират, 11C
В качестве диагностического средства для позитронной эмиссионной томографии (ПЭТ). Основными показаниями для проведения исследования являются:
в онкологии:
- диагностика и дифференциальная диагностика злокачественных и доброкачественных новообразований;
- контроль эффективности лечения злокачественных новообразований, в том числе при выявлении продолженного роста злокачественных опухолей в послеоперационной зоне.
в кардиологии:
- оценка жизнеспособности дисфункционирующего миокарда, в том числе у больных с полной блокадой левой ножки пучка Гиса;
- диагностика ишемической болезни сердца (ИБС), в частности определение степени гипоксии сердечной мышцы;
- оценка эффективности проводимого лечения ИБС.
Режим дозирования
Препарат в виде стерильного раствора вводится больным внутривенно струйно. Перед использованием во флакон с РФП Бутират,11С добавляют 10% раствор плацентарного альбумина в соотношении 1:1 к объему РФП. Смесь фильтруют через стерилизующий фильтр с величиной пор 0, 22 мкм. Готовый стерильный раствор должен быть прозрачным. В случае наличия у больного в анамнезе аллергической реакции на белок РФП Бутират,11С может вводиться без альбумина.
Динамические ПЭТ-исследования больных оптимально начинать сразу после инъекции РФП Бутират,11С и проводить в динамическом режиме в течение 30 минут. Специальной подготовки онкологических пациентов не требуется. Исследование кардиологических больных проводят натощак (последний прием пищи — вечерний).
Диагностическая доза препарата для проведения исследования в динамическом режиме составляет 200 МБк на 1 м2 поверхности тела пациента. Площадь поверхности тела определяется по номограмме на основании роста и массы тела пациента. Как правило, используют от 250 до 400 МБк препарата на одно обследование, который вводят внутривенно струйно в объеме от 0,5 до 2,5 мл.
Эффективная доза
Дозовые коэффициенты для расчета эффективных доз облучения пациентов при использовании препарата РФП Бутират,11С
Дозовый коэффициент при внутривенном введении Бутирата,11С у взрослых составляет 3.5×10-3 мЗв/МПк. При введении диагностической дозы препарата (от 250 до 400МБк) эффективная доза составляет от 0.87 до 1.4 мЗв.
Побочное действие
При использовании препарата в соответствии с инструкцией и в рекомендованных дозах побочных действий не отмечалось.
Противопоказания к применению
- при беременности;
- в период лактации;
- для исследования у детей, так как клинические испытания проводились только у взрослых.
Возможны реакции гиперчувствительности.
Применение при беременности и кормлении грудью
Противопоказан при беременности и в период лактации
Применение у детей
Противопоказан для исследования у детей, так как клинические испытания проводились только у взрослых.
Особые указания
Работа с препаратом проводится в соответствии с «Основными санитарными правилами обеспечения радиационной безопасности» (ОСПОРБ-99) и Методическими указаниями «Гигиенические требования по обеспечению радиационной безопасности при проведении радионуклидной диагностики с помощью радиофармпрепаратов». (МУ-2.6.1.1892-04).
Передозировка
Передозировка препарата маловероятна в связи с тщательным контролем вводимой радиоактивности в условиях специализированного стационара.
Лекарственное взаимодействие
Данные по лекарственному взаимодействию отсутствуют.
Условия хранения препарата Бутират, 11C
Препарат хранят в соответствии с требованиями «Основных санитарных правил обеспечения радиационной безопасности (ОСПОРБ-99).
Срок годности препарата Бутират, 11C
Срок годности — 40 мин с даты и времени изготовления. Не использовать по истечении срока годности.
Условия реализации
Препарат реализации через аптечную сеть не подлежит.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Среди функциональных заболеваний желудочно-кишечного тракта в последние годы наибольший интерес исследователей вызывает синдром раздраженного кишечника (СРК). Распространенность СРК в различных географических регионах значительно варьирует от 10% до 25%, составляя в среднем около 11% [1].
Пациенты с СРК составляют значимую долю на приеме у врача общей практики и гастроэнтеролога (от 30% до 50%) [1]. В основном обращаются к врачам тяжелые и средней степени тяжести пациенты с СРК, которые проходят многочисленные обследования для исключения органической патологии, характеризуются отчетливым снижением качества жизни и психоэмоциональными расстройствами.
Согласно критериям Римского консенсуса ΙΙΙ пересмотра (2006 г.) синдром раздраженного кишечника определялся как функциональное кишечное расстройство, при котором дискомфорт или боль в животе уменьшаются после дефекации, связаны с изменением частоты и консистенции стула, возникают не менее 3 дней в месяц на протяжении 3 месяцев при общей продолжительности жалоб не менее 6 месяцев [2].
На Американской гастроэнтерологической неделе, проходившей в Сан-Диего с 22 по 24 мая 2016 г., были озвучены новые критерии функциональных нарушений (Римские критерии ІV) [3, 4]. Из диагностических критериев СРК удалено такое понятие, как «дискомфорт». В новых критериях фраза «улучшение после дефекации» изменена на «абдоминальная боль, связанная с дефекацией». Кроме того, в определении СРК изменена частота абдоминальной боли — для постановки диагноза СРК пациент должен испытывать абдоминальную боль по меньшей мере 1 день в неделю в течение 3 последних месяцев [3, 4].
Истинная природа СРК остается до конца неясной. Целый ряд факторов самостоятельно или в сочетании друг с другом приводят к развитию СРК. Наибольшее число исследователей сходятся во мнении о важной роли психоэмоционального стресса в развитии СРК. В Римских критериях ІV предложен новый термин «нарушения цереброинтестинального взаимодействия» [3, 4].
В патогенезе СРК одним из ключевых звеньев является формирование висцеральной гиперчувствительности (ВГЧ). В развитии ВГЧ и восприятии боли участвуют многочисленные молекулярные медиаторы и рецепторы [5]. Недавно были описаны новые рецепторы, участвующие в формировании реакций ВГЧ — N-метил-D-аспартат-рецепторы (NMDA) в головном мозге, спинном мозге и энтеральной нервной системе. Показано значительное усиление активности NMDA слизистых оболочек кишечника у пациентов с СРК по сравнению с контролем, а также статистически значимая корреляция с выраженностью абдоминальной боли [6].
Результаты последних экспериментальных и клинических исследований свидетельствуют о роли слабовыраженного воспаления в патогенезе СРК.
Показано снижение плотности и активности энтероэндокринных клеток, выделяющих различные сигнальные вещества, такие как серотонин, мелатонин, а также цитокины, что может приводить к нарушению моторики кишечника и формированию повышенной висцеральной чувствительности [7].
Кроме того, у пациентов с СРК отмечается сдвиг в сторону повышения продукции провоспалительных цитокинов: фактора некроза опухоли-альфа (ФНО-α), интерлейкинов — ИЛ-6, ИЛ-8, ИЛ-1β и снижение уровня противовоспалительного цитокина — ИЛ-10 в системном кровотоке [8].
В последнее время авторы придают значение окислительному стрессу в развитии СРК. При СРК показано снижение концентрации ферментов-антиоксидантов, в том числе ферментов системы глутатиона, и, напротив, повышение показателей перекисного окисления липидов [9].
Микробиоценоз кишечника играет важную роль в развитии СРК. Показана взаимосвязь микрофлоры, иммунной системы и ноцицептивной системы кишечника [10]. В связи с нарушением процессов кишечной ферментации дисбиоз кишечника рассматривается как потенциальный этиологический механизм при СРК [11].
Медикаментозная терапия СРК складывается из назначения препаратов, применяемых для купирования: болевого абдоминального синдрома, метеоризма, cиндрома диареи и запора, и назначается с учетом преобладания тех или иных синдромов. Патогенетически оправданным, необходимым условием купирования боли является назначение спазмолитических лекарственных средств [12]. В то же время удовлетворенность пациентов с СРК лечением недостаточна.
В последние годы появились принципиально новые группы лекарственных средств, активно воздействующие на ключевые звенья патогенеза СРК. В частности, экспериментально и клинически был показан эффект масляной кислоты.
В настоящее время применение масляной кислоты в качестве лекарственного средства для снижения висцеральной чувствительности запатентовано в Евросоюзе. В России зарегистрирован препарат Закофальк, содержащий 250 мг бутирата с таргетной доставкой в толстую кишку путем использования специальной технологии замедленного высвобождения (мультиматриксная основа), а также 250 мг инулина — водорастворимого пищевого волокна, подвергающегося бактериальному гидролизу толстокишечной микрофлорой с высвобождением дополнительного количества бутирата [13].
Масляная кислота в норме образуется в толстой кишке в результате расщепления нормальной микрофлорой кишки неперевариваемых углеводов, поступающих вместе с пищей. Основная функция масляной кислоты — снабжение энергией клеток слизистой оболочки толстой кишки и поддержание их в здоровом функциональном состоянии. Масляная, уксусная и пропионовая кислоты составляют приблизительно 83% от короткоцепочечных жирных кислот (КЦЖК) в толстой кишке [14]. Концентрация этих кислот в просвете кишечника колеблется от 60 ммоль/кг до 150 ммоль/кг [15]. Предпочтительным источником бутирата является хорошо сбалансированная диета, богатая пробиотиками, пребиотиками и клетчаткой. В производстве бутирата участвуют следующие виды бактерий: Eubacterium spp., Fusobacterium spp., Butyrivibrio spp., Megasphaera elsdenii, Mitsuokella multiacida, Roseburia intestinalis, и Faecalibacterium prausnitzii, а также непатогенные виды клостридий [16].
Нами проведено проспективное интервенционное исследование с целью оценки клинической эффективности препарата Закофальк в составе комплексной терапии различных вариантов СРК.
Задачами исследования были оценка эффективности препарата Закофальк по влиянию на основные синдромы (болевой, синдром диареи/запора, синдром метеоризма), а также переносимости и безопасности препарата.
Материалы и методы исследования
Проспективное интервенционное исследование проведено в двух медицинских центрах г. Иркутска: поликлиническое отделение Клиник ГБОУ ВПО Иркутский Государственный медицинский университет Минздрава России и ООО Медицинский центр «Виктория». В исследование было включено 63 амбулаторных пациента с СРК.
Диагноз СРК ставили согласно Римским критериям ІІІ (2006 г.) при исключении органической патологии органов желудочно-кишечного тракта. Кроме того, критериями исключения являлись тяжелая соматическая патология (сердечно-сосудистая патология, дыхательная недостаточность и др.); онкологическая патология любой локализации.
Все пациенты с СРК были разделены на две основные группы в зависимости от проводимой терапии: 1-я группа — 31 пациент с различными вариантами СРК на фоне стандартной терапии в комбинации с приемом препарата Закофальк и 2-я группа — 32 пациента с различными вариантами СРК на фоне стандартной терапии (рис. 1). Стандартная терапия включала: при CРК с преобладанием запора — миотропные спазмолитики в терапевтических дозах, препарат Мукофальк 2–6 пакетиков в сутки (в зависимости от тяжести запора); при CРК с преобладанием диареи — миотропные спазмолитики и лоперамид в терапевтических дозах. По данным Кохрановсого обзора наиболее эффективными спазмолитическими препаратами для купирования боли являются пинаверия бромид и тримебутин [17].
Из спазмолитических препаратов пациенты получали пинаверия бромид 200 мг в сутки или тримебутин 600 мг в сутки. Пациенты с СРК в первой группе в дополнение к стандартной терапии получали препарат Закофальк по 1 таблетке 3 раза в сутки. Длительность курса терапии составила 1 месяц. Больные дважды посещали врача — до начала лечения и после его окончания. До начала лечения и в конце лечения оценивали выраженность клинических проявлений (выраженность болевого синдрома в брюшной полости и метеоризма оценивали по шкале ВАШ, консистенцию стула по Бристольской шкале кала). Статистическую обработку проводили, используя программу Statistica 8 for Windows. Достоверность различий определяли по критерию Манна–Уитни. Качественные показатели сравнивались с помощью критерия χ2.
Результаты исследования
Из исследования выбыли 3 пациента: 2 из 1-й группы (прекратили прием препаратов) и 1 пациент из 2-й (не явился на второй визит). Таким образом, оценка эффективности препарата Закофальк в составе комплексной терапии проведена у 29 пациентов с СРК 1-й группы (из них у 14 диагностирован вариант СРК с запором, у 15 — СРК с диареей) в сравнительном аспекте с 31 пациентом 2-й группы на фоне стандартной терапии (из них у 16 — вариант СРК с запором, у 15 — СРК с диареей) (рис. 1).
После проведенного лечения в обеих группах пациентов с СРК с диареей отмечено уменьшение болевого синдрома, урежение стула, уменьшение метеоризма и чувства неполного опорожнения. В 1-й группе болевой синдром был полностью купирован у 12 пациентов (80%), в то время как во второй группе полное исчезновение болевого синдрома отметили 6 пациентов (40%) (p < 0,05), что свидетельствует об эффективности комбинации спазмолитиков и препарата Закофальк в купировании болевого синдрома у пациентов с СРК с преобладанием диареи, p < 0,05 (рис. 2).
В результате лечения у пациентов с СРК, вариант с преобладанием запоров, как в 1-й, так и во 2-й группах отмечено уменьшение интенсивности болевого синдрома, нормализация консистенции и частоты стула. В 1-й группе болевой синдром был полностью купирован у 12 пациентов (86%), во 2-й лишь 5 пациентов (31%) отметили отсутствие абдоминальных болей после проведенного лечения, p < 0,05 (рис. 3).
У 2 пациентов в 1-й группе болевой синдром в животе сохранялся, но был слабой степени интенсивности и возникал 1 раз в 5–6 дней.
После проведенного лечения в 1-й группе с преобладанием диареи у всех пациентов частота стула нормализовалась: стул был в среднем 1 раз в сутки (у 10 пациентов 1 раз в сутки, у 5 — 2 раза), причем преобладал 3–4 тип стула по Бристольской шкале кала; во 2-й же группе пациенты отмечали частоту стула 3 раза (у 12 пациентов стул был 3 раза в сутки, у 3 — 4 раза) (p < 0,05), сохранялся 5-й тип по шкале.
У большинства пациентов с СРК с запором в обеих группах частота стула нормализовалась (в то время как различия не были статистически достоверны, p > 0,05), стул после проведенного лечения соответствовал 3–4 типу по Бристольской шкале кала.
На первом приеме вздутие живота отмечено у 10 пациентов (67%) с СРК 1-й группы с преобладанием диареи, из них после лечения метеоризм прошел у 8 (80%). Во 2-й группе симптом вздутия живота отмечали 9 (60%) пациентов с СРК с преобладанием диареи, из них метеоризм купирован у 7 (78%), что статистически незначимо.
После лечения вздутие живота прошло у пациентов с СРК с запором: в 1-й группе — у 8 из 14 пациентов (57%), во 2-й группе — у 8 из 16 (50%) (p > 0,05). В обеих группах у пациентов с СРК с запором чувство неполного опорожнения прошло после лечения: в 1-й группе — у 11 пациентов (79%), во 2-й группе — у 12 (75%) (p > 0,05).
Побочных действий препарата Закофальк не было отмечено ни у одного пациента.
Таким образом, полученные результаты свидетельствуют, что препарат Закофальк является эффективным препаратом в комплексной терапии пациентов с СРК: эффективно купирует болевой синдром при различных вариантах СРК; при СРК с диареей нормализует стул (уменьшает частоту и нормализует консистенцию); побочные действия при применении препарата Закофальк отсутствовали.
Обсуждение результатов исследования
Эффективное купирование абдоминального болевого синдрома при применении в комплексной терапии препарата Закофальк у пациентов с СРК, очевидно, связано со снижением ВГЧ под влиянием масляной кислоты и ее противовоспалительными свойствами. Основными механизмами снижения ВГЧ на фоне терапии масляной кислотой являются увеличение высвобождения 5-гидрокситриптамина, инактивация масляной кислотой активности TRPV1-рецепторов в слизистой оболочке толстой кишки, а также ингибирование гистондезацетилазы (НDaС) [17–19].
Исследование S. A. Vanhouten и соавт. с участием здоровых добровольцев продемонстрировало дозозависимый эффект влияния бутирата на ВГЧ [20].
Снижение ВГЧ непосредственно связано с противовоспалительными свойствами бутирата. Так, было показано, что масляная кислота оказывает прямое противовоспалительное действие как in vitro, так и in vivo, местно ингибируя медиаторы воспаления в эпителии кишечника. Была зарегистрирована способность бутирата уменьшать концентрацию провоспалительных цитокинов, таких как ИЛ-8 и ФНО-α, а также оксида азота, интерферона-гамма, ИЛ-2, ИЛ-12, в то же время повышается активность противовоспалительного цитокина ИЛ-10 [21, 22].
В ряде исследований продемонстрировано антиоксидантное свойство масляной кислоты. Было показано, что локальное введение масляной кислоты в физиологических концентрациях здоровым добровольцам увеличивает уровень ключевого фермента, подавляющего оксидативный стресс, — восстановленного глутатиона [23].
В эксперименте на животных был уточнен механизм антиоксидантного действия масляной кислоты: снижение активности миелопероксидазы, восстановление концентрации антиоксиданта глутатиона в колоноцитах и усиление активности глутатион-S-трансферазы [24].
Снижая ВГЧ, бутират уменьшает внутрикишечное давление. Он улучшает перистальтику кишечника и усиливает сократимость циркулярного мышечного слоя [25].
Масляная кислота непосредственно влияет на желудочно-кишечную микрофлору. Присутствие бутират-синтезирующих видов бактерий в кишечнике подавляет рост кишечной палочки, Campylobacter spp., Salmonella spp. и Shigella spp. [26]. Бутират является мощным индуктором человеческого кателицидина LL-37, одного из антимикробных белков, которые являются частью защиты хозяина [27].
Продемонстрированную эффективность применения препарата Закофальк при СРК с диареей можно объяснить антисекреторным действием масляной кислоты [14].
Применение препаратов масляной кислоты является обоснованным еще в связи с тем, что у пациентов с СРК, как показано в недавно проведенных исследованиях, относительное содержание бутират-продуцирующих бактерий значительно ниже по сравнению со здоровыми лицами контрольной группы, в частности, у пациентов с СРК с преобладанием диареи и СРК со смешанным вариантом, не получавших какого-либо лечения [28].
Описаны также другие многочисленные механизмы, обусловливающие как противовоспалительный эффект действия масляной кислоты, регенераторный (трофический) эффект на пролиферацию клеток кишечника, так и влияющие на ВГЧ, иммунную систему, усиливающие апоптоз [14, 24, 25, 29, 30].
Заключение
Таким образом, препарат Закофальк является патогенетически обоснованным средством лечения пациентов с СРК в связи с воздействием на основные патофизиологические звенья, участвующие в развитии СРК. Полученные данные свидетельствуют об эффективности применения комплексного препарата масляной кислоты Закофальк у пациентов с СРК наряду со стандартной терапией для купирования болевого синдрома и нормализации стула при СРК с диареей. Продолжительность настоящего исследования относительно коротка (1 месяц), учитывая, что СРК — хроническое заболевание, в дальнейшем необходимы исследования, более продолжительные по времени, что является целью наших будущих исследований. В перспективе подтверждение эффективности и безопасности препарата Закофальк требует широкомасштабных многоцентровых исследований.
Выводы
- Препарат Закофальк, применяемый в комбинации со стандартной терапией пациентов с СРК, эффективнее (в 3 раза) купирует болевой синдром при вариантах СРК как с преобладанием диареи, так и запоров в сравнении с только стандартной терапией.
- При СРК с диареей препарат Закофальк, применяемый в комплексной терапии, нормализует стул (уменьшает частоту и нормализует консистенцию), по сравнению с контрольной группой пациентов, получающих стандартную терапию.
- Препарат Закофальк хорошо переносится, побочные действия при применении препарата отсутствовали.
- Рекомендуется включение препарата Закофальк как патогенетически обоснованного средства в комплексную схему лечения пациентов с СРК с целью купирования болевого синдрома (при всех вариантах СРК) и нормализации стула (при варианте СРК с преобладанием диареи).
Литература
- Canavan C., West J., Card T. The epidemiology of irritable bowel syndrome // Clin Epidemiol. 2014; 6: 71–80.
- Drossman D. A. The functional gastrointestinal disorders and the Rome III process // Gastroenterology. 2006; 130 (5): 1377–1390.
- Drossman D. A. The functional Gastrointestinal Disorders: History, Pathophysiology, Clinical Features and Rome IV // Gastroenterology. 2016; 150 (6): 1262–1279.
- Drossman D. A., Hasler W. L. Rome IV — Functional GI Disorders of Gut-Brain Interaction // Gastroenterology. 2016; 150 (6): 1257–1261.
- Farzaei M. H., Bahramsoltani R., Abdollahi M., Rahimi R. The role of visceral hypersensitivity in irritable bowel syndrome: pharmacological targets and novel treatments // Neurogastroenterol Motil. 2016; 22 (4): 558–574.
- Qi Q., Chen F., Zhang W., Wang P. et al. Colonic N-methyl-D-aspartate receptor contributes to visceral hypersensitivity in irritable bowel syndrome // Gastroenterol Hepatol 2016, Aug 30. Epub 2016 Aug 30.
- El-Salhy M., Hausken T., Gilja O. H. et al. The possible role of gastrointestinal endocrine cells in the pathophysiology of irritable bowel syndrome // Expert Rev Gastroenterol Hepatol. 2016, Dec 14: 1–10.
- Martin-Viñas J. J., Quigley E. M. Immune response in irritable bowel syndrome: A systematic review of systemic and mucosal inflammatory mediators // Dig Dis. 2016 Sep; 17 (9): 572–581.
- Mete R., Tulubas F., Oran M., Yilmaz A. The role of oxidants and reactive nitrogen species in irritable bowel syndrome: a potential etiological explanation // Med Sci Monit. 2013, Sep 13; 19: 762–766.
- Raskov H., Burcharth J., Pommergaard H. C., Rosenberg J. Irritable bowel syndrome, the microbiota and the gut-brain axis // Gut Microbes. 2016; Jul 29: 1–19.
- Ringel-Kulka T., Choi C. H., Temas D. et al. Altered colonic bacterial fermentation as a potential pathophysiological factor in irritable bowel syndrome // Am. J. Gastroenterol. 2015 Sep; 110 (9): 1339–1346.
- Ивашкин В. Т., Шелыгин Ю. А., Баранская Е. К. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации, Ассоциации колопроктологов России по диагностике и лечению больных синдромом раздраженного кишечника // Российский ЖГГК. 2014; 2: 92–101.
- Маев И. В., Кучерявый Ю. А., Черёмушкин С. В. Эволюция представлений о синдроме разражённого кишечника. Метод. рекомендации для врачей. М., 2013, 80 с.
- Zaleski A., Banaszkiewicz A., Walkowiak J. Butyric acid in irritable bowel syndrome // Prz Gastroenterol. 2013; 8 (6): 350–353.
- Topping D. L., Clifton P. M. Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides // Physiol Rev. 2001; 81: 31–64.
- Hold G. L., Schwiertz A., Aminov R. I. et al. Oligonucleotide probes that detect quantitatively significant groups of butyrate-producing bacteria in human feces // Appl Environ Microbiol. 2003; 69: 4320–4324.
- Ruepert T., Quartero А., de Wit N. et al. Bulking agents, antispasmodics and antidepressants for the treatment of irritаblе bowel syndrome // Cochrane Database Syst Rev. 2011; 8: CD 003460.
- Kannampalli P., Shaker R., Sengupta J. N. Colonic Butyrate- algesic or analgesic? // Neurogastroenterol Motil. 2011; 23 (11): 975–979.
- Felice C., Lewis A., Armuzzi A. et al. Review article: selective histone deacetylase isoforms as potential therapeutic targets in inflammatory bowel diseases // Aliment Pharmacol Ther. 2015; 41 (1): 26–38.
- Vanhoutvin S. A., Troost F. J., Kilkens T. O. et al. The effects of butyrate enemas on visceral perception in healthy volunteers // Neurogastroenterol. Motil. 2009; 21 (9): 952–976.
- Hamer Н., Jonkers D., Venema K. et al. Review article: the role of butyrate on colonic function // Aliment. Pharmacol. Ther. 2008; 27: 104–119.
- Säemann M. D., Böhmig G. A., Zlabinger G. J. Short-chain fatty acids: bacterial mediators of a balanced host-microbial relationship in the human gut // Wien Klin Wochenschr. 2002; 114 (8–9): 289–300.
- Hamer H. M., Jonkers D. M., Bast A. et al. Butyrate modulates oxidative stress in the colonic mucosa of healthy humans // Clin Nutr. 2009; 28: 88–93.
- Toden S., Bird A. R., Topping D. L. et al. Dose-dependent reduction of dietary protein-induced colonocyte DNA damage by resistant starch in rats correlates more highly with caecal butyrate than with other short chain fatty acids // Cancer Biol Ther. 2007; 6: 253–258.
- Banasiewicz T., Kaczmarek E., Maik J. et al. Quality of life and the clinical symptoms at the patients with irritable bowel syndrome treated complementary with protected sodium butyrate // Gastroenterol Prakt. 2011; 5: 45–53.
- Chen C. C., Walker W. A. Probiotics and prebiotics: role in clinical disease states // Adv Pediatr. 2005; 52: 77–113.
- Van der Does A. M., Bergman P., Agerberth B. et al. Induction of the human cathelicidin LL-37 as a novel treatment against bacterial infections // Leukoc Biol. 2012 Oct; 92 (4): 735–742.
- Pozuelo M., Panda S., Santiago A. et al. Reduction of butyrate- and methane-producing microorganisms in patients with Irritable Bowel Syndrome // Sci Rep. 2015 Aug 4; 5: 12693.
- Deiteren A., de Wit A., van der Linden L. et al. Irritable bowel syndrome and visceral hypersensitivity: risk factors and pathophysiological mechanisms // Acta Gastroenterol Belg. 2016; 79 (1): 29–38.
- Canani R. B., Costanzo M. D., Leone L. еt al. Potential beneficial effects of butyrate in intestinal and extraintestinal diseases // World J. Gastroenterol. 2011, 17 (12): 1519–1528.
Н. М. Козлова1, доктор медицинских наук, профессор
Н. И. Меринова, кандидат медицинских наук
ФГБОУ ВО ИГМУ МЗ РФ, Иркутск
1 Контактная информация: natkova@yandex.ru
Бутират, 11С
(Butyratum, 11C)
0.001 ‰
Бутират, 11С (раствор для внутривенного введения, 300-1600 МБк/мл), инструкция по медицинскому применению РУ № Р N001367/01
Дата последнего изменения: 15.06.2017
Особые отметки:
Содержание
- ATX
- Фармакологическая группа
- Лекарственная форма
- Состав
- Свойства компонентов
- Описание лекарственной формы
- Фармакокинетика
- Фармакодинамика
- Фармако-терапевтическая группа
- Показания
- Противопоказания
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Условия отпуска из аптек
- Условия хранения
- Срок годности
ATX
Фармакологическая группа
Лекарственная форма
Раствор для внутривенного введения.
Состав
Состав*
В 1 мл раствора содержится:
Углерод-11 — от 300 до 1600 МБк
Натрия гидрокарбонат — 13,0 мг
Вода для инъекций — до 1,0 мл
* Получение препарата происходит в процессе непрерывного синтеза в специализированном модуле.
Примечание. Углерод-11 получают на ускорителе протонов по ядерной реакции 14N(p, )11C при облучении газообразного азота природного изотопного состава (ГОСТ 9293-74). Углерод-11 в препарате находится в химической форме натриевой соли 1-[11С]- масляной кислоты (натрия 1-[11С]-бутират).
Свойства компонентов
Препарат представляет собой изотонический раствор натрия гидрокарбоната, содержащий углерод-11 в химической форме натриевой соли 1-[11С] масляной кислоты (натрия 1-[11С] бутират). Препарат получают без добавления носителя.
Объемная активность препарата от 300 до 1600 МБк/мл на дату и время изготовления, pH от 8,0 до 9,5, радиохимическая чистота не менее 95,0 %.
Период полураспада углерода-11 составляет 20,38 мин. Радионуклид распадается по позитронному типу со средней энергией позитронов 385 кэВ, энергия аннигиляционного гамма-излучения составляет 511 кэВ.
Описание лекарственной формы
Прозрачная бесцветная жидкость.
Фармакокинетика
После внутривенного введения РФП «Бутират, 11С» быстро покидает кровяное русло и уже через 1 мин содержание его в крови не превышает 4-5 % от введенного. Током крови препарат доставляется в ткани, где включается в обменные процессы соответственно уровню их перфузии. Максимальный уровень захвата в органах и тканях наблюдается на 1 минуте. РФП накапливается в повышенных количествах в почках (0,12 г %), печени (0,1 г %), селезенке (0,06 г %), миокарде (0,03 г %), поджелудочной железе (0,03 г %).
В остальных органах, включая головной мозг, легкие, мышцы, скелет и кожу накопление препарата фоновое. В печени, селезенке и железах метаболизация препарата замедлена. В тоже время из миокарда и почек в норме наблюдается быстрое выведение радионуклидной метки. С момента внутривенного введения РФП отмечается постепенное выведение радионуклидной метки через легкие в виде диоксида углерода, углерод-11.
Площадь под кривой «концентрация/время» (AUC) накопления и выведения РФП «Бутират, 11С» для сердечной мышцы биэкспоненциальна и характеризуется фазой быстрого накопления РФП в миокарде, за которой следует фаза быстрой элиминации радионуклидной метки (отражает процесс -окисления жирной кислоты), и фаза медленной элиминации радионуклидной метки (отражает процесс образования меченых фосфолипидов и триглицеридов). Время достижения максимальной концентрации (ТСmах) препарата в здоровом миокарде — 1-2 минуты, период полувыведения (T1/2) — 20-22 мин. В норме через 30 минут после введения РФП 60-80 % радионуклидной метки выводится из миокарда в легкие в виде диоксида углерода-11. В условиях гипоксии сердечной мышцы наблюдается замедление скорости накопления и выведения радионуклидной метки из миокарда.
ТСmах для «Бутират, 11С» в опухолевых клетках — 2-6 мин. Отношение опухоль/нормальная ткань, достаточное для визуализации злокачественных и гиперваскулярных доброкачественных опухолей, сохраняется еще в течение 20 минут.
Фармакодинамика
При внутривенном введении препарат «Бутират, 11С» быстро выводится из крови. Максимальный уровень захвата препарата в органах наблюдается на второй минуте и сохраняется еще не менее 20 мин, что достаточно для проведения позитронной эмиссионной томографии. Препарат поступает и распределяется в органах пропорционально уровню перфузии и метаболической активности белков-транспортеров. В клеточных митохондриях происходит -окисление жирной кислоты с образованием 11С-Ацетил-КоА. В условиях достаточной оксигенации 11С-Ацетил-КоА метаболизируется в цикле Кребса в диоксид углерода, углерод-11 и воду. В условиях гипоксии образуются преимущественно меченые фосфолипиды и триглицериды. Фосфолипиды и триглицериды задерживаются в клетке, причем в условиях гипоксии доля образования фосфолипидов и триглицеридов, по сравнению с диоксидом углерода, возрастает.
С момента введения РФП «Бутират, 11С» наблюдается постепенное выведение радионуклидной метки через легкие в виде диоксида углерода, углерод-11. Почками радионуклидная метка не выводится.
«Бутират, 11С» является неспецифическим туморотропным радиофармпрепаратом (РФП). По своим диагностическим свойствам РФП пригоден для проведения позитронной эмиссионной томографии с целью диагностики опухолей.
Наиболее информативно исследование злокачественных и гиперваскулярных доброкачественных опухолей головного мозга, так как в коре головного мозга препарат не накапливается, что не препятствует визуализации новообразований. Следует также отметить возможность визуализации рака предстательной железы, так при внутривенном введении данного препарата радионуклидная метка в мочевой пузырь не поступает.
РФП «Бутират, 11С» является также кардиотропным средством и пригоден для исследования метаболизма жирных кислот в миокарде. В норме при внутривенном введении «Бутират, ПС» равномерно распределяется во всех отделах левого желудочка миокарда пропорционально миокардиальной перфузии. В последующие 30 минут происходит постепенное равномерное выведение радионуклидной метки из миокарда по мере метаболизации препарата, при этом наблюдается повышенное накопление углерода-11 в легких и выдыхаемом воздухе. При значимом снижении миокардиального кровотока, приводящем к гипоксии, уровень захвата и -оксидация жирных кислот уменьшаются, в результате чего радионуклидная метка задерживается в миоцитах в виде меченых фосфолипидов и триглицеридов. В участках постинфарктного кардиосклероза наблюдается стойкая гипофиксация РФП, что свидетельствует о гипоперфузии и отсутствии метаболизма.
Фармако-терапевтическая группа
Радиофармацевтическое диагностическое средство.
Показания
Препарат «Бутират, 11С» применяют в качестве диагностического средства для позитронной эмиссионной томографии (ПЭТ). Основными показаниями для проведения исследования являются:
в онкологии:
- диагностика и дифференциальная диагностика злокачественных и доброкачественных новообразований;
- контроль эффективности лечения злокачественных новообразований, в том числе при выявлении продолженного роста злокачественных опухолей в послеоперационной зоне.
в кардиологии:
- оценка жизнеспособности дисфункционирующего миокарда, в том числе у больных с полной блокадой левой ножки пучка Гиса;
- диагностика ишемической болезни сердца (ИБС), в частности определение степени гипоксии сердечной мышцы;
- оценка эффективности проводимого лечения ИБС.
Противопоказания
Использование РФП «Бутират, 11С» противопоказано при беременности, в период лактации и для исследования у детей, так как клинические испытания проводились только у взрослых. Возможны реакции гиперчувствительности.
Способ применения и дозы
Реклама: ООО «РЛС-Библиомед», ИНН 7714758963, erid=4CQwVszH9pUmKjt23pm
Препарат в виде стерильного раствора вводится больным внутривенно струйно. Перед использованием во флакон с РФП «Бутират, 11С» добавляют 10 % раствор плацентарного альбумина в соотношении 1:1 к объему РФП. Смесь фильтруют через стерилизующий фильтр с величиной пор 0,22 мкм. Готовый стерильный раствор должен быть прозрачным. В случае наличия у больного в анамнезе аллергической реакции на белок РФП «Бутират, 11С» может вводиться без альбумина.
Динамические ПЭТ-исследования больных оптимально начинать сразу после инъекции РФП «Бутират, 11С» и проводить в динамическом режиме в течение 30 минут. Специальной подготовки онкологических пациентов не требуется. Исследование кардиологических больных проводят натощак (последний прием пищи — вечерний).
Диагностическая доза препарата для проведения исследования в динамическом режиме составляет 200 МБк на 1 м2 поверхности тела пациента. Площадь поверхности тела определяется по номограмме на основании роста и массы тела пациента. Как правило, используют от 250 до 400 МБк препарата на одно обследование, который вводят внутривенно струйно в объеме от 0,5 до 2,5 мл.
Эффективная доза
Дозовые коэффициенты для расчета эффективных доз облучения пациентов при использовании препарата РФП «Бутират, 11С».
| Соединение | Дозовые коэффициенты, мЗв/МБк |
| Взрослые | |
| Бутират, 11С | 0,0035 |
Дозовый коэффициент при внутривенном введении «Бутирата, 11С» у взрослых составляет 3,5х10-3 мЗв/МБк. При введении диагностической дозы препарата (от 250 до 400МБк) эффективная доза составляет от 0,87 до 1,4 мЗв.
Побочные действия
При использовании препарата в соответствии с инструкцией и в рекомендованных дозах побочных действий не отмечалось.
Взаимодействие
Данные по лекарственному взаимодействию отсутствуют.
Передозировка
Передозировка препарата маловероятна в связи с тщательным контролем вводимой радиоактивности в условиях специализированного стационара.
Особые указания
Работа с препаратом проводится в соответствии с «Основными санитарными правилами обеспечения радиационной безопасности» (ОСПОРБ-99) и Методическими указаниями «Гигиенические требования по обеспечению радиационной безопасности при проведении радионуклидной диагностики с помощью радиофармпрепаратов» (МУ-2.6.1.1892-04).
Форма выпуска
РФП «Бутират, 11С», раствор для внутривенного введения с объемной радиоактивностью от 300 до 1600 МБк/мл выпускают порциями с активностью от 750 до 4000 МБк на установленную дату и время изготовления помещают в стеклянный стерильный флакон для лекарственных средств вместимостью 10 мл, герметически укупоренный резиновой медицинской пробкой типа 1-1, или УЛ-1А и обжатый алюминиевым колпачком. Каждый флакон помещают в контейнер транспортный для радиоактивных веществ типа КТ 1-20, к флакону прилагают инструкцию по медицинскому применению и паспорт.
Условия отпуска из аптек
Препарат реализации через аптечную сеть не подлежит.
Условия хранения
Препарат хранят в соответствии с требованиями «Основных санитарных правил обеспечения радиационной безопасности» (ОСПОРБ-99).
Срок годности
40 мин с даты и времени изготовления. Не использовать по истечении срока годности.
Дата обновления: 23.11.2020
|
||
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Butanoic acid[1] |
||
| Other names
Ethylacetic acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.003.212 |
|
| EC Number |
|
|
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
| MeSH | Butyric+acid | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 2820 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
C 3H 7COOH |
|
| Molar mass | 88.106 g·mol−1 | |
| Appearance | Colorless liquid | |
| Odor | Unpleasant, similar to vomit or body odor | |
| Density | 1.135 g/cm3 (−43 °C)[2] 0.9528 g/cm3 (25 °C)[3] |
|
| Melting point | −5.1 °C (22.8 °F; 268.0 K)[3] | |
| Boiling point | 163.75 °C (326.75 °F; 436.90 K)[3] | |
|
Sublimation |
Sublimes at −35 °C ΔsublH |
|
|
Solubility in water |
Miscible | |
| Solubility | Miscible with ethanol, ether. Slightly soluble in CCl4 | |
| log P | 0.79 | |
| Vapor pressure | 0.112 kPa (20 °C) 0.74 kPa (50 °C) 9.62 kPa (100 °C)[4] |
|
|
Henry’s law |
5.35·10−4 L·atm/mol | |
| Acidity (pKa) | 4.82 | |
|
Magnetic susceptibility (χ) |
−55.10·10−6 cm3/mol | |
| Thermal conductivity | 1.46·105 W/m·K | |
|
Refractive index (nD) |
1.398 (20 °C)[3] | |
| Viscosity | 1.814 cP (15 °C)[5] 1.426 cP (25 °C) |
|
| Structure | ||
|
Crystal structure |
Monoclinic (−43 °C)[2] | |
|
Space group |
C2/m[2] | |
|
Lattice constant |
a = 8.01 Å, b = 6.82 Å, c = 10.14 Å[2] α = 90°, β = 111.45°, γ = 90° |
|
|
Dipole moment |
0.93 D (20 °C)[5] | |
| Thermochemistry | ||
|
Heat capacity (C) |
178.6 J/mol·K[4] | |
|
Std molar |
222.2 J/mol·K[5] | |
|
Std enthalpy of |
−533.9 kJ/mol[4] | |
|
Std enthalpy of |
2183.5 kJ/mol[4] | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [6] [6]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H314[6] | |
|
Precautionary statements |
P280, P305+P351+P338, P310[6] | |
| NFPA 704 (fire diamond) |
 3 2 0 |
|
| Flash point | 71 to 72 °C (160 to 162 °F; 344 to 345 K)[6] | |
|
Autoignition |
440 °C (824 °F; 713 K)[6] | |
| Explosive limits | 2.2–13.4% | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
2000 mg/kg (oral, rat) | |
| Safety data sheet (SDS) | External MSDS | |
| Related compounds | ||
|
Related carboxylic acids |
Propionic acid, Pentanoic acid | |
|
Related compounds |
1-Butanol Butyraldehyde Methyl butyrate |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
Butyric acid (; from Ancient Greek: βούτῡρον, meaning «butter»), also known under the systematic name butanoic acid, is a straight-chain alkyl carboxylic acid with the chemical formula CH3CH2CH2CO2H. It is an oily, colorless liquid with an unpleasant odor. Isobutyric acid (2-methylpropanoic acid) is an isomer. Salts and esters of butyric acid are known as butyrates or butanoates. The acid does not occur widely in nature, but its esters are widespread. It is a common industrial chemical[7] and an important component in the mammalian gut.
History[edit]
Butyric acid was first observed in an impure form in 1814 by the French chemist Michel Eugène Chevreul. By 1818, he had purified it sufficiently to characterize it. However, Chevreul did not publish his early research on butyric acid; instead, he deposited his findings in manuscript form with the secretary of the Academy of Sciences in Paris, France. Henri Braconnot, a French chemist, was also researching the composition of butter and was publishing his findings, and this led to disputes about priority. As early as 1815, Chevreul claimed that he had found the substance responsible for the smell of butter.[8] By 1817, he published some of his findings regarding the properties of butyric acid and named it.[9] However, it was not until 1823 that he presented the properties of butyric acid in detail.[10] The name butyric acid comes from βούτῡρον, meaning «butter», the substance in which it was first found. The Latin name butyrum (or buturum) is similar.
Occurrence[edit]
Triglycerides of butyric acid compose 3–4% of butter. When butter goes rancid, butyric acid is liberated from the glyceride by hydrolysis.[11] It is one of the fatty acid subgroup called short-chain fatty acids. Butyric acid is a typical carboxylic acid that reacts with bases and affects many metals.[12]
It is found in animal fat and plant oils, bovine milk, breast milk, butter, parmesan cheese, body odor, vomit, and as a product of anaerobic fermentation (including in the colon).[13][14] It has a taste somewhat like butter and an unpleasant odor. Mammals with good scent detection abilities, such as dogs, can detect it at 10 parts per billion, whereas humans can detect it only in concentrations above 10 parts per million. In food manufacturing, it is used as a flavoring agent.[15]
In humans, butyric acid is one of two primary endogenous agonists of human hydroxycarboxylic acid receptor 2 (HCA2), a Gi/o-coupled G protein-coupled receptor.[16][17]
Butyric acid is present as its octyl ester in parsnip (Pastinaca sativa)[18] and in the seed of the ginkgo tree.[19]
Production[edit]
Industrial[edit]
In industry, butyric acid is produced by hydroformylation from propene and syngas, forming butyraldehyde, which is oxidised to the final product.[7]
- H2 + CO + CH3CH=CH2 → CH3CH2CH2CHOoxidation→butyric acid
It can be separated from aqueous solutions by saturation with salts such as calcium chloride. The calcium salt, Ca(C4H7O2)2 · H2O, is less soluble in hot water than in cold.
Microbial biosynthesis[edit]
Butyrate is produced by several fermentation processes performed by obligate anaerobic bacteria.[20] This fermentation pathway was discovered by Louis Pasteur in 1861. Examples of butyrate-producing species of bacteria:
- Clostridium butyricum
- Clostridium kluyveri
- Clostridium pasteurianum
- Faecalibacterium prausnitzii
- Fusobacterium nucleatum
- Butyrivibrio fibrisolvens
- Eubacterium limosum
The pathway starts with the glycolytic cleavage of glucose to two molecules of pyruvate, as happens in most organisms. Pyruvate is oxidized into acetyl coenzyme A catalyzed by pyruvate:ferredoxin oxidoreductase. Two molecules of carbon dioxide (CO2) and two molecules of hydrogen (H2) are formed as waste products. Subsequently, ATP is produced in the last step of the fermentation. Three molecules of ATP are produced for each glucose molecule, a relatively high yield. The balanced equation for this fermentation is
- C6H12O6 → C4H8O2 + 2CO2 + 2H2
Other pathways to butyrate include succinate reduction and crotonate disproportionation.
| Action | Responsible enzyme |
|---|---|
| Acetyl coenzyme A converts into acetoacetyl coenzyme A | acetyl-CoA-acetyl transferase |
| Acetoacetyl coenzyme A converts into β-hydroxybutyryl CoA | β-hydroxybutyryl-CoA dehydrogenase |
| β-hydroxybutyryl CoA converts into crotonyl CoA | crotonase |
| Crotonyl CoA converts into butyryl CoA (CH3CH2CH2C=O−CoA) | butyryl CoA dehydrogenase |
| A phosphate group replaces CoA to form butyryl phosphate | phosphobutyrylase |
| The phosphate group joins ADP to form ATP and butyrate | butyrate kinase |
Several species form acetone and n-butanol in an alternative pathway, which starts as butyrate fermentation. Some of these species are:
- Clostridium acetobutylicum, the most prominent acetone and butanol producer, used also in industry
- Clostridium beijerinckii
- Clostridium tetanomorphum
- Clostridium aurantibutyricum
These bacteria begin with butyrate fermentation, as described above, but, when the pH drops below 5, they switch into butanol and acetone production to prevent further lowering of the pH. Two molecules of butanol are formed for each molecule of acetone.
The change in the pathway occurs after acetoacetyl CoA formation. This intermediate then takes two possible pathways:
- acetoacetyl CoA → acetoacetate → acetone
- acetoacetyl CoA → butyryl CoA → butyraldehyde → butanol
Fermentable fiber sources[edit]
Highly-fermentable fiber residues, such as those from resistant starch, oat bran, pectin, and guar are transformed by colonic bacteria into short-chain fatty acids (SCFA) including butyrate, producing more SCFA than less fermentable fibers such as celluloses.[14][21] One study found that resistant starch consistently produces more butyrate than other types of dietary fiber.[22] The production of SCFA from fibers in ruminant animals such as cattle is responsible for the butyrate content of milk and butter.[13][23]
Fructans are another source of prebiotic soluble dietary fibers which can be digested to produce butyrate.[24] They are often found in the soluble fibers of foods which are high in sulfur, such as the allium and cruciferous vegetables. Sources of fructans include wheat (although some wheat strains such as spelt contain lower amounts),[25] rye, barley, onion, garlic, Jerusalem and globe artichoke, asparagus, beetroot, chicory, dandelion leaves, leek, radicchio, the white part of spring onion, broccoli, brussels sprouts, cabbage, fennel, and prebiotics, such as fructooligosaccharides (FOS), oligofructose, and inulin.[26][27]
Reactions[edit]
Butyric acid reacts as a typical carboxylic acid: it can form amide, ester, anhydride, and chloride derivatives.[28] The latter, butyryl chloride, is commonly used as the intermediate to obtain the others.
Uses[edit]
Butyric acid is used in the preparation of various butyrate esters. It is used to produce cellulose acetate butyrate (CAB), which is used in a wide variety of tools, paints, and coatings, and is more resistant to degradation than cellulose acetate.[29] CAB can degrade with exposure to heat and moisture, releasing butyric acid.[30]
Low-molecular-weight esters of butyric acid, such as methyl butyrate, have mostly pleasant aromas or tastes.[7] As a consequence, they are used as food and perfume additives. It is an approved food flavoring in the EU FLAVIS database (number 08.005).
Due to its powerful odor, it has also been used as a fishing bait additive.[31] Many of the commercially available flavors used in carp (Cyprinus carpio) baits use butyric acid as their ester base. It is not clear whether fish are attracted by the butyric acid itself or the substances added to it. Butyric acid was one of the few organic acids shown to be palatable for both tench and bitterling.[32] The substance has been used as a stink bomb by the Sea Shepherd Conservation Society to disrupt Japanese whaling crews.[33]
Pharmacology[edit]
| Inhibited enzyme | IC50 (nM) | Entry note |
|---|---|---|
| HDAC1 | 16,000 | |
| HDAC2 | 12,000 | |
| HDAC3 | 9,000 | |
| HDAC4 | 2,000,000 | Lower bound |
| HDAC5 | 2,000,000 | Lower bound |
| HDAC6 | 2,000,000 | Lower bound |
| HDAC7 | 2,000,000 | Lower bound |
| HDAC8 | 15,000 | |
| HDAC9 | 2,000,000 | Lower bound |
| CA1 | 511,000 | |
| CA2 | 1,032,000 | |
| GPCR target | pEC50 | Entry note |
| FFAR2 | 2.9–4.6 | Full agonist |
| FFAR3 | 3.8–4.9 | Full agonist |
| HCA2 | 2.8 | Agonist |
Pharmacodynamics[edit]
Butyric acid (pKa 4.82) is fully ionized at physiological pH, so its anion is the material that is mainly relevant in biological systems.
It is one of two primary endogenous agonists of human hydroxycarboxylic acid receptor 2 (HCA2, also known as GPR109A), a Gi/o-coupled G protein-coupled receptor (GPCR),[16][17]
Like other short-chain fatty acids (SCFAs), butyrate is an agonist at the free fatty acid receptors FFAR2 and FFAR3, which function as nutrient sensors that facilitate the homeostatic control of energy balance; however, among the group of SCFAs, only butyrate is an agonist of HCA2.[36][37][38] It is also an HDAC inhibitor (specifically, HDAC1, HDAC2, HDAC3, and HDAC8),[34][35] a drug that inhibits the function of histone deacetylase enzymes, thereby favoring an acetylated state of histones in cells.[38] Histone acetylation loosens the structure of chromatin by reducing the electrostatic attraction between histones and DNA.[38] In general, it is thought that transcription factors will be unable to access regions where histones are tightly associated with DNA (i.e., non-acetylated, e.g., heterochromatin).[medical citation needed] Therefore, butyric acid is thought to enhance the transcriptional activity at promoters,[38] which are typically silenced or downregulated due to histone deacetylase activity.
Pharmacokinetics[edit]
Butyrate that is produced in the colon through microbial fermentation of dietary fiber is primarily absorbed and metabolized by colonocytes and the liver[note 1] for the generation of ATP during energy metabolism; however, some butyrate is absorbed in the distal colon, which is not connected to the portal vein, thereby allowing for the systemic distribution of butyrate to multiple organ systems through the circulatory system.[dubious – discuss][38] Butyrate that has reached systemic circulation can readily cross the blood–brain barrier via monocarboxylate transporters (i.e., certain members of the SLC16A group of transporters).[39][40] Other transporters that mediate the passage of butyrate across lipid membranes include SLC5A8 (SMCT1), SLC27A1 (FATP1), and SLC27A4 (FATP4).[34][40]
Metabolism [edit]
Butyric acid is metabolized by various human XM-ligases (ACSM1, ACSM2B, ASCM3, ACSM4, ACSM5, and ACSM6), also known as butyrate–CoA ligase.[41][42] The metabolite produced by this reaction is butyryl–CoA, and is produced as follows:[41]
- Adenosine triphosphate + butyric acid + coenzyme A → adenosine monophosphate + pyrophosphate + butyryl-CoA
As a short-chain fatty acid, butyrate is metabolized by mitochondria as an energy (i.e., adenosine triphosphate or ATP) source through fatty acid metabolism.[38] In particular, it is an important energy source for cells lining the mammalian colon (colonocytes).[24] Without butyrates, colon cells undergo autophagy (i.e., self-digestion) and die.[43]
In humans, the butyrate precursor tributyrin, which is naturally present in butter, is metabolized by triacylglycerol lipase into dibutyrin and butyrate through the reaction:[44]
- Tributyrin + H2O → dibutyrin + butyric acid
Biochemistry[edit]
Butyrate has numerous effects on energy homeostasis and related diseases (diabetes and obesity), inflammation, and immune function (e.g., it has pronounced antimicrobial and anticarcinogenic effects) in humans. These effects occur through its metabolism by mitochondria to generate ATP during fatty acid metabolism or through one or more of its histone-modifying enzyme targets (i.e., the class I histone deacetylases) and G-protein coupled receptor targets (i.e., FFAR2, FFAR3, and HCA2).[36][45]
In the mammalian gut[edit]
Butyrate is essential to host immune homeostasis.[36] Although the role and importance of butyrate in the gut is not fully understood, many researchers argue that a depletion of butyrate-producing bacteria in patients with several vasculitic conditions is essential to the pathogenesis of these disorders. A depletion of butyrate in the gut is typically caused by an absence or depletion of butyrate-producing-bacteria (BPB). This depletion in BPB leads to microbial dysbiosis. This is characterized by an overall low biodiversity and a depletion of key butyrate-producing members. Butyrate is an essential microbial metabolite with a vital role as a modulator of proper immune function in the host. It has been shown that children lacking in BPB are more susceptible to allergic disease[46] and Type 1 Diabetes.[47] Butyrate is also reduced in a diet low in dietary fiber which can induce inflammation and have other adverse affects insofar as these short-chain fatty acids activate PPAR-γ.[48]
Butyrate exerts a key role for the maintenance of immune homeostasis both locally (in the gut) and systemically (via circulating butyrate). It has been shown to promote the differentiation of regulatory T cells. In particular, circulating butyrate prompts the generation of extrathymic regulatory T cells. The low-levels of butyrate in human subjects could favor reduced regulatory T cell-mediated control, thus promoting a powerful immuno-pathological T-cell response.[49] On the other hand, gut butyrate has been reported to inhibit local pro-inflammatory cytokines. The absence or depletion of these BPB in the gut could therefore be a possible aide in the overly-active inflammatory response. Butyrate in the gut also protects the integrity of the intestinal epithelial barrier. Decreased butyrate levels therefore lead to a damaged or dysfunctional intestinal epithelial barrier.[50]
In a 2013 research study conducted by Furusawa et al., microbe-derived butyrate was found to be essential in inducing the differentiation of colonic regulatory T cells in mice. This is of great importance and possibly relevant to the pathogenesis and vasculitis associated with many inflammatory diseases because regulatory T cells have a central role in the suppression of inflammatory and allergic responses.[51] In several research studies, it has been demonstrated that butyrate induced the differentiation of regulatory T cells in vitro and in vivo.[52] The anti-inflammatory capacity of butyrate has been extensively analyzed and supported by many studies. It has been found that microorganism-produced butyrate expedites the production of regulatory T cells, although the specific mechanism by which it does so unclear.[53] More recently, it has been shown that butyrate plays an essential and direct role in modulating gene expression of cytotoxic T-cells.[54] Butyrate also has an anti-inflammatory effect on neutrophils, reducing their migration to wounds. This effect is mediated via the receptor HCA1[55]
In the gut microbiomes found in the class Mammalia, omnivores and herbivores have butyrate-producing bacterial communities dominated by the butyryl-CoA:acetate CoA-transferase pathway, whereas carnivores have butyrate-producing bacterial communities dominated by the butyrate kinase pathway.[56]
Immunomodulation and inflammation[edit]
Butyrate’s effects on the immune system are mediated through the inhibition of class I histone deacetylases and activation of its G-protein coupled receptor targets: HCA2 (GPR109A), FFAR2 (GPR43), and FFAR3 (GPR41).[37][57] Among the short-chain fatty acids, butyrate is the most potent promoter of intestinal regulatory T cells in vitro and the only one among the group that is an HCA2 ligand.[37] It has been shown to be a critical mediator of the colonic inflammatory response. It possesses both preventive and therapeutic potential to counteract inflammation-mediated ulcerative colitis and colorectal cancer.
Butyrate has established antimicrobial properties in humans that are mediated through the antimicrobial peptide LL-37, which it induces via HDAC inhibition on histone H3.[57][58][59] In vitro, butyrate increases gene expression of FOXP3 (the transcription regulator for Tregs) and promotes colonic regulatory T cells (Tregs) through the inhibition of class I histone deacetylases;[37][57] through these actions, it increases the expression of interleukin 10, an anti-inflammatory cytokine.[57][37] Butyrate also suppresses colonic inflammation by inhibiting the IFN-γ–STAT1 signaling pathways, which is mediated partially through histone deacetylase inhibition. While transient IFN-γ signaling is generally associated with normal host immune response, chronic IFN-γ signaling is often associated with chronic inflammation. It has been shown that butyrate inhibits activity of HDAC1 that is bound to the Fas gene promoter in T cells, resulting in hyperacetylation of the Fas promoter and up-regulation of Fas receptor on the T-cell surface.[60]
Similar to other HCA2 agonists studied, butyrate also produces marked anti-inflammatory effects in a variety of tissues, including the brain, gastrointestinal tract, skin, and vascular tissue.[61][62][63] Butyrate binding at FFAR3 induces neuropeptide Y release and promotes the functional homeostasis of colonic mucosa and the enteric immune system.[64]
Cancer[edit]
Butyrate has been shown to be a critical mediator of the colonic inflammatory response. It is responsible for about 70% of energy from the colonocytes, being a critical SCFA in colon homeostasis.[65] Butyrate possesses both preventive and therapeutic potential to counteract inflammation-mediated ulcerative colitis (UC) and colorectal cancer.[66] It produces different effects in healthy and cancerous cells: this is known as the «butyrate paradox». In particular, butyrate inhibits colonic tumor cells and stimulates proliferation of healthy colonic epithelial cells.[67][68] The explanation why butyrate is an energy source for normal colonocytes and induces apoptosis in colon cancer cells, is the Warburg effect in cancer cells, which leads to butyrate not being properly metabolized. This phenomenon leads to the accumulation of butyrate in the nucleus, acting as a histone deacetylase (HDAC) inhibitor.[69] One mechanism underlying butyrate function in suppression of colonic inflammation is inhibition of the IFN-γ/STAT1 signalling pathways. It has been shown that butyrate inhibits activity of HDAC1 that is bound to the Fas gene promoter in T cells, resulting in hyperacetylation of the Fas promoter and upregulation of Fas receptor on the T cell surface. It is thus suggested that butyrate enhances apoptosis of T cells in the colonic tissue and thereby eliminates the source of inflammation (IFN-γ production).[70] Butyrate inhibits angiogenesis by inactivating Sp1 transcription factor activity and downregulating vascular endothelial growth factor gene expression.[71]
In summary, the production of volatile fatty acids such as butyrate from fermentable fibers may contribute to the role of dietary fiber in colon cancer. Short-chain fatty acids, which include butyric acid, are produced by beneficial colonic bacteria (probiotics) that feed on, or ferment prebiotics, which are plant products that contain dietary fiber. These short-chain fatty acids benefit the colonocytes by increasing energy production, and may protect against colon cancer by inhibiting cell proliferation.[21]
Conversely, some researchers have sought to eliminate butyrate and consider it a potential cancer driver.[72] Studies in mice indicate it drives transformation of MSH2-deficient colon epithelial cells.[73]
Potential treatments from butyrate restoration[edit]
Owing to the importance of butyrate as an inflammatory regulator and immune system contributor, butyrate depletions could be a key factor influencing the pathogenesis of many vasculitic conditions. It is thus essential to maintain healthy levels of butyrate in the gut. Fecal microbiota transplants (to restore BPB and symbiosis in the gut) could be effective by replenishing butyrate levels. In this treatment, a healthy individual donates their stool to be transplanted into an individual with dysbiosis. A less-invasive treatment option is the administration of butyrate—as oral supplements or enemas—which has been shown to be very effective in terminating symptoms of inflammation with minimal-to-no side-effects. In a study where patients with ulcerative colitis were treated with butyrate enemas, inflammation decreased significantly, and bleeding ceased completely after butyrate provision.[74]
Addiction[edit]
Butyric acid is an HDACTooltip histone deacetylase inhibitor that is selective for class I HDACs in humans.[34] HDACs are histone-modifying enzymes that can cause histone deacetylation and repression of gene expression. HDACs are important regulators of synaptic formation, synaptic plasticity, and long-term memory formation. Class I HDACs are known to be involved in mediating the development of an addiction.[75][76][77] Butyric acid and other HDAC inhibitors have been used in preclinical research to assess the transcriptional, neural, and behavioral effects of HDAC inhibition in animals addicted to drugs.[77][78][79]
Butyrate salts and esters[edit]
The butyrate or butanoate ion, C3H7COO−, is the conjugate base of butyric acid. It is the form found in biological systems at physiological pH. A butyric (or butanoic) compound is a carboxylate salt or ester of butyric acid.
Examples[edit]
Salts[edit]
- Sodium butyrate
Esters[edit]
- Butyl butyrate
- Butyryl-CoA
- Cellulose acetate butyrate (aircraft dope)
- Estradiol benzoate butyrate
- Ethyl butyrate
- Methyl butyrate
- Pentyl butyrate
- Tributyrin
See also[edit]
- List of saturated fatty acids
- Hershey’s milk chocolate
- Histone
- Histone-modifying enzyme
- Histone acetylase
- Histone deacetylase
- Histone-modifying enzyme
- Hydroxybutyric acids
- α-Hydroxybutyric acid
- β-Hydroxybutyric acid
- γ-Hydroxybutyric acid
- Oxobutyric acids
- 2-Oxobutyric acid (α-ketobutyric acid)
- 3-Oxobutyric acid (acetoacetic acid)
- 4-Oxobutyric acid (succinic semialdehyde)
- β-Methylbutyric acid
- β-Hydroxy β-methylbutyric acid
Notes[edit]
- ^ Most of the butyrate that is absorbed into blood plasma from the colon enters the circulatory system via the portal vein; most of the butyrate that enters the circulatory system by this route is taken up by the liver.[38]
References[edit]
This article incorporates text from a publication now in the public domain: Chisholm, Hugh, ed. (1911). «Butyric Acid». Encyclopædia Britannica (11th ed.). Cambridge University Press.
- ^ «Applications to Specific Classes of Compounds». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 746. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ a b c d Strieter FJ, Templeton DH (1962). «Crystal structure of butyric acid» (PDF). Acta Crystallographica. 15 (12): 1240–1244. doi:10.1107/S0365110X6200328X.
- ^ a b c d Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b c d e Butanoic acid in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (retrieved 27 October 2020)
- ^ a b c «Butanoic acid». Chemister.ru. 19 March 2007. Retrieved 27 October 2020.
- ^ a b c d e Sigma-Aldrich Co., Butyric acid. Retrieved on 27 October 2020.
- ^ a b c Riemenschneider, Wilhelm (2002). «Carboxylic Acids, Aliphatic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a05_235.
- ^ Chevreul (1815) «Lettre de M. Chevreul à MM. les rédacteurs des Annales de chimie» (Letter from Mr. Chevreul to the editors of the Annals of Chemistry), Annales de chimie, 94 : 73–79; in a footnote spanning pages 75–76, he mentions that he had found a substance that is responsible for the smell of butter.
- ^ Chevreul (1817) «Extrait d’une lettre de M. Chevreul à MM. les Rédacteurs du Journal de Pharmacie» (Extract of a letter from Mr. Chevreul to the editors of the Journal of Pharmacy), Journal de Pharmacie et des sciences accessoires, 3 : 79–81. On p. 81, he named butyric acid: «Ce principe, que j’ai appelé depuis acid butérique, … « (This principle [i.e., constituent], which I have since named «butyric acid», … )
- ^ E. Chevreul, Recherches chimiques sur les corps gras d’origine animale [Chemical researches on fatty substances of animal origin] (Paris, France: F.G. Levrault, 1823), pages 115–133.
- ^ Woo, A.H.; Lindsay, R.C. (1983). «Stepwise Discriminant Analysis of Free Fatty Acid Profiles for Identifying Sources of Lipolytic Enzymes in Rancid Butter». Journal of Dairy Science. 66 (10): 2070–2075. doi:10.3168/jds.S0022-0302(83)82052-9.
- ^ ICSC 1334 – Butyric acid. Inchem.org (23 November 1998). Retrieved on 2020-10-27.
- ^ a b McNabney, S. M.; Henagan, T. M. (2017). «Short Chain Fatty Acids in the Colon and Peripheral Tissues: A Focus on Butyrate, Colon Cancer, Obesity and Insulin Resistance». Nutrients. 9 (12): 1348. doi:10.3390/nu9121348. PMC 5748798. PMID 29231905.
- ^ a b Morrison, D. J.; Preston, T. (2016). «Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism». Gut Microbes. 7 (3): 189–200. doi:10.1080/19490976.2015.1134082. PMC 4939913. PMID 26963409.
- ^ «Butyric acid». The Good Scents Company. Retrieved 26 October 2020.
- ^ a b Offermanns S, Colletti SL, Lovenberg TW, Semple G, Wise A, IJzerman AP (June 2011). «International Union of Basic and Clinical Pharmacology. LXXXII: Nomenclature and Classification of Hydroxy-carboxylic Acid Receptors (GPR81, GPR109A, and GPR109B)». Pharmacological Reviews. 63 (2): 269–90. doi:10.1124/pr.110.003301. PMID 21454438.
- ^ a b Offermanns S, Colletti SL, IJzerman AP, Lovenberg TW, Semple G, Wise A, Waters MG. «Hydroxycarboxylic acid receptors». IUPHAR/BPS Guide to Pharmacology. International Union of Basic and Clinical Pharmacology. Retrieved 13 July 2018.
- ^ Carroll, Mark J.; Berenbaum, May R. (2002). «Behavioral responses of the parsnip webworm to host plant volatiles». Journal of Chemical Ecology. 28 (11): 2191–2201. doi:10.1023/A:1021093114663. PMID 12523562. S2CID 23512190.
- ^ Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). Biology of Plants. W. H. Freemanand Company. pp. 429–431. ISBN 978-0-7167-1007-3. Retrieved 11 October 2018.
- ^ Seedorf, H.; Fricke, W. F.; Veith, B.; Bruggemann, H.; Liesegang, H.; Strittmatter, A.; Miethke, M.; Buckel, W.; Hinderberger, J.; Li, F.; Hagemeier, C.; Thauer, R. K.; Gottschalk, G. (2008). «The Genome of Clostridium kluyveri, a Strict Anaerobe with Unique Metabolic Features». Proceedings of the National Academy of Sciences. 105 (6): 2128–2133. Bibcode:2008PNAS..105.2128S. doi:10.1073/pnas.0711093105. PMC 2542871. PMID 18218779.
- ^ a b Lupton JR (February 2004). «Microbial degradation products influence colon cancer risk: the butyrate controversy». The Journal of Nutrition. 134 (2): 479–82. doi:10.1093/jn/134.2.479. PMID 14747692.
- ^ Cummings JH, Macfarlane GT, Englyst HN (February 2001). «Prebiotic digestion and fermentation». The American Journal of Clinical Nutrition. 73 (2 Suppl): 415S–420S. doi:10.1093/ajcn/73.2.415s. PMID 11157351.
- ^ Grummer RR (September 1991). «Effect of feed on the composition of milk fat». Journal of Dairy Science. 74 (9): 3244–57. doi:10.3168/jds.S0022-0302(91)78510-X. PMID 1779073.
- ^ a b Rivière, Audrey; Selak, Marija; Lantin, David; Leroy, Frédéric; De Vuyst, Luc (2016). «Bifidobacteria and Butyrate-Producing Colon Bacteria: Importance and Strategies for Their Stimulation in the Human Gut». Frontiers in Microbiology. 7: 979. doi:10.3389/fmicb.2016.00979. PMC 4923077. PMID 27446020.
- ^ «Frequently asked questions in the area of diet and IBS». Department of Gastroenterology Translational Nutrition Science, Monash University, Victoria, Australia. Retrieved 24 March 2016.
- ^ Gibson, Peter R.; Shepherd, Susan J. (1 February 2010). «Evidence-based dietary management of functional gastrointestinal symptoms: The FODMAP approach». Journal of Gastroenterology and Hepatology. 25 (2): 252–258. doi:10.1111/j.1440-1746.2009.06149.x. ISSN 1440-1746. PMID 20136989. S2CID 20666740.
- ^ Gibson, Peter R.; Varney, Jane; Malakar, Sreepurna; Muir, Jane G. (1 May 2015). «Food components and irritable bowel syndrome». Gastroenterology. 148 (6): 1158–1174.e4. doi:10.1053/j.gastro.2015.02.005. ISSN 1528-0012. PMID 25680668.
- ^ Jenkins, P. R. (1985). «Carboxylic acids and derivatives». General and Synthetic Methods. Vol. 7. pp. 96–160. doi:10.1039/9781847556196-00096. ISBN 978-0-85186-884-4.
- ^ Lokensgard, Erik (2015). Industrial Plastics: Theory and Applications (6th ed.). Cengage Learning.
- ^ Williams, R. Scott. «Care of Plastics: Malignant plastics». WAAC Newsletter. Vol. 24, no. 1. Conservation OnLine. Retrieved 29 May 2017.
- ^ Freezer Baits Archived 25 January 2010 at the Wayback Machine, nutrabaits.net
- ^ Kasumyan A, Døving K (2003). «Taste preferences in fishes». Fish and Fisheries. 4 (4): 289–347. doi:10.1046/j.1467-2979.2003.00121.x.
- ^ Japanese Whalers Injured by Acid-Firing Activists Archived 8 June 2010 at the Wayback Machine, newser.com, 10 February 2010
- ^ a b c d «Butyric acid». IUPHAR/BPS Guide to Pharmacology. International Union of Basic and Clinical Pharmacology. Retrieved 13 July 2018.
- ^ a b «Butanoic acid and Sodium butyrate». BindingDB. The Binding Database. Retrieved 27 October 2020.
- ^ a b c Kasubuchi M, Hasegawa S, Hiramatsu T, Ichimura A, Kimura I (2015). «Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation». Nutrients. 7 (4): 2839–49. doi:10.3390/nu7042839. PMC 4425176. PMID 25875123.
Short-chain fatty acids (SCFAs) such as acetate, butyrate, and propionate, which are produced by gut microbial fermentation of dietary fiber, are recognized as essential host energy sources and act as signal transduction molecules via G-protein coupled receptors (FFAR2, FFAR3, OLFR78, GPR109A) and as epigenetic regulators of gene expression by the inhibition of histone deacetylase (HDAC). Recent evidence suggests that dietary fiber and the gut microbial-derived SCFAs exert multiple beneficial effects on the host energy metabolism not only by improving the intestinal environment, but also by directly affecting various host peripheral tissues.
- ^ a b c d e Hoeppli RE, Wu D, Cook L, Levings MK (February 2015). «The environment of regulatory T cell biology: cytokines, metabolites, and the microbiome». Front Immunol. 6: 61. doi:10.3389/fimmu.2015.00061. PMC 4332351. PMID 25741338.
Figure 1: Microbial-derived molecules promote colonic Treg differentiation. - ^ a b c d e f g Bourassa MW, Alim I, Bultman SJ, Ratan RR (June 2016). «Butyrate, neuroepigenetics and the gut microbiome: Can a high fiber diet improve brain health?». Neurosci. Lett. 625: 56–63. doi:10.1016/j.neulet.2016.02.009. PMC 4903954. PMID 26868600.
- ^ Tsuji A (2005). «Small molecular drug transfer across the blood–brain barrier via carrier-mediated transport systems». NeuroRx. 2 (1): 54–62. doi:10.1602/neurorx.2.1.54. PMC 539320. PMID 15717057.
Other in vivo studies in our laboratories indicated that several compounds including acetate, propionate, butyrate, benzoic acid, salicylic acid, nicotinic acid, and some β-lactam antibiotics may be transported by the MCT at the BBB.21 … Uptake of valproic acid was reduced in the presence of medium-chain fatty acids such as hexanoate, octanoate, and decanoate, but not propionate or butyrate, indicating that valproic acid is taken up into the brain via a transport system for medium-chain fatty acids, not short-chain fatty acids.
- ^ a b Vijay N, Morris ME (2014). «Role of monocarboxylate transporters in drug delivery to the brain». Curr. Pharm. Des. 20 (10): 1487–98. doi:10.2174/13816128113199990462. PMC 4084603. PMID 23789956.
Monocarboxylate transporters (MCTs) are known to mediate the transport of short chain monocarboxylates such as lactate, pyruvate and butyrate. … MCT1 and MCT4 have also been associated with the transport of short chain fatty acids such as acetate and formate which are then metabolized in the astrocytes [78]. … SLC5A8 is expressed in normal colon tissue, and it functions as a tumor suppressor in human colon with silencing of this gene occurring in colon carcinoma. This transporter is involved in the concentrative uptake of butyrate and pyruvate produced as a product of fermentation by colonic bacteria.
- ^ a b Butyric acid. University of Alberta. Retrieved 15 August 2015.
- ^ «Butanoate metabolism – Reference pathway». Kyoto Encyclopedia of Genes and Genomes. Kanehisa Laboratories. 1 November 2017. Retrieved 1 February 2018.
- ^ Donohoe, Dallas R.; Garge, Nikhil; Zhang, Xinxin; Sun, Wei; O’Connell, Thomas M.; Bunger, Maureen K.; Bultman, Scott J. (4 May 2011). «The Microbiome and Butyrate Regulate Energy Metabolism and Autophagy in the Mammalian Colon». Cell Metabolism. 13 (5): 517–526. doi:10.1016/j.cmet.2011.02.018. ISSN 1550-4131. PMC 3099420. PMID 21531334.
- ^ «triacylglycerol lipase – Homo sapiens». BRENDA. Technische Universität Braunschweig. Retrieved 25 May 2015.
- ^ Tilg H, Moschen AR (September 2014). «Microbiota and diabetes: an evolving relationship». Gut. 63 (9): 1513–1521. doi:10.1136/gutjnl-2014-306928. PMID 24833634. S2CID 22633025.
- ^ Cait, Alissa; Cardenas, Erick (December 2019). «Reduced genetic potential for butyrate fermentation in the gut microbiome of infants who develop allergic sensitization». Journal of Allergy and Clinical Immunology. 144 (6): 1638–1647. E3. doi:10.1016/j.jaci.2019.06.029. PMID 31279007.
- ^ Vatanen, T.; Franzosa, E.A.; Schwager, R.; et al. (2018). «The human gut microbiome in early-onset type 1 diabetes from the TEDDY study». Nature. 562 (7728): 589–594. Bibcode:2018Natur.562..589V. doi:10.1038/s41586-018-0620-2. PMC 6296767. PMID 30356183.
- ^ Kumar J, Rani K, Datt C (2020). «Molecular link between dietary fibre, gut microbiota and health». Molecular Biology Reports. 47 (8): 6229–6237. doi:10.1007/s11033-020-05611-3. PMID 32623619. S2CID 220337072.
- ^ Consolandi, Clarissa; Turroni, Silvia; Emmi, Giacomo; et al. (April 2015). «Behçet’s syndrome patients exhibit specific microbiome signature». Autoimmunity Reviews. 14 (4): 269–276. doi:10.1016/j.autrev.2014.11.009. PMID 25435420.
- ^ Ye, Zi; Zhang, Ni; Wu, Chunyan; et al. (4 August 2018). «A metagenomic study of the gut microbiome in Behcet’s disease». Microbiome. 6 (1): 135. doi:10.1186/s40168-018-0520-6. PMC 6091101. PMID 30077182.
- ^ Cait, Alissa; Hughes, Michael R (May 2018). «Microbiome-driven allergic lung inflammation is ameliorated by short chain fatty acids». Mucosal Immunology. 11 (3): 785–796. doi:10.1038/mi.2017.75. PMID 29067994.
- ^ Furusawa, Yukihiro; Obata, Yuuki; Fukuda, Shinji; et al. (13 November 2013). «Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells». Nature. 504 (7480): 446–450. Bibcode:2013Natur.504..446F. doi:10.1038/nature12721. PMID 24226770. S2CID 4408815.
- ^ Arpaia, Nicholas; Campbell, Clarissa; Fan, Xiying; et al. (13 November 2013). «Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation». Nature. 504 (7480): 451–455. Bibcode:2013Natur.504..451A. doi:10.1038/nature12726. PMC 3869884. PMID 24226773.
- ^ Luu, Maik; Weigand, Katharina; Wedi, Fatana; et al. (26 September 2018). «Regulation of the effector function of CD8+ T cells by gut microbiota-derived metabolite butyrate». Scientific Reports. 8 (1): 14430. Bibcode:2018NatSR…814430L. doi:10.1038/s41598-018-32860-x. PMC 6158259. PMID 30258117.
- ^ Cholan, Pradeep Manuneedhi; Han, Alvin; Woodie, Brad R.; Watchon, Maxinne; Kurz, Angela RM; Laird, Angela S.; Britton, Warwick J.; Ye, Lihua; Holmes, Zachary C.; McCann, Jessica R.; David, Lawrence A. (9 November 2020). «Conserved anti-inflammatory effects and sensing of butyrate in zebrafish». Gut Microbes. 12 (1): 1–11. doi:10.1080/19490976.2020.1824563. ISSN 1949-0976. PMC 7575005. PMID 33064972.
- ^ Vital, Marius; Gao, Jiarong; Rizzo, Mike; Harrison, Tara; Tiedje, James M. (2015). «Diet is a major factor governing the fecal butyrate-producing community structure across Mammalia, Aves and Reptilia». The ISME Journal. 9 (4): 832–843. doi:10.1038/ismej.2014.179. PMC 4817703. PMID 25343515.
- ^ a b c d Wang G (2014). «Human antimicrobial peptides and proteins». Pharmaceuticals. 7 (5): 545–94. doi:10.3390/ph7050545. PMC 4035769. PMID 24828484.
Table 3: Select human antimicrobial peptides and their proposed targets
Table 4: Some known factors that induce antimicrobial peptide expression - ^ Yonezawa H, Osaki T, Hanawa T, Kurata S, Zaman C, Woo TD, Takahashi M, Matsubara S, Kawakami H, Ochiai K, Kamiya S (2012). «Destructive effects of butyrate on the cell envelope of Helicobacter pylori». J. Med. Microbiol. 61 (Pt 4): 582–9. doi:10.1099/jmm.0.039040-0. PMID 22194341.
- ^ McGee DJ, George AE, Trainor EA, Horton KE, Hildebrandt E, Testerman TL (2011). «Cholesterol enhances Helicobacter pylori resistance to antibiotics and LL-37». Antimicrob. Agents Chemother. 55 (6): 2897–904. doi:10.1128/AAC.00016-11. PMC 3101455. PMID 21464244.
- ^ Zimmerman MA, Singh N, Martin PM, Thangaraju M, Ganapathy V, Waller JL, Shi H, Robertson KD, Munn DH, Liu K (2012). «Butyrate suppresses colonic inflammation through HDAC1-dependent Fas upregulation and Fas-mediated apoptosis of T cells». Am. J. Physiol. Gastrointest. Liver Physiol. 302 (12): G1405–15. doi:10.1152/ajpgi.00543.2011. PMC 3378095. PMID 22517765.
- ^ Offermanns S, Schwaninger M (2015). «Nutritional or pharmacological activation of HCA(2) ameliorates neuroinflammation». Trends Mol Med. 21 (4): 245–255. doi:10.1016/j.molmed.2015.02.002. PMID 25766751.
- ^ Chai JT, Digby JE, Choudhury RP (May 2013). «GPR109A and vascular inflammation». Curr Atheroscler Rep. 15 (5): 325. doi:10.1007/s11883-013-0325-9. PMC 3631117. PMID 23526298.
- ^ Graff EC, Fang H, Wanders D, Judd RL (February 2016). «Anti-inflammatory effects of the hydroxycarboxylic acid receptor 2». Metab. Clin. Exp. 65 (2): 102–113. doi:10.1016/j.metabol.2015.10.001. PMID 26773933.
- ^ Farzi A, Reichmann F, Holzer P (2015). «The homeostatic role of neuropeptide Y in immune function and its impact on mood and behaviour». Acta Physiol (Oxf). 213 (3): 603–27. doi:10.1111/apha.12445. PMC 4353849. PMID 25545642.
- ^ Zeng, Huawei; Lazarova, DL; Bordonaro, M (2014). «Mechanisms linking dietary fiber, gut microbiota and colon cancer prevention». World Journal of Gastrointestinal Oncology. 6 (2): 41–51. doi:10.4251/wjgo.v6.i2.41. PMC 3926973. PMID 24567795.
- ^ Chen, Jiezhong; Zhao, Kong-Nan; Vitetta, Luis (2019). «Effects of Intestinal Microbial–Elaborated Butyrate on Oncogenic Signaling Pathways» (pdf). Nutrients. 11 (5): 1026. doi:10.3390/nu11051026. PMC 6566851. PMID 31067776. S2CID 148568580.
- ^ Klampfer L, Huang J, Sasazuki T, Shirasawa S, Augenlicht L (August 2004). «Oncogenic Ras promotes butyrate-induced apoptosis through inhibition of gelsolin expression». The Journal of Biological Chemistry. 279 (35): 36680–8. doi:10.1074/jbc.M405197200. PMID 15213223.
- ^ Vanhoutvin SA, Troost FJ, Hamer HM, Lindsey PJ, Koek GH, Jonkers DM, Kodde A, Venema K, Brummer RJ (2009). Bereswill S (ed.). «Butyrate-induced transcriptional changes in human colonic mucosa». PLOS ONE. 4 (8): e6759. Bibcode:2009PLoSO…4.6759V. doi:10.1371/journal.pone.0006759. PMC 2727000. PMID 19707587.
- ^ Encarnação, J. C.; Abrantes, A. M.; Pires, A. S.; et al. (30 July 2015). «Revisit dietary fiber on colorectal cancer: butyrate and its role on prevention and treatment». Cancer and Metastasis Reviews. 34 (3): 465–478. doi:10.1007/s10555-015-9578-9. PMID 26224132. S2CID 18573671.
- ^ Zimmerman, Mary A.; Singh, Nagendra; Martin, Pamela M.; et al. (15 June 2012). «Butyrate suppresses colonic inflammation through HDAC1-dependent Fas upregulation and Fas-mediated apoptosis of T cells». American Journal of Physiology. Gastrointestinal and Liver Physiology. 302 (12): G1405–G1415. doi:10.1152/ajpgi.00543.2011. PMC 3378095. PMID 22517765.
- ^ Prasanna Kumar, S.; Thippeswamy, G.; Sheela, M.L.; et al. (October 2008). «Butyrate-induced phosphatase regulates VEGF and angiogenesis via Sp1». Archives of Biochemistry and Biophysics. 478 (1): 85–95. doi:10.1016/j.abb.2008.07.004. PMID 18655767.
- ^ «Low-carb diet cuts risk of colon cancer, study finds | University of Toronto Media Room». media.utoronto.ca. Retrieved 4 May 2016.
- ^ Belcheva, Antoaneta; Irrazabal, Thergiory; Robertson, Susan J.; Streutker, Catherine; Maughan, Heather; Rubino, Stephen; Moriyama, Eduardo H.; Copeland, Julia K.; Kumar, Sachin (17 July 2014). «Gut microbial metabolism drives transformation of MSH2-deficient colon epithelial cells». Cell. 158 (2): 288–299. doi:10.1016/j.cell.2014.04.051. ISSN 1097-4172. PMID 25036629.
- ^ Scheppach, W.; Sommer, H.; Kirchner, T.; et al. (1992). «Effect of butyrate enemas on the colonic mucosa in distal ulcerative colitis». Gastroenterology. 103 (1): 51–56. doi:10.1016/0016-5085(92)91094-K. PMID 1612357.
- ^ Robison AJ, Nestler EJ (November 2011). «Transcriptional and epigenetic mechanisms of addiction». Nat. Rev. Neurosci. 12 (11): 623–637. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
- ^ Nestler EJ (January 2014). «Epigenetic mechanisms of drug addiction». Neuropharmacology. 76 Pt B: 259–268. doi:10.1016/j.neuropharm.2013.04.004. PMC 3766384. PMID 23643695.
- ^ a b Walker DM, Cates HM, Heller EA, Nestler EJ (February 2015). «Regulation of chromatin states by drugs of abuse». Curr. Opin. Neurobiol. 30: 112–121. doi:10.1016/j.conb.2014.11.002. PMC 4293340. PMID 25486626.
- ^ Ajonijebu DC, Abboussi O, Russell VA, Mabandla MV, Daniels WM (August 2017). «Epigenetics: a link between addiction and social environment». Cellular and Molecular Life Sciences. 74 (15): 2735–2747. doi:10.1007/s00018-017-2493-1. PMID 28255755. S2CID 40791780.
- ^ Legastelois R, Jeanblanc J, Vilpoux C, Bourguet E, Naassila M (2017). «Mécanismes épigénétiques et troubles de l’usage d’alcool : une cible thérapeutique intéressante?» [Epigenetic mechanisms and alcohol use disorders: a potential therapeutic target]. Biologie Aujourd’hui (in French). 211 (1): 83–91. doi:10.1051/jbio/2017014. PMID 28682229.
External links[edit]
- NIST Standard Reference Data for butanoic acid
Бутират или масляная кислота — продукт жизнедеятельности бактерий кишечника. Но это не просто какашки бактерий. Бутират — питательное вещество, которое очень нужно организму.
Рассказываем, зачем нужна масляная кислота и как увеличить её синтез.
Оглавление
- 1. Что такое масляная кислота и откуда она берётся
- 2. Какие свойства имеет масляная кислота
- 3. Как увеличить синтез бутирата
Узнать, как ваша микробиота синтезирует бутират, можно с помощью Теста микробиоты Атлас.
Бактерии нашего кишечника производят жирные кислоты, витамины и аминокислоты. А они, в свою очередь, положительно влияют на наш организм: укрепляют иммунитет, поддерживают функции слизистой.
Одна из функций микробиоты — расщепление пищевых волокон или ферментация. В организме человека нет ферментов для расщепления сложных углеводов, которые содержатся в основном в растительной пище.
Ферментация способствует образованию метаболитов — продуктов жизнедеятельности бактерий. Среди этих метаболитов и бутират. Это органическое соединение из группы короткоцепочечных жирных кислот.
Бутират — важный источник энергии для организма, который обеспечивает порядка 5–15 % ежедневной нормы калорий.
Согласно статистике, существует взаимосвязь между нарушением метаболизма масляной кислоты и повреждениями слизистой оболочки кишечника. Такая связь наблюдается у пациентов с воспалительными заболеваниями кишечника, такими как язвенный колит и болезнь Крона.
Масляная кислота и её производные в небольших количествах содержатся в сливочном масле и нефти.
- Помогает в работе некоторых генов
- Питает клетки кишечника, колоноциты
- Защищает от воспаления
- Снижает риск развития рака прямой кишки
- Питает полезные бактерии кишечника
- Помогает впитывать электролиты
- Улучшает перистальтику
Бутират положительно влияет на многие процессы в организме. Например, помогает полноценно функционировать некоторым генам, которые отвечают за воспалительные процессы и иммунные реакции.
Масляная кислота обеспечивает до 90% энергии клеток кишечника, колоноцитов, и помогает выполнять их главную функцию — поддерживать целостность стенок кишечника.
Лабораторные исследования на мышах показали, что недостаток бутирата вызывает разрушение колоноцитов. Тем не менее процесс можно остановить, если увеличить производство масляной кислоты.
Бутират подавляет работу слишком активных иммунных клеток, которые повышают риск воспаления. Противовоспалительное действие помогает микробиоте и предотвращает развитие рака прямой кишки.
Масляная кислота стимулирует рост ворсинок на поверхности стенок желудочно-кишечного тракта, а также производство муцина — гелеобразного вещества, которое покрывает стенки кишечника.
Полезные бактерии, например, Akkermansia muciniphila, питаются муцином.
Исследования показывают, что масляная кислота помогает прямой кишке впитывать электролиты, которые необходимы для правильной работы клеток и которые снижают вероятность некоторых типов диареи.
Она также регулирует перистальтику прямой кишки — естественную подвижность желудочно-кишечного тракта, которая помогает проталкивать пищу и усиливает кровоток в кишечнике.
Так масляная кислота помогает сохранить целостность стенок кишечника, которые не позволяют бактериям и токсинам проникать в кровоток из кишечника.
В интернете много сомнительных советов о том, как увеличить концентрацию масляной кислоты в кишечнике. Например, употреблять больше сливочного масла или принимать добавки, которые содержат бутират.
Однако, прямое употребление масляной кислоты не всегда приносит желаемый эффект — желудок может впитать бутират и он не дойдет до толстого кишечника, чтобы дать питание клеткам.
Самый простой способ повысить уровень масляной кислоты — накормить бактерии, которые ее производят.
Главный источник питания для микроорганизмов — пребиотики. Это питательные вещества, которые содержатся в некоторых продуктах. В основном это растительные волокна, но не только.
Разнообразная диета, богатая пребиотическими продуктами, способна увеличить уровень масляной кислоты.
К таким продуктам относятся овощи, бобовые, фрукты и цельные злаки, которые не всегда нам по вкусу, но необходимы для производства масляной кислоты.
Ученые проанализировали микробиоту пациентов с ожирением, которые некоторое время придерживались низкоуглеводной диеты, ограничив употребление растительной клетчатки.
Результаты исследования помогли понять, что при сокращении употребления углеводов концентрация бутирата также уменьшается.
Также ученые выяснили, что количество полезных бактерий отдела Firmicutes, таких как Roseburia и E. rectale, снижается при уменьшении клетчатки в рационе.
Высокопротеиновые, низкоуглеводные диеты, как и диеты с высоким содержанием жира могут нарушить процесс производства масляной кислоты.
Лучший способ поддерживать баланс масляной кислоты — придерживаться рациона с высоким содержанием клетчатки. Это стимулирует определенные бактерии кишечника на производство бутирата в достаточном для организма количестве.
Важно учитывать, что микробиота каждого человека уникальна, и для разных бактерий могут требоваться разные пребиотики.
Тест микробиоты Атлас анализирует уровень бактерий-производителей бутирата и оценивает способность микробиоты синтезировать масляную кислоту. Затем мы составляем список продуктов, которые содержат пребиотики, нужные бактериям для производства бутирата.
- Microbiome, metabolites and host immunity. Current Opinion in Microbiology, 35, 8–15. Levy, M., Blacher, E., & Elinav, E. (2017)
- Implications of butyrate and its derivatives for gut health and animal production.Andrea Bedford, Joshua Gong, Guelph Research and Development Centre, Agriculture and Agri-food Canada (2017)
- From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Cell, 165(6), 1332–1345.Koh, A., De Vadder, F., Kovatcheva-Datchary, P., & Bäckhed, F. (2016).
- Microbiome, metabolites and host immunity. Current Opinion in Microbiology, 35, 8–15. Levy, M., Blacher, E., & Elinav, E. (2017).
- Colonic mucin synthesis is increased by sodium butyrate. Gut. 1995 Jan;36(1):93-9.Finnie IA, Dwarakanath AD, Taylor BA, Rhodes JM (1995).
- Butyrate and the colonocyte. Production,
absorption, metabolism, and therapeutic implications. Adv Exp Med Biol.
1997;427:123-34.Velázquez OC, Lederer HM, Rombeau JL. - Reduced Dietary Intake of Carbohydrates by Obese Subjects Results in Decreased Concentrations of Butyrate and Butyrate-Producing Bacteria in Feces. Applied and Environmental Microbiology, 73(4), 1073–1078. Duncan, S. H., Belenguer, A., Holtrop, G., Johnstone, A. M., Flint, H. J., & Lobley, G. E. (2006).